【醉仁心胸】肺移植术后肺部并发症、移植物损伤和术后死亡率增加的围术期因素分析
时间:2024-10-17 19:01:28 热度:37.1℃ 作者:网络
摘要
研究目的:术后并发症如术后肺部并发症(PPCs)等器官并发症与肺移植手术成功后的发病率和死亡率增加相关,对患者的恢复有不利影响。本研究旨在探讨肺移植患者院内死亡率和术后并发症的围手术期风险因素,重点探讨PPC和移植物损伤的危险因素。
设计:对173例肺移植术患者进行单中心回顾性队列研究。
地点:弗莱堡医学中心,大学医院。
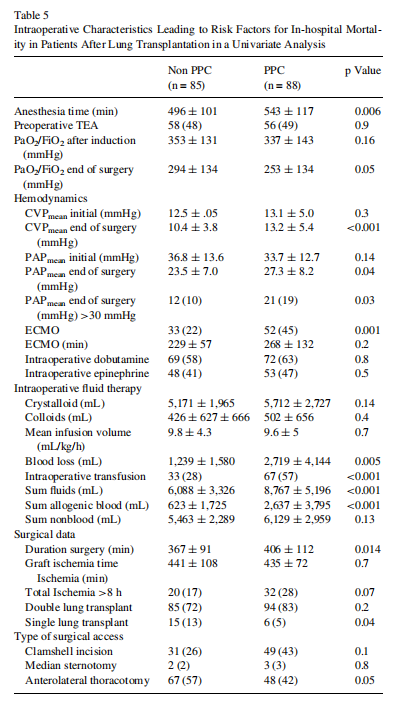
主要结果:在逐步多元回归分析中,供体年龄>60岁(OR,1.85;95%CI,1.27-2.81)、术中体外膜氧合(OR,2.4;95%CI,1.7-3.3)、输血>4单位浓缩红细胞(OR,3.1;95%CI,1.82-5.1),手术结束时平均肺动脉压>30mmHg(OR,3.5;95%CI,2-6.3)、术后移植物损伤(OR,4.1;95% CI,2.8-5.9)、PPCs (OR,2.1;95%CI,1.7-2.6)、脓毒血症(OR,4.5;95%CI,2.8-7.3)和肾脏疾病改善预后分级系统3期急性肾功能衰竭(OR,4.3;95%CI,2.4-7.7) 与住院死亡率增加相关,而慢性阻塞性肺疾病患者的住院死亡率较低(OR,1.6;95% CI,1.4-1.9)。PPCs发生的频率和数量与术后死亡率相关。
结论:临床管理和风险分层侧重于已确定的潜在因素,有助于改善患者的预后。
导语
肺移植是终末期肺病患者的最终治疗方法,但与其他实体器官移植相比,长期生存率有限,平均5年生存率为59%,而肾移植的5年存活率为81%。围手术期对这些高危患者至关重要,因为术中、术后早期并发症会降低移植物和患者的存活率,导致肺移植患者的高发病率。肺部和移植物并发症(PGD),发病率为 30%,是最常见的并发症之一,但有关导致这些术后并发症及相关结果的围手术期风险因素的数据有限。本研究旨在分析以术后院内死亡率为主要终点,以术后肺部并发症(PPCs)和移植物并发症为次要终点的风险因素。
方法
从2012年1月到2022年12月,在弗莱堡大学医院对所有年龄大于18岁、接受肺移植手术的患者进行了回顾性分析。弗莱堡大学医学中心是一家大型三级医院(床位数超过1,500),同时也进行肾脏和心脏移植。在此研究期间,每年进行8至24例肺移植手术。该研究得到了弗莱堡大学医院伦理委员会的批准。根据本研究的回顾性性质,我们被豁免知情同意。本研究分析了电子病历:患者的人口统计学特征、患者相关变量和术前特征。筛选手术和麻醉报告,并收集来自重症监护病房(ICU)的记录和术后监护病房的术后数据,并进行分析。
麻醉管理
所有患者均接受了全身麻醉和单肺通气。常规放置Swan-Ganz导管;但并非所有患者均进行经食道超声心动图检查。体外膜氧合(ECMO)用于以下情况:存在需要体外支持的预测因素;诱导和随后的单肺通气测试后发现心肺功能不稳定;或术中出现问题。除2例V-V ECMO外,所有患者均为V-A ECMO。使用肝素以达到ACT160秒-180秒之间,为手术内ECMO回路提供抗凝。移植物植入后停用V-A ECMO。再灌注策略包括吸入一氧化氮、吸入伊洛前列素(PGI2)和使用多巴酚丁胺。采用围手术期血栓弹力测定指导的止血治疗和限制性输血策略,目标手术结束时血红蛋白值大于 8 g/dL。
外科管理
对移植类型(单双肺移植)和手术切口类型进行研究。未纳入联合移植,仅纳入1例再次移植手术。记录手术时间和失血量。
术后病程
计算ICU住院时间和总住院时间。存活率从移植手术当天开始计算到被报告还活着的最后一天。院内死亡率定义为初次出院前的死亡;未调查再入院率。
PPC
① 肺炎。
② 血胸。
③ 术后胸腔积液。
④ 术后气管切开。
⑤ 术后通气>14天,包括无创通气,但不包括高流量氧疗。
⑥ 根据国际心肺移植协会的定义,PGD等级为 1 级和 2 级。
移植物损伤
① 急性排斥反应(组织病理学诊断)。
② PGD根据国际心肺移植协会的定义被评为3级。
③ 同种异体移植气道并发症(裂开、狭窄)。
其他并发症
① 心血管并发症(心律失常、非心脏手术后心肌损伤、心肌缺血,心力衰竭)。
② 胃肠道并发症(胃肠道梗阻、缺血)。
③ 神经系统并发症(中风、谵妄、惊厥、意识水平下降)。
统计
数据分析使用IBM SPSS Statistics for Windows(23.0 版,IBM 公司,纽约州阿蒙克市)。仅对完整的数据集进行分析,无法获得所有患者的特定参数的详细信息,例如超声心动图数据、再灌注时吸入一氧化氮的确切剂量以及合并症信息,则不对这些数据进行分析。将两组分组后进行单因素统计分析。所有连续计量资料均报告为平均±标准差,并采用Mann-Whitney U检验进行分析。计数资料采用百分比和数字,并适当使用皮尔逊卡方检验或Fisher精确检验进行分析。p值为<0.05为显著性。多变量分析采用逻辑逐步 回归法进行多变量分析,包括单变量分析的显著结果,p值为<0.01。生存率计算采用Kaplan-Meier分析和对数秩检验。
结果
从2012年1月至2022年12月,173例患者在弗莱堡大学医院接受了肺移植,移植后初次住院时间的术后死亡率为15%(26/173)。人口统计学数据见表1。86例女性和87例男性患者接受了单肺移植(18例单肺移植,155例双肺移植)。导致肺移植的主要诊断为慢性阻塞性肺疾病(COPD[41%]),其次是间质性肺疾病(27%)。患者的平均年龄为57.7岁,平均BMI为23.5。
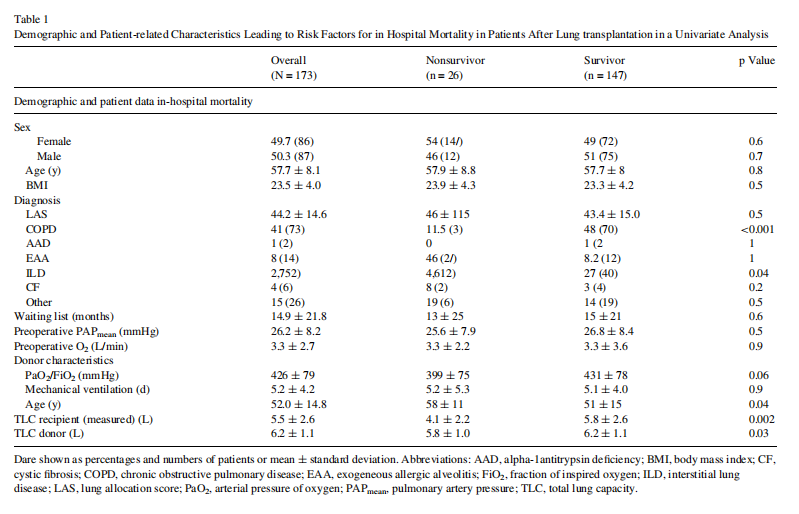
住院死亡率
在供体和受体的人口统计学资料上,存活者和非存活者之间的主要差异见表1。在非存活者中,间质性肺病(p= 0.04)、供体年龄较大(p= 0.04)、受体总肺容量较低(p=0.03)和供体总肺容量较低(p= 0.002)的发生率更大。根据多变量分析,供体年龄<60岁(OR,1.85;95%CI,1.27-2.81)和COPD作为进行肺移植的主要原因( OR,1.6;95% CI,1.4- 1.9)是与院内死亡率降低相关的因素(图1)。
术中数据见表2。在非存活者中,麻醉时间更长(p< 0.001)、诱导后氧合指数更低(动脉氧压/吸入氧分数)(p=0.013)、 移植后手术结束时的平均肺动脉压(PAPmean)较高(P < 0.001)、使用多巴酚丁胺支持(p<0.04)、术中使用体外膜循环(ECMO)(p< 0.001)。管理的差异包括更大的失血量(p< 0.001)、总晶体输注量(p=0.03)以及所有类型的输血产品(p< 0.001)。在非存活者中,较长的手术时间(p< 0.001),蛤壳形切口类型比例更高(p = 0.02),8小时后移植物缺血率较高(p=0.04)。逐步逻辑回归显示,>4单位输注红细胞(OR3.1;95%CI,1.82-5.1)、手术结束时PAP平均值为>30mmHg(OR3.5 ;95%CI , 2.0-6.3 )和 术中 使用ECMO (OR2.4 ;95%CI1.7-3.3)是住院死亡率的独立危险因素。
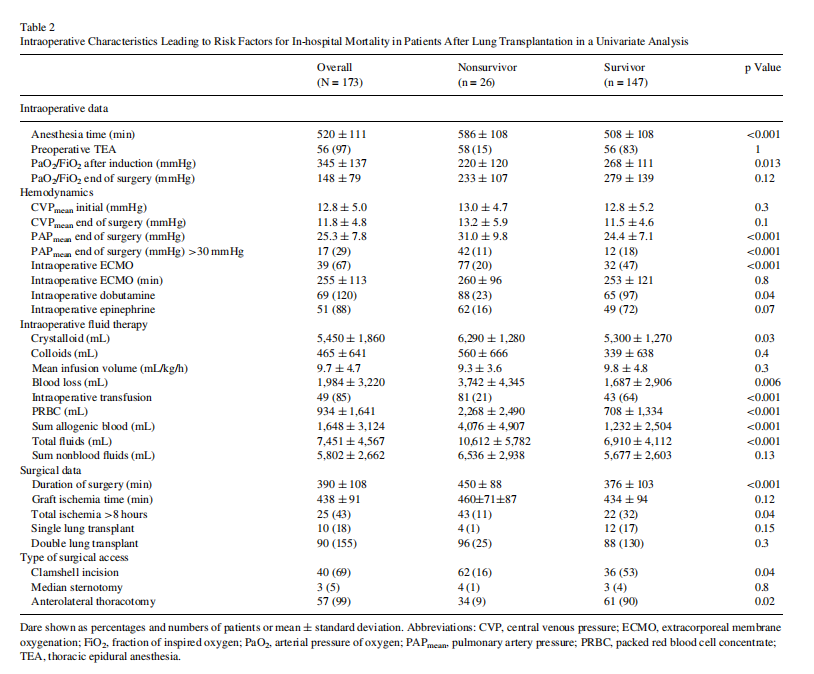
术后各项并发症的发生率和类型见表3。PPCs(p<0.001)和移植物损伤(p <0.001)的发生率和数量增高与死亡率增加相关。ICU住院时间缺乏差异可能是过早死亡和ICU住院结束的影响。逐步逻辑回归分析显示移植物损伤(OR,4.1;95%CI,2.8-5.9)、PPC(OR,2.1;95%CI,1.7-2.6)、脓毒症(OR,4.5;95% CI,2.8-7.3)和急性肾功能衰竭(肾脏疾病改善结局分级系统第3期)(OR,4.3;95%CI,2.4-7.7)作为术后院内死亡的独立因素。
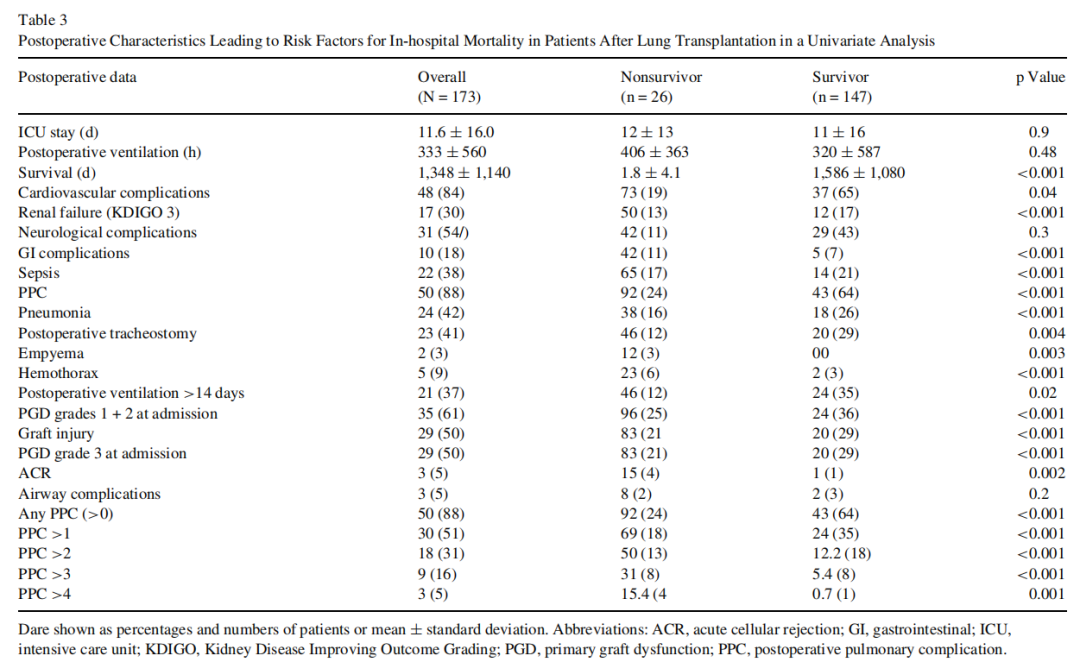
PPC的风险因素
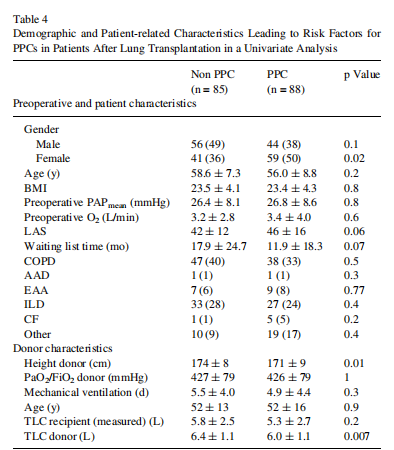
有PPCs(=88)和无PPCs(=85)的患者的人口统计学特征见表4。女性受试者更有可能有PPCs(p=0.02)。供体人身高越高,供体肺总量越大,PPC的发病率就越低(此处原文为越高,结合表4应为笔误)。
比较有PPC和无PPC的患者的术中特征见表5。有PPC组的患者有:更长的麻醉和手术时间(p = 0.006/p = 0.014),更高的手术结束时的中心静脉压(CVP)(p<0.001),更高的手术结束时的 PAPmean(p=0.04),和更低的PAPmean 下降幅度(以初始 PAPmean/ 结束PAPmean 的较低比率表示)(p=0.04)。PPC 组患者的失血量、异体输血率和输血量较高(P < 0.05)。
逐步逻辑回归分析显示,异体输血(OR,1.49;95%CI ,1.27-1.7)和手术结束时更高的CVP(OR,1.6;95%CI,1.2-2.1)是PPC的独立术中危险因素。心血管(p=0.04)、肾脏(p<0.001)和胃肠道并发症(p<0.001)在 PPC 患者中的发生率明显更高 (表3)。PPC组移植物损伤率和住院死亡率均增加。
术后比较显示,心血管疾病(OR,1.5;95% CI,1.1-2.4)、肾脏疾病改善预后分级系统3期急性肾功能衰竭(OR,1.3;95%CI,1.1-1.5)和术后脓毒症(OR,1.60;95%CI,1.3-1.9)与PPC独立相关。
移植物损伤的风险因素
表S1、S2、S3显示了有移植损伤患者和无移植损伤患者之间的相关差异。单因素分析显示,更高的供体人身高、更大的供体和受体肺总量(均p<0.001)和(原发病)慢性阻塞性肺病(p = 0.002)与较低的移植损伤发生率相关。
术中差异因素是麻醉持续时间较长,诱导后(p =0.04)和手术结束时的PaO2/FiO2更低,CVP更高(p=0.009),手术结束的PAPmean更高(p< 0.001),术中使用ECMO(p< 0.001),失血量更高和输异体血液制品更多,更长的手术时间(均p<0.001),移植物缺血时间>8小时的发生率更高(p = 0.01)。根据多变量分析,术后PAPmean>30mmHg(OR1.5;95%CI,1.1-2.1)和失血>2000mL(OR1.6;95% CI,1.2-2.1)与移植物损伤的的独立风险因素。
单因素分析后的术后差异为:较长的ICU住院时间(p<0.001)、较长的术后通气时间(p<0.001)、较高的院内死亡率(p<0.001)、所有心血管、肾脏、胃肠道(所有p<0.001)、神经系统(p=0.01)并发症、脓毒症(p<0.001)和PPCs(p<0.001)的发生率较高。移植物损伤患者的院内死亡率和90天死亡率均有增加(p< 0.001)。与移植物损伤密切相关的术后因素为脓毒症(OR、1.9;95%CI、1.0、5-2.6)和PPCs(OR、1.9 ;95% CI,1.4-2.6)。
讨论
本研究对过去 10 年肺移植患者的数据进行了回顾性分析,结果显示院内死亡率为 15%。其他作者报告的死亡率在 5.5%(30 天死亡率)和 >20%之间,但大多数研究关注的是中长期生存率上。本研究决定选择院内死亡率而非30天死亡率作为终点,是基于住院时间的差异和可能遗漏的死亡率。
与术中和麻醉管理相关的风险因素
由于肺移植的数量有限、患者群体异质性以及大型对照研究的缺乏,关于肺移植术中麻醉管理的影响的数据尽管越来越多,但仍然有限。本研究表明,麻醉持续时间明显较长的患者术后死亡率、PPC 和移植物损伤会增加。可以认为麻醉持续时间是手术过程可能更复杂的次要结果,并不是主因,但具体原因只能从我们的数据中推测。手术持续时间与术中失血量相关,但我们的数据无法确定胸膜粘连或血管损伤等其他因素。
基础疾病可以解释诱导后氧合指数的差异,因为代表大多数幸存者的COPD患者,诱导后的氧合减少通常少于其他情况的患者,如间质性肺病。
术前使用胸椎硬膜外麻醉(TEA)对术后结果无影响。根据作者所在医院的机构指南,术前 TEA 在麻醉诱导前(56% 的患者)或术后第 1 天或第 2 天进行。术前接受TEA的患者与未接受TEA的患者的死亡率、PPC或移植物损伤均无显著差异,术后通气时间、尤其是肺炎发生率相当。有一些报道表明了TEA的有益作用,特别是在术前使用时。我们的数据显示了结果不明确。由于>90%的患者在术后第3天前使用TEA,术前使用的影响将限制在非常短的时间内,因此,从临床统计的角度来看,影响可能很小。此外,导致PPCs和其他并发症的危险因素可能比开放非移植胸腔手术更复杂,也更不容易被TEA影响。虽然TEA可能提供最佳的镇痛效果,但由于ECMO在肺移植中的应用增加,而支持TEA使用的数据有限导致其在一些中心的使用减少。
输液治疗和异体输血是PGD和肺移植后延迟康复的风险因素。我们的数据显示,术后即刻死亡的患者输注了较多的晶体液,但 PPC 或 PGD 患者没有这种情况。一种更复杂的方法是将输液量作为手术持续时间和体重的函数来计算,但该方法并未显示出任何差异。此外,两组患者的输液量相当,这与其他报道一致。
然而,异体输血在总容量和不同血液成分的输血量均存在显著差异,死亡率、PPCs和PGD也有显著差异。在本研究中,输注大于4单位异体红细胞是死亡的一个重要危险因素。肺移植中异体输血的负面影响(如免疫导致异体移植物功能障碍)是众所周知的。在我们的回顾性研究中,同种异体输血的内在影响和失血量的明显增加(表明更复杂的手术)之间没有明显的分离,这在其他研究中也可能如此,这让人怀疑输血本身是可变风险因素。限制性输血算法和目标导向止血方案当然值得推荐,但在大量失血的情况下,恢复体内稳态是至关重要的。
在单变量分析中,蚌壳切口作为手术入路类型与死亡率增加有关。其他作者报道了经前外侧开胸切口行肺经移植术后,手术创伤减少,移植后恢复情况有所改善。从我们的数据来看,不能排除选择性偏差,因为69%通过蚌壳切口手术的患者需要静脉ECMO(经侧胸肺移植的患者为<20%),且围术期出血量明显增加。
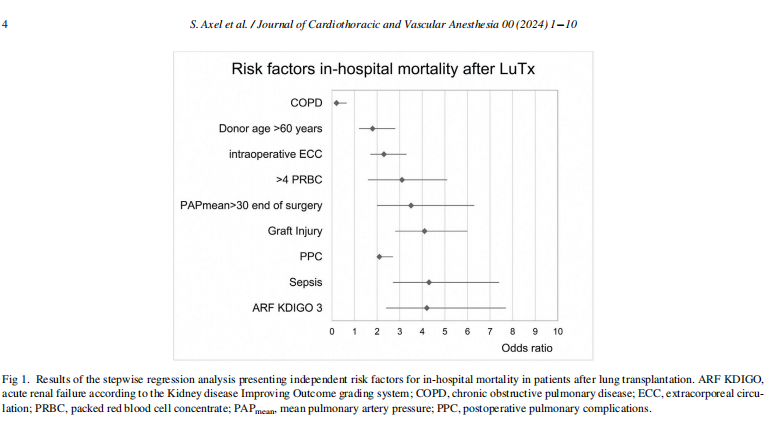
一个有趣的发现是植入后肺动脉压力的平均压力水平显著升高,而PAP水平下降较低(图2)。本研究中,两组患者在麻醉诱导后和移植物植入前的PAPmean水平相当。在麻醉诱导后和脱离体外支持后测量PAP。术前肺动脉高压与术后PGD与其他并发症之间的相关性是众所周知的。我们观察到的植入术后肺动脉高压可能与肺血管阻力和右心张力较高有关,也可能与相对高灌注或高血容量有关。手术结束时PPC和移植后损伤组的CVP值更高可能符合这一假设,表明其机制比单纯高血容量导致CVP升高更复杂。然而,在缺乏完整的心-肺血管阻力、心输出量和超声心动图数据的情况下,这些观察结果仍然是假设的。肺血管阻力是复杂生理学中的一个单一参数,但持续监测肺血管阻力在大多数移植手术中都是可行的,并可作为一个指标,指导治疗方案,如吸入肺血管扩张剂(如吸入一氧化氮)、前列腺素或血管扩张剂。初步控制再灌注以减少移植物上的机械和分子压力的概念已被证明对术前肺高压的患者有益,但也可能是对移植物植入后出现肺血管阻力增加的患者的合适策略。
术中使用体外循环(ECMO和CPB)是一个可能与并发症相关的因素,这取决于支持的类型和其他因素。我们的数据显示,术中使用ECMO有很大的风险,但应该考虑一些因素,如通常表明患者病情更重或更复杂的手术,因此有显著的围手术期风险。近年来,尽管一些大型医学中心的数据支持术中ECMO术后的长期和短期结果,汉诺威研究小组也报告了院内生存率的下降。
在我们的队列中,已观察到围手术期并发症的增加(围手术期失血量和输血,术后并发症等如PPC和心血管、肾脏和神经系统并发症),可能导致增加死亡率。
术后数据
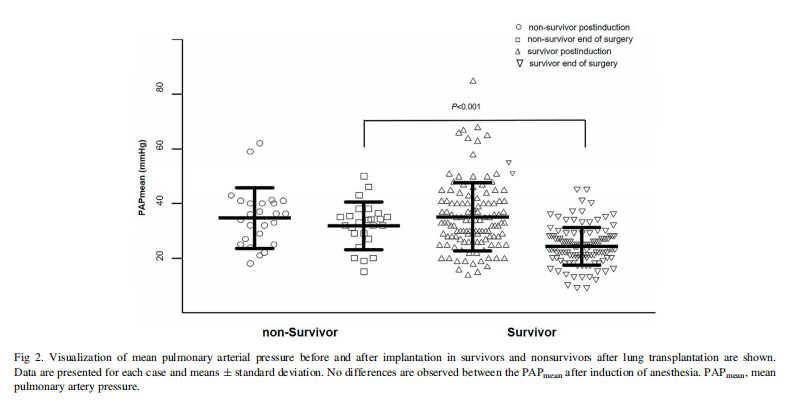
死亡率受并发症发生率的影响,PPCs、脓毒症、心脏并发症、严重急性肾功能衰竭和PGD均为院内死亡率的独立因素(图3)。我们的数据是最早之一显示肺移植特异性PPCs的。其相关性很清楚,因为我们能够证明PPCs的发生率和数量与院内死亡率显著相关。26例无PPCs的患者中只有2例在术后住院期间死亡。
在死亡患者中,PGD 1 级和 2 级以及肺炎是最常见的 PPCs,并且与存活率相关。尽管PGD被认为是一种肺部并发症,因此被纳入了我们的PPC定义,但对于PGD 1级和2级对死亡率的确切影响仍缺乏共识。我们的数据证实了 PGD 的总体不利影响,这也是因为诊断是在比较入院时的放射学检查结果和氧合指数后得出的。其他术中病变的额外影响,如肺不张,可以解释在这个早期阶段PGD的高发病率。所有患者入院时都保证同时进行胸片和动脉血气分析,这也是我们选择该时间点的原因。诊断免疫功能低下患者的肺炎并将其与其他肺部并发症区分开来可能很困难,这导致了不同的发病率和预后,尽管由于同时进行免疫抑制治疗,肺炎对肺移植术后预后的影响显而易见。在我们的研究中,诊断需要充分的微生物检查结果,这提高了诊断的准确性和特异性。
术后通气时间过长是导致并发症的一个已知风险因素。要区分导致通气时间延长的因素和通气时间延长导致的因素通常比较困难。因此,通气时间延长可能反映了术前、术中和术后因素的影响,并且相互关联。由于术后气管切开可能是在通气时间延长后进行的,因此可将其解释为继发现象,显示出更复杂的呼吸过程。肾功能衰竭、心脏并发症和脓毒症的发生率也与PPC相关。从我们的回顾性数据中,既不能推断出因果关系,也不能推断出时间关系。几种机制有可能,如肾衰竭导致高血容量、肺充血和肺炎,但也有可能肾衰竭是肺脓毒症的后果。这些并发症之间的相关性纯粹是统计学上的,但却强调了并发症的预防、早期发现和后续治疗策略的重要性。
移植物损伤是术后和总生存率的重要风险因素。PGD 3级是移植物损伤最常见的参数;对移植物的早期和长期影响是有据可查的。在我们的数据中,气道并发症的发生率相当低,尽管有报道其对生存率的影响不确定。在我们的研究中,我们发现急性排斥反应率与术后死亡率之间存在明显的相关性,但不排除对于危重患者会更早怀疑并检查发现的偏倚。
以下因素增加了移植物损伤的可能性:同种异体输血超过4个单位,移植后PAPmean>30mmHg,术后脓毒症和PPCs。正如此前已提及,输血和移植后肺动脉高压似乎至少是部分可改变的因素,因此可以作为改善的目标。从我们的数据中可以看出,PPC、脓毒症和PGD 3级之间可能的相互依赖是清楚的,但从临床角度来看,PGD 3级(我们研究中最常见的移植物损伤类型)先于大多数PPCs和术后并发症。我们的研究只能发现这些并发症与移植损伤之间有很强的相关性,对于其风险因素的定义仍有待商榷。我们的研究结果更倾向于并发症发生后产生的恶性循环的假设,从而更容易进一步发生并发症。
局限性
研究的回顾性特征和相对的研究规模小是本研究的局限性。尽管这些数据代表了一个较小的标准化管理中心的经验,但将我们的经验推广到其他机构的可能性有限。由于我们的队列中没有原发性肺动脉高压患者,囊性纤维化患者也很少,而且主要是慢性阻塞性肺病患者,因此必须考虑到显著的差异。这进一步限制了与其他中心的比较。在我们的研究中没有出现合并症,这是由于缺乏涵盖所有患者合并症的完整数据,我们决定不显示不完整的数据。
我们对PPC的认识包括PGD的1级和2级。除了讨论中提到的问题外,有些很难区分,有些重叠不能完全排除;然而,由于放射医生和胸外科医生会独立评估每个胸片,我们试图尽可能地提高选择性。术后气管切开术不一定由于呼吸原因进行。我们的研究确定术后气管切开术定义为PPC,这是基于绝大多数气管切开术都是在早期进行的,以促进需要延长有创通气的患者的呼吸脱机。我们的研究期间包括COVID流行。我们注意到,仅在开始时移植数量有所减少,之后的结果与以前相当。我们的数据中没有因为原发性冠状病毒感染诱导的急性呼吸呼吸不良综合征而进行的移植。如果我们的研究结果是否受到了COVID的影响,目前还不清楚。我们的数据只包括移植后出院前的数据,二次入院和初次出院后的发病率和死亡率不在我们的研究范围。
结论
通过对这些数据的解读,可以得出哪些围手术期因素导致并发症、移植物损伤和死亡率。很明显,术中和术后的复杂过程会增加负担,并危及移植物和患者的存活。我们研究了肺移植术后住院死亡的以下危险因素:无慢性阻塞性肺病受者、供体年龄>60岁、术中使用ECMO、输血>4单位、PPCs、移植损伤、脓毒症和严重肾功能衰竭。虽然受体和供体器官因素很少是可以改变的,但审慎地使用ECMO、目标导向止血和限制性输血可以整合到围手术期管理中。移植后 PAP 是术后诊断和治疗的重要参数,其数字的增长在术后诊断和指导治疗中都是一个有价值的参数。预防、及时和积极治疗术后并发症,以及针对我们研究中报告的潜在因素进行预防,可以改善肺移植受者的预后。
原始文献
Axel S, Moneke I, Autenrieth J, Baar W, Loop T. Analysis of Perioperative Factors Leading to Postoperative Pulmonary Complications, Graft Injury and Increased Postoperative Mortality in Lung Transplantation. J Cardiothorac Vasc Anesth. 2024 Aug 8:S1053-0770(24)00521-4. doi: 10.1053/j.jvca.2024.08.002. Epub ahead of print. PMID: 39214800.


