【Nat Med】BCMA/CD3双抗Elranatamab的注册研究结果
时间:2023-08-18 21:37:29 热度:37.1℃ 作者:网络
Elranatamab
蛋白酶体抑制剂(PI)、免疫调节剂(IMiD)和抗CD38单克隆抗体改变了多发性骨髓瘤的治疗现状,但如果患者在用过这三类药后仍发生疾病进展,则预后较差,中位PFS仅有4.6个月,中位OS仅有12.4个月。复发或难治性多发性骨髓瘤(RRMM)患者存在极大的未满足医疗需求,而近年出现的T细胞重定向疗法在这一患者人群中显示出了希望。
B 细胞成熟抗原 (BCMA)是治疗多发性骨髓瘤的理想靶点。许多 BCMA 靶向治疗(包括belantamab mafodotin、Idelabtagene vicleucel(ide-cel)、ciltacabtagene autoleucel(cilta-cel) 和teclistamab、elranatamab)已在临床试验中显示出疗效,并获批用于治疗复发性或难治性多发性骨髓瘤。
Elranatamab(辉瑞) 是一种人源化双特异性抗体,靶向BCMA(骨髓瘤细胞)和CD3(T细胞),在RRMM中具有较好的安全性和疗效。基于注册MagnetisMM-3 2期研究,2023年8月14日FDA加速批准Elranatamab用于治疗既往接受过至少4种疗法(包括PI、IMiD和抗CD38单克隆抗体)的RRMM成人患者,是继强生的teclistamab之后,全球第二款获批上市的CD3/BCMA双特异性抗体。
MagnetisMM-3研究分两个队列,队列A为既往未接受过 BCMA 靶向治疗的患者,队列 B 入组既往接受过BCMA治疗的患者。《Nature Medicine》近日发表了MagnetisMM-3研究队列A随访约15个月的结果,现整理如下供各位老师参考。

研究设计
MagnetisMM-3 是一项正在进行的多中心、开放标签、单臂、2期研究,评估elranatamab 在成人RRMM患者中的疗效和安全性。患者必须对至少一种PI、一种IMiD和一种抗 CD38 抗体难治,并且复发或对末线抗骨髓瘤方案难治。其中队列 A 中的受试者既往不得接受过靶向 BCMA 治疗,而队列 B 的患者必须接受过既往靶向 BCMA 抗体-药物偶联物或 BCMA CAR T 细胞治疗。
28天/周期,患者在第1周期第1天和第4天接受两次递增预充剂量 12mg 和 32mg elranatamab后,接受76mg皮下给药每周一次(仅前4例患者在第1天接受 44 mg 单次预充剂量,然后从第8天开始接受 76 mg 全剂量)。6个周期后,持续缓解者(≥部分缓解 (PR)持续至少2个月)转换为每2周一次 (Q2W) 的给药间隔。
主要终点为盲态独立中心审查 (BICR) 根据 IMWG 标准评估的客观缓解率 (ORR),次要终点包括 BICR 评估的基线髓外病变状态的ORR、研究者评估的ORR、完全缓解 (CR) 率(定义为≥CR)、至缓解时间 (TTR)、缓解持续时间 (DOR)、≥CR的缓解持续时间 (DOCR)、微小残留病 (MRD) 阴性率、PFS、OS、安全性、药代动力学和免疫原性。
研究结果
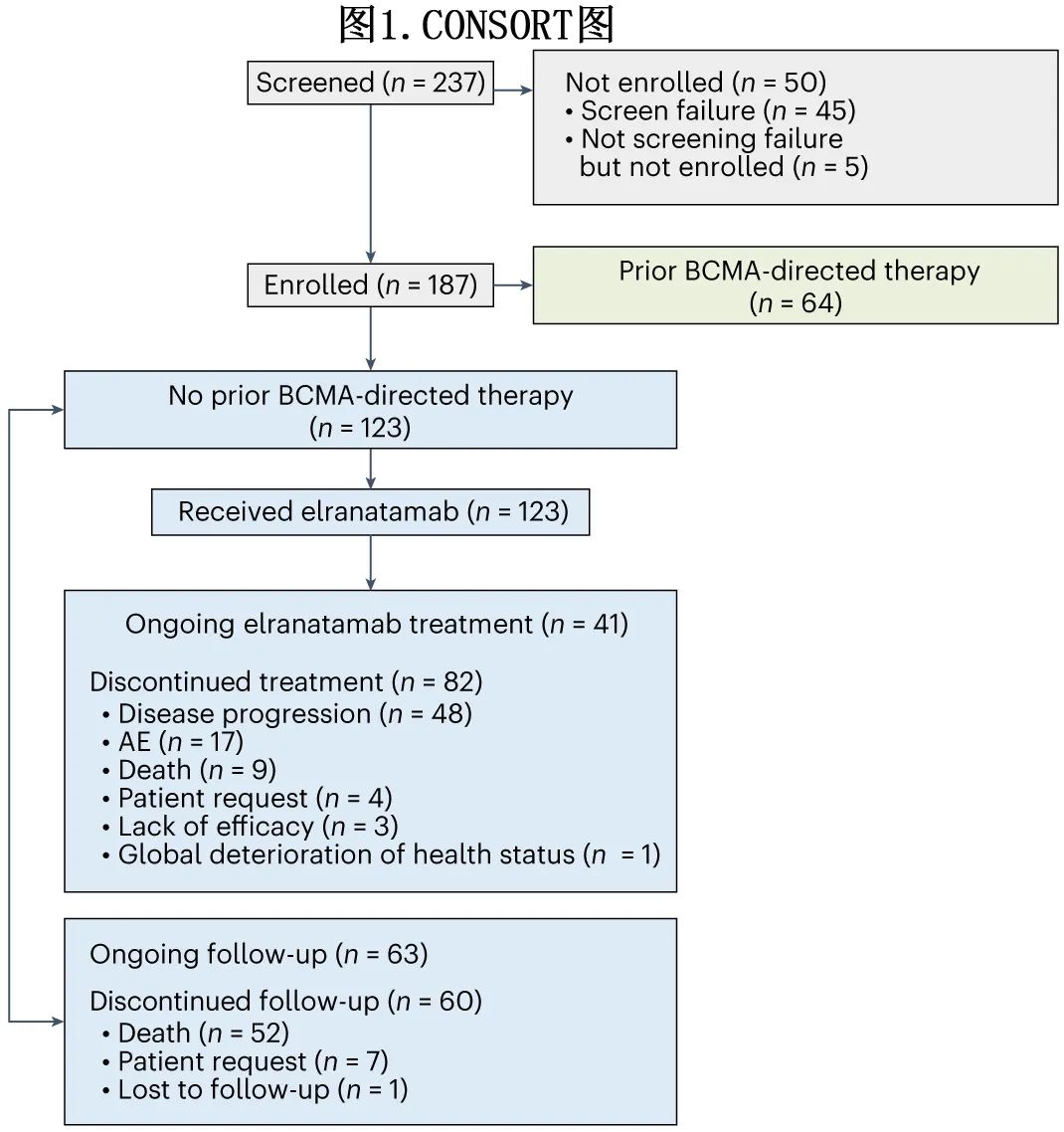
队列A共入组123例患者(图1)。
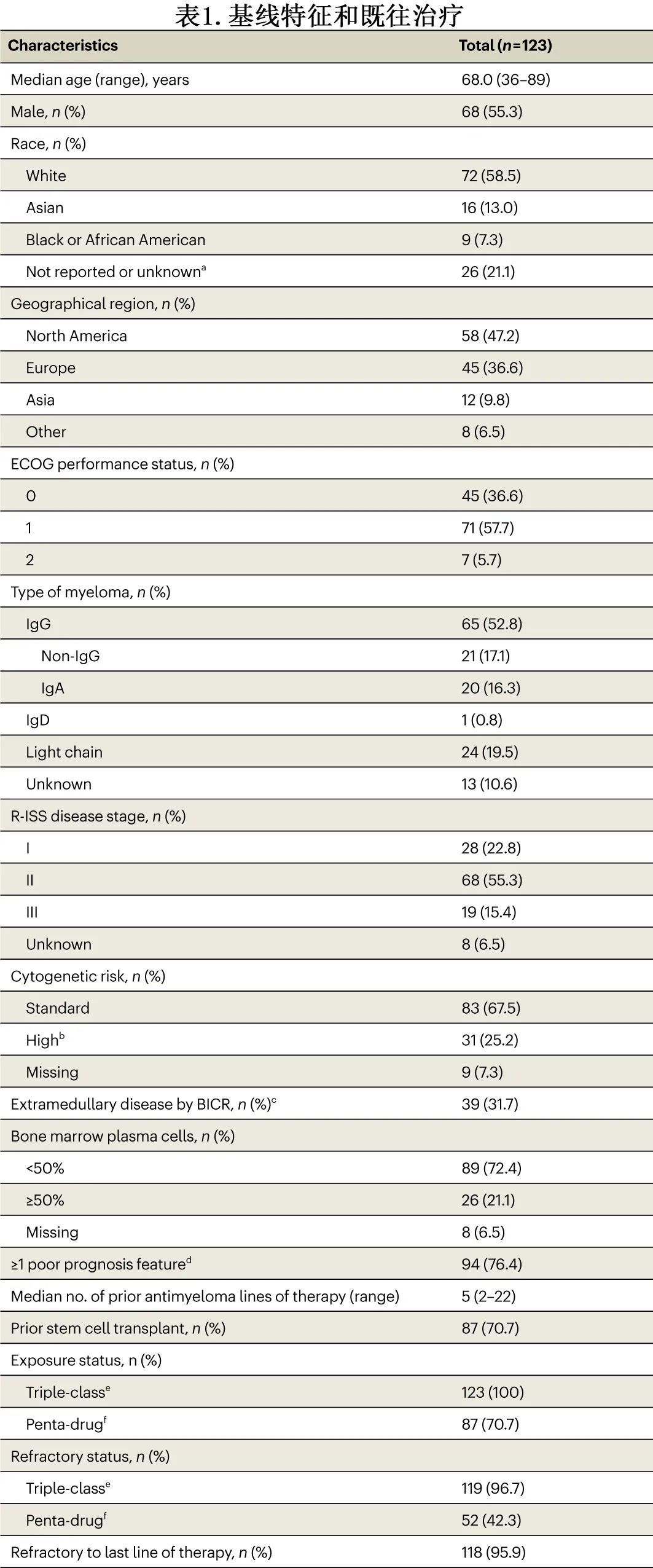
中位年龄为68岁,55.3%为男性,58.5%为白人,13.0%为亚裔,7.3%为黑人/非裔美国人(表1)。基线时,63.4%的患者 ECOG 体能状态为1或2,15.4%的患者为R-ISS III 期,25.2%的患者具有高危细胞遗传学,定义为t(4;14)、t(14;16) 或del(17p)。31.7%的患者存在髓外病变,定义为存在任何浆细胞瘤(具有软组织成分的髓外和/或髓旁),由 BICR 评估。总体而言,76.4%至少有一个不良预后特征(表1)。患者既往接受过中位5线治疗,96.7%为三重难治(triple-class refractory),42.3%为五药难治(penta-drug refractory,对至少两种蛋白酶体抑制剂、两种免疫调节剂和一种抗 CD38 抗体难治)。
截至2023年03月14日,33.3%的患者仍在接受elranatamab治疗(图1)。中位治疗持续时间为5.6个月(范围:0.03-24.4个月),48.0%接受了≥6个月治疗,35.8%接受≥12个月治疗。所有治疗周期的中位相对剂量强度为78.4%。永久停止治疗的最常见主要原因是疾病进展 (PD)/缺乏疗效 (41.5%) 和AE(13.8%)。
主要和次要疗效终点
中位随访14.7个月后达到主要终点,61.0%的患者经 BICR 证实达到客观缓解。最佳总体缓解见图2a。35.0%的患者达到≥CR,56.1%的患者达到≥非常好的部分缓解 (VGPR)。分析时9例 (7.3%) 缓解者仍在接受治疗且尚未达到CR。在≥CR且MRD可评估的患者 (n=29) 中,89.7%达到 MRD 阴性,相当于≥CR患者中60.5%达到MRD阴性。R-ISSⅠ-Ⅱ期患者和无髓外病变或五重难治患者的 ORR 较高,其他各亚组的缓解率一致,包括基线时骨髓浆细胞≥50%的患者和高危细胞遗传学患者 (图2b)。
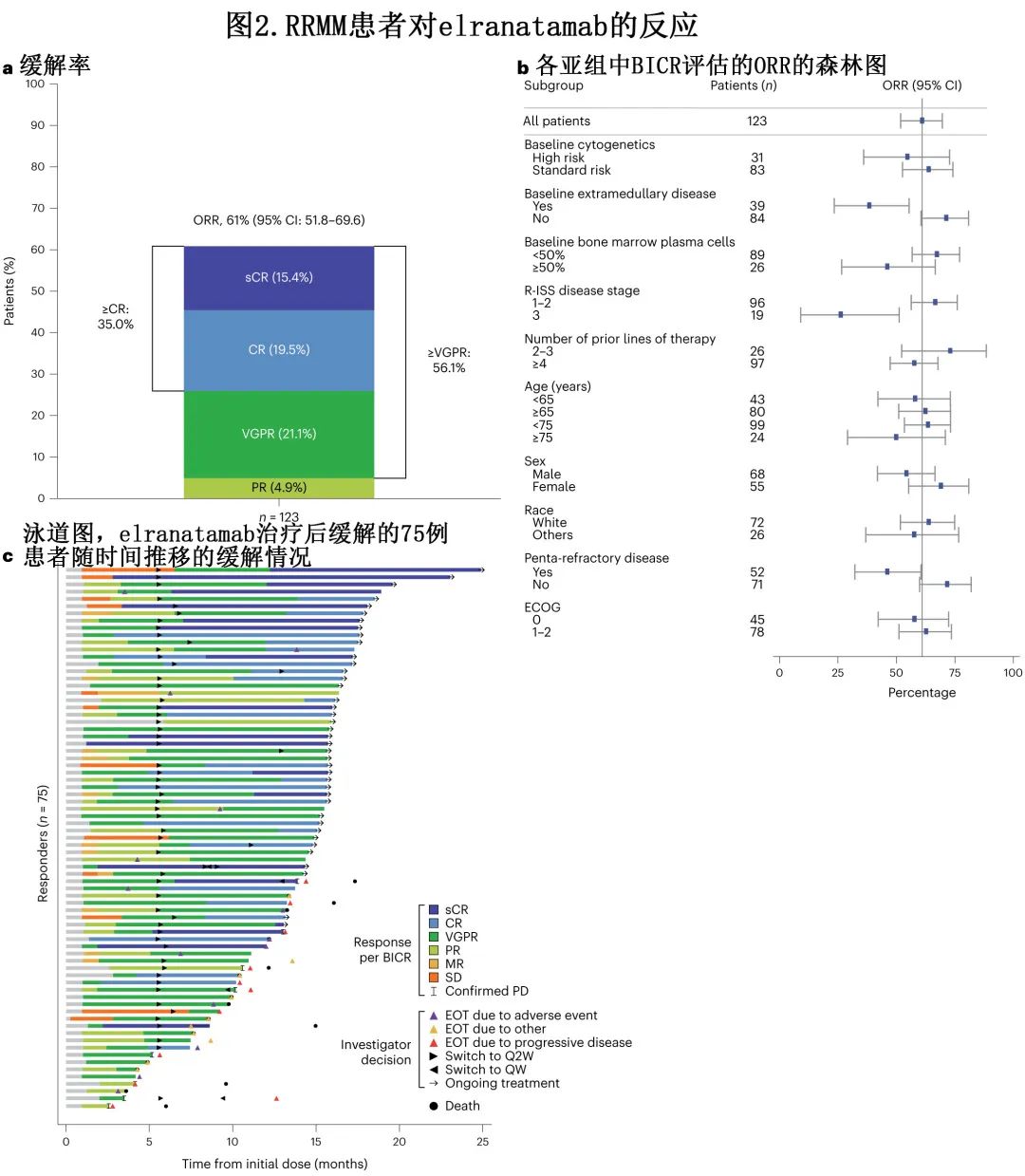
缓解者的中位 TTR 为1.2个月,且随着时间的推移反应会加深(图2c)。缓解者未达到中位DOR,56例 (74.7%) 患者在分析时删失。
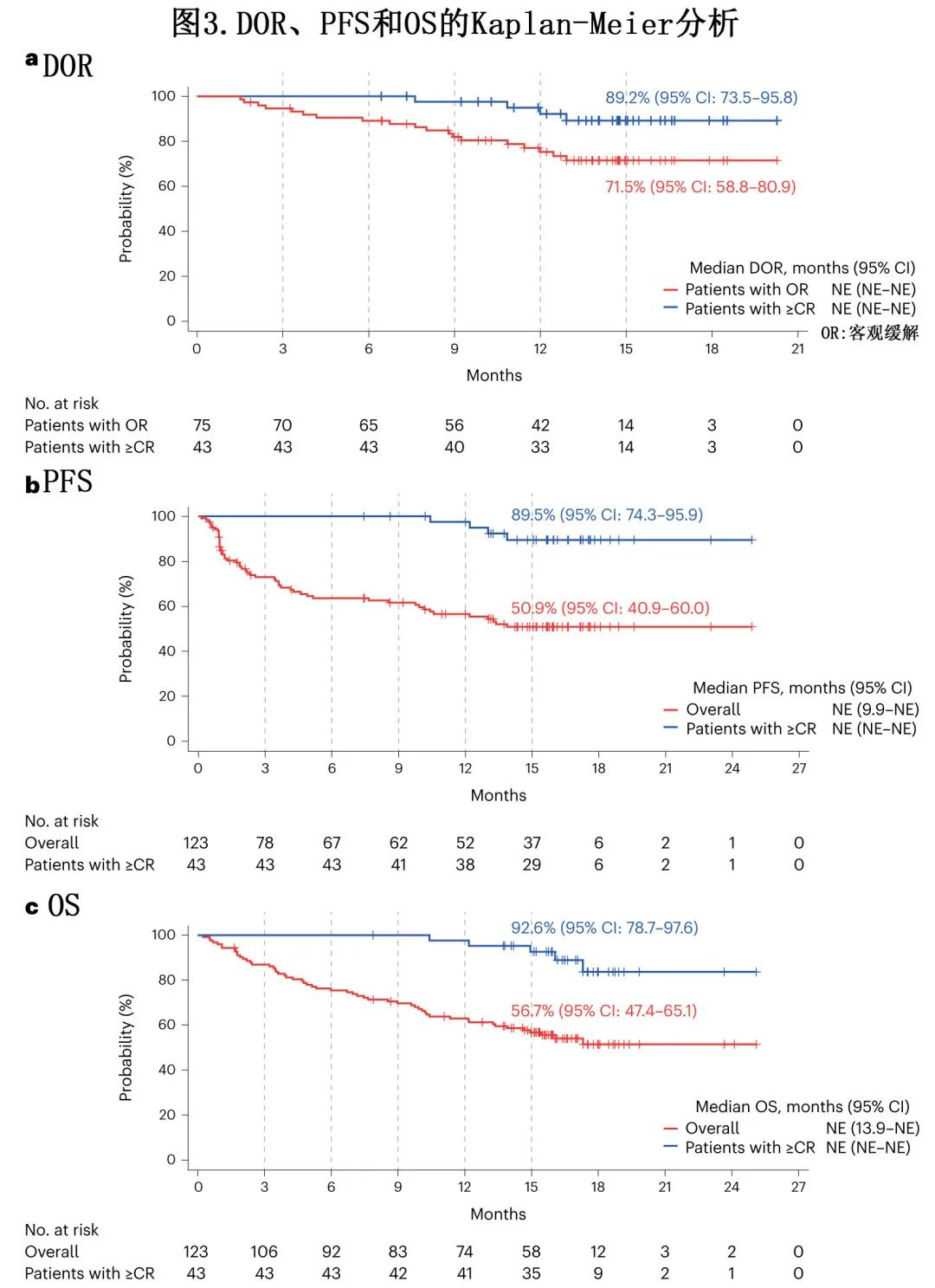
总体人群15个月时维持缓解的Kaplan—Meier概率为71.5%,而≥CR患者为89.2% (图3a)。至≥CR的中位时间为6.1个月。≥CR的患者未达到中位DOCR,9个月时维持≥CR的概率为89.0%。
在预后不良亚组(髓外病变、五重难治和 R-ISS III 期)的缓解者中,有和无髓外病变患者在15个月时维持缓解的概率分别为77.9%和70.6%;有和无五重难治患者分别为63.8%与74.6%,R-ISSⅠ-Ⅱ期和Ⅲ期患者分别为76.3%与26.7%。
中位 PFS 未达到,其中70例 (56.9%) 患者在数据截止时删失,15个月时 PFS 的Kaplan—Meier估计值为50.9%(图3b)。OS 的中位持续时间未达到,15个月时的Kaplan—Meier估计值为56.7%(图3c)。对于≥CR的患者,15个月时 PFS 和 OS 的Kaplan—Meier估计值分别为89.5%和92.6% (图3b,c)。
BICR、研究者和计算机算法之间的缓解一致,ORR分别为61.0%、59.3% 和59.3%。BICR和研究者之间的至事件时间终点(如TTR、DOR、DOCR和PFS)也一致。
安全性
接受 elranatamab 治疗的所有123例患者均报告了治疗中出现的AE(TEAE),87例 (70.7%) 患者报告了3级或4级事件。最常见的 TEAE 见表2。分别有28.5%和77.2%的患者发生导致剂量降低和给药中断的TEAE。血液学TEAE(17.1%) 包括中性粒细胞减少症 (15.4%),是导致剂量降低的最常见 (≥15%) TEAE。导致给药中断的最常见 (≥20%) TEAE为感染 (50.4%)(最常见为COVID-19相关 [25.2%])和血液学TEAE(40.7%)(最常见为中性粒细胞减少症 [35.0%])。在因感染或血液学 TEAE 而中断给药且再激发的患者中,93.5%和95.3%的患者再激发成功(定义为在因 AE 而中断给药后能够重新开始治疗,而非因相同 AE 类型而永久停药)。
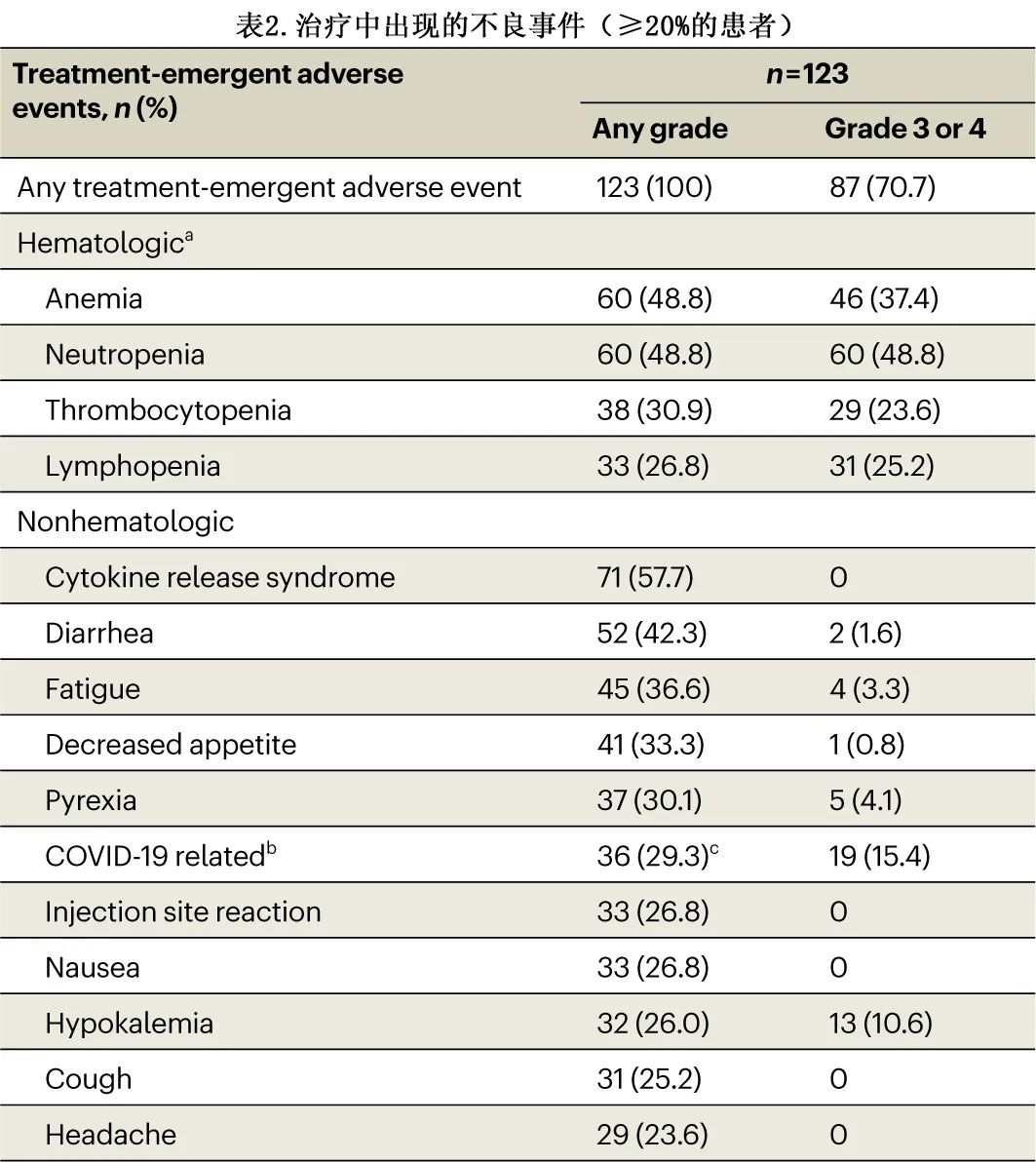
69.9%的患者发生感染;39.8%发生3级或4级事件,6.5%发生致死性感染。最常报告的是COVID-19 相关感染。在有定量免疫球蛋白数据的患者(基线时n=72,基线后n=102)中,98.6%在基线时有免疫麻痹(定义为至少有两种未受累的免疫球蛋白同种型低于正常下限),75.5%在治疗期间至少有一次IgG< 400 mg/dl。43.1%的患者在研究期间接受免疫球蛋白替代治疗。患者还根据当地标准治疗接受抗感染预防:绝大多数患者 (87.0%) 接受了抗病毒预防治疗,约一半 (49.6%) 接受抗耶氏肺孢子虫预防治疗;少数患者接受抗真菌 (11.4%) 和抗菌预防(5.7%);在发生耶氏肺孢子菌肺炎的6例患者中,仅1例接受预防治疗。
分别有17.1%和13.8%的患者报告周围神经病变,定义为运动功能障碍和感觉神经病变;这些患者中分别有14.1%和35.3%的患者有运动功能障碍和感觉神经病变病史。最常见 (≥5%) 的神经病变事件为肌肉痉挛和周围感觉神经病变(各7.3%)。3级运动功能障碍和感觉神经病变分别有1例 (0.8%) 和0例,无4级或5级事件。
在接受两种递增预充剂量方案的119例患者中,56.3%的患者发生细胞因子释放综合征 (CRS),均为1级 (42.0%) 或2级 (14.3%),未报告≥3级事件。相对于最近一次给药,至 CRS 发作的中位时间为2.0 d(范围:1.0-9.0 d),至消退的中位时间为2.0 d(范围:1.0-19.0 d)。98.8%的 CRS 事件发生在前3次给药时,90.6%发生在递增剂量时;1例 (0.8%) 患者在第4次或之后给药后发生1级 CRS 事件(图4)。18例 (15.1%) 患者发生1起以上 CRS 事件。分别有22.7%和8.4%的患者使用托珠单抗和皮质类固醇治疗CRS。119例患者中有4例 (3.4%) 发生ICANS,均为1级或2级。ICANS 的支持性治疗包括皮质类固醇 (1.7%)、托珠单抗 (1.7%) 和左乙拉西坦预防癫痫发作 (0.8%)。没有患者因发生 CRS 或 ICANS 而永久停用elranatamab。

共有55例 (44.7%) 患者在研究期间死亡,大多数 (n=37,(30.1%)) 死于疾病进展;14例 (11.4%) 患者死于非PD TEAE,8例 (6.5%) 死于感染。研究者认为4例死亡与 elranatamab 相关:1例腺病毒性肝炎,1例腺病毒感染和腺病毒性肺炎,1例假单胞菌性肺炎,1例发育停滞。根据方案,不需要筛查腺病毒感染;方案中未规定腺病毒感染的治疗建议,2例5级腺病毒感染患者均由研究者治疗,并根据当地临床实践接受支持治疗。
Q2W给药的疗效和安全性
在数据截止日期前至少6个月转换为 Q2W 给药的应答者中 (BICR,n=50),80.0%在转换后至少6个月维持或改善其缓解, 40.0%的患者缓解加深,其中38.0%改善至≥CR(图1c)。在其余20.0%的患者中,2例 (4.0%) PD,3例 (6.0%) 死亡,5例 (10.0%) 在缓解期间永久停用elranatamab。在改为 Q2W 给药的所有58例患者中,3级或4级 AE 的发生率从58.6%降至46.6%。
总结
在进行中的 II 期 MagnetisMM-3 研究中,RRM患者在两次递增预充剂量后接受 elranatamab 皮下给药,每周一次;6个周期后,持续应答者转换为每两周给药一次。本次报告了队列 A 的结果,该队列入组既往未接受过靶向 BCMA 治疗的患者 (n = 123)。主要终点为经盲态独立中心审查确认的ORR,达到了61.0%(75/123),且35.0%达到≥CR,其中60.5%达到MRD阴性。50例应答者改用每两周一次给药,40例 (80.0%) 可改善或维持其应答超过6个月。中位随访14.7个月,尚未达到DOR、PFS和OS(次要终点),15个月发生率分别为71.5%、50.9%和56.7%。常见不良事件(任何级别;3-4级)包括感染 (69.9%,39.8%)、CRS (57.7%,0%)、贫血 (48.8%,37.4%) 和中性粒细胞减少症 (48.8%,48.8%)。每两周给药一次,3-4级不良事件从58.6%降至46.6%。
在这项接受过多线治疗的RRMM患者的 II 期研究中,elranatamab表现出较高的深度和持久缓解率,包括达到≥CR的患者,且安全性特征可控。给予两步递增预充剂量方案可成功缓解CRS 的发生率和严重程度,且具有可预测的特征,从而支持门诊给药的可能性。尽管需要额外的随访,但在转换为每两周一次给药方案后,仍可观察到 elranatamab 的缓解维持或加深。每两周一次给药可为患者提供更大的便利,并可能降低毒性。Elranatamab 也是一种容易获得的现成疗法,为无法获得 CAR T 细胞疗法的患者提供另外一种选择。该结果支持继续开发 elranatamab 作为单药治疗,并进一步研究其与MM患者的标准或新疗法进行联合。
参考文献
Lesokhin AM,et al.Elranatamab in relapsed or refractory multiple myeloma: phase 2 MagnetisMM-3 trial results.Nat Med . 2023 Aug 15. doi: 10.1038/s41591-023-02528-9.


