CIR:刘志强/侯健/王亚非揭示多发性骨髓瘤骨髓基质细胞介导γδ T细胞功能失调机制
时间:2023-08-28 20:45:39 热度:37.1℃ 作者:网络
MM的骨髓微环境
在多发性骨髓瘤(Multiple Myeloma,MM)中,骨髓基质细胞(BMSC)在骨髓内形成独特的微环境,促进T细胞功能障碍并驱动MM进展,但BMSC如何驱动免疫抑制微环境和容纳肿瘤驻留的机制仍不清楚。T细胞根据受体链组成的不同,除了表达αβ TCR的CD4和CD8 T细胞,还有一类表达γδ TCR的γδ T细胞。γδ T 细胞迁移到肿瘤局部环境后,可通过穿孔素-颗粒酶途径、配体TRAIL和FasL及通过 ADCC 等多种途径来杀死癌细胞,或者通过分泌IL-7形成抑制性免疫微环境。然而,近年来研究表明,γδ T细胞的细胞因子分泌和功能具有高度的微环境依赖性,且所有已知的IL-17+ γδ T细胞亚群都依赖于RORγt作为谱系特异性转录因子,因此靶向RORγt有望成为阻碍IL-17+ γδ T细胞分化的潜在策略。更全面地了解MM肿瘤微环境中γδ T细胞的功能和调控,有益于释放其抗MM潜力和增强疗效。
近日美国癌症研究协会 (AACR)的官方期刊《Cancer immunology research》在线发表题为“CXCL10 recruitment of γδ T cells into the hypoxic bone marrow environment leads to IL-17 expression and multiple myeloma progression”的文章,报道了多发性骨髓瘤(MM)骨髓微环境促进γδ T细胞功能重编程的分子机制,并通过小分子抑制剂靶向此过程中的关键转录因子逆转γδ T细胞的功能失调并改善MM的治疗效果。论文第一作者为天津医科大学基础医学院讲师王静雅和博士研究生彭子怡,基础医学院刘志强教授、上海交大医学院仁济医院血液科侯健教授和天津医科大学肿瘤医院血液科王亚非教授为共同通讯作者。

研究结果
作者首先通过体外BMSC-MM相互作用的模型来筛选造成免疫功能异常的细胞因子,发现与BMSC相互作用可以促进MM细胞高表达CXCL10,并且发现临床患者骨髓中CXCL10水平显著升高并且与疾病进展和预后密切相关。此外,CXCL10对MM细胞的直接作用依赖于其受体类型,即促进CXCR3α高表达型细胞对硼替佐米的耐受性,但是对CXCR3β型细胞没有明显的效果。

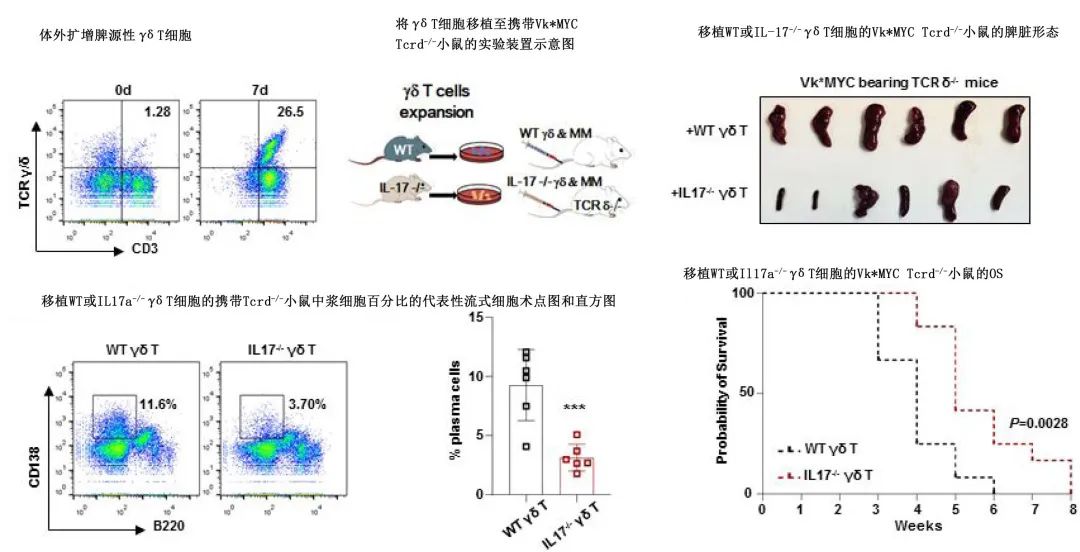
作者建立Vk*MYC和5TGM1的MM小鼠模型,发现骨髓微环境中γδ T细胞数量增加,而外周血中数量减少;MM骨髓微环境中功能失调的γδ T细胞表现出PD-1表达和IL-17生成增加,并在促进MM小鼠模型和临床患者的疾病进展。此外在Vk*MYC小鼠模型中,Tcrd-/-小鼠中MM相关骨病变和死亡率显著减轻,移植从野生型小鼠扩增的γδ T细胞后,这些小鼠中MM疾病进展可以挽救,但从IL17-/-小鼠中移植的细胞无效。证明γδ T细胞来源的 IL-17 参与了 MM 肿瘤发生过程。
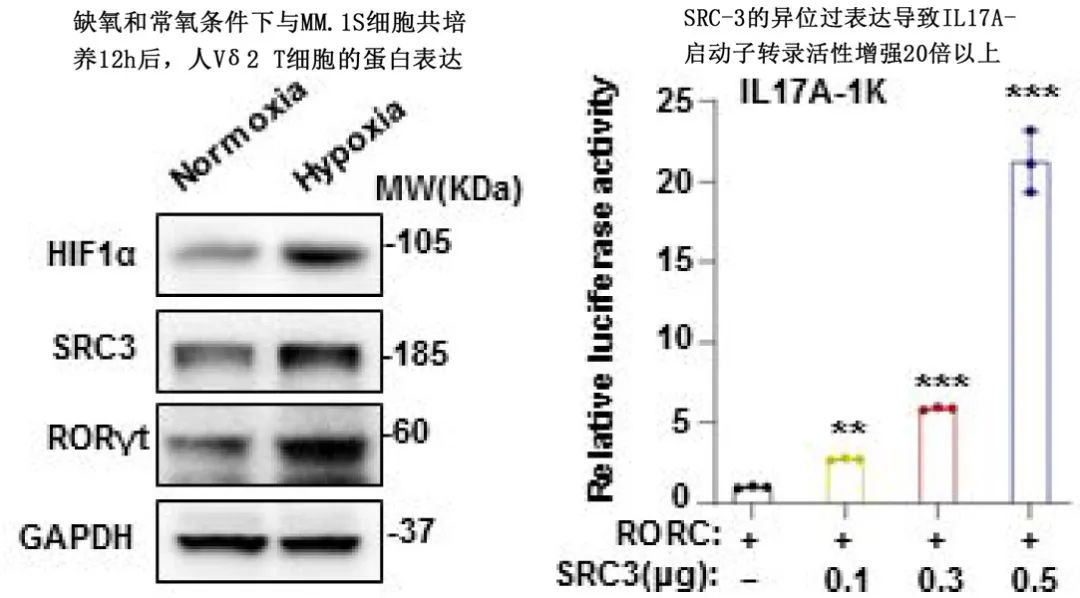
已知MM缺氧的肿瘤微环境可通过不同机制驱动MM进展,因此作者研究了缺氧在导致MM中Vδ2 T细胞功能障碍中的作用。研究发现MM的低氧微环境刺激γδ T细胞中类固醇受体共激活因子3(SRC-3)的表达,进而与转录因子RORγt相互作用,促进IL17转录。
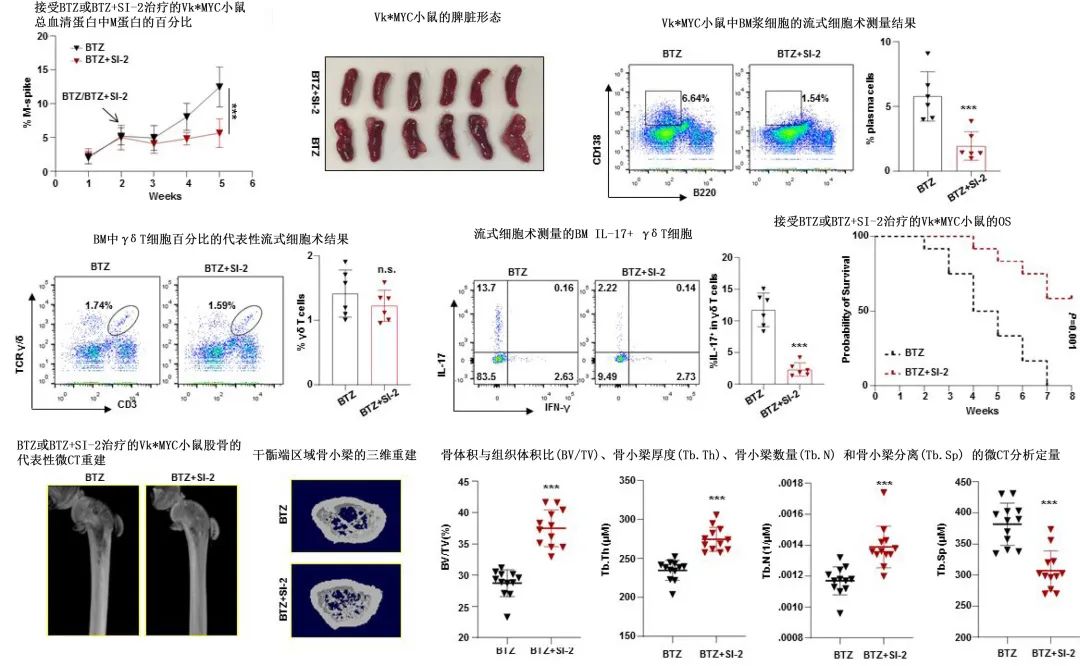
作者评估了SRC3的小分子抑制剂SI-2在Vk*MYC小鼠模型中的作用。通过对SRC-3进行药理学抑制,可有效抑制γδ T细胞中的IL17A表达,从而减缓小鼠模型中的MM进展并增强硼替佐米的化疗效果,提示靶向SRC-3/RORγt/IL-17轴可改善免疫抑制,增强传统化疗的疗效。
总结
本研究结果阐明了骨髓微环境在整个MM进展过程中参与激发γδ T细胞功能障碍导致免疫抑制性微环境的分子机制,即BMSC促使MM细胞分泌CXCL10来募集γδ T细胞进入肿瘤微环境并改变其功能,从而创造有利于肿瘤细胞生存的免疫抑制性环境,同时也为增强γδ T细胞的肿瘤免疫治疗效果提供了新思路和新理论。
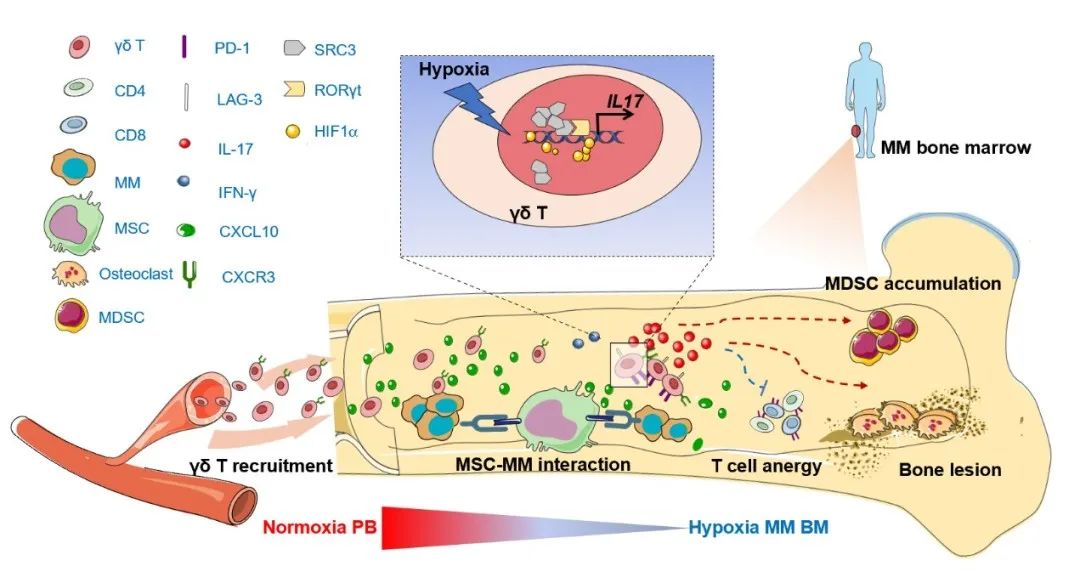
骨髓微环境造成γδ T功能失调的分子机制示意图
参考文献
Jingya Wang, Ziyi Peng, Jing Guo, Yixuan Wang, Sheng Wang, Hongmei Jiang, Mengqi Wang, Ying Xie, Xin Li, Meilin Hu, Yangyang Xie, Hao Cheng, Tiantian Li, Linchuang Jia, Jia Song, Yafei Wang, Jian Hou, Zhiqiang Liu; CXCL10 recruitment of γδ T cells into the hypoxic bone marrow environment leads to IL-17 expression and multiple myeloma progression. Cancer Immunol Res 2023; https://doi.org/10.1158/2326-6066.CIR-23-0088


