溶血合并肾功能相关三联征,是否该考虑补体旁路途径失调?
时间:2023-09-09 10:58:48 热度:37.1℃ 作者:网络
溶血尿毒症综合征(HUS)是一种以非免疫性血管内溶血性贫血、血小板减少和急性肾功能不全三联征为主要临床表现的血栓性微血管病(TMA)[1,2]。根据有无腹泻前驱症状,HUS分为典型HUS和非典型HUS(aHUS)。60%~70%的aHUS患者携带补体基因致病变异或抗补体因子H(CFH)抗体阳性,导致内皮细胞和血小板失去对补体攻击的保护,并最终导致TMA病变,即补体旁路途径失调aHUS[1]。
aHUS是非腹泻性及共患病性HUS,具有预后差、致死率高的特点,发病年龄范围很大,据估计,每年每100万成年人中有2人患aHUS,每100万儿童中有3.3人患aHUS[3]。从既往数据来看,aHUS患者的预后一直很差:高达79%的患者在诊断后3年内死亡、需要透析或有永久性肾损伤[4]。
aHUS有哪些经典的临床表现?及时识别和干预很重要
典型HUS通常通过检查患者是否有腹泻的历史证据,并用通常编码在转移质粒上的志贺氏菌毒素(志贺氏毒素相关的经典溶血性尿毒综合征,STEC-HUS检测粪便中的痢疾杆菌或大肠杆菌来排除。此外,由于严重的维生素B12缺乏而导致的溶血和血小板减少,通常与肾功能衰竭无关,在血清B12水平正常时就可以排除。一旦排除了STEC-HUS和维生素B12缺乏症,临床标准可以帮助区分aHUS和TTP,直到确定ADAMTS13活性(等待7天或更长时间)[5]。
KDOGO指南指出,目前有一些临床医生使用“原发性 aHUS”来指高度怀疑补体替代途径的潜在异常,并排除其它可能引起继发性 aHUS的病因。然而,在有些患者中,补体异常也无法被识别。面对许多具有潜在补体危险因素的患者,aHUS 需要存在触发因素,而触发因素就包括:自身免疫性疾病、移植、妊娠、感染、药物和代谢性情况[6]。

图1.TMA诊断分类[6]
目前,随着对发病机制的深入探索和相关病例的汇总分析,aHUS的临床表现主要总结为以下方面:
①非免疫性溶血性贫血,血红蛋白<100g/L,外周血涂片显微镜下可见红细胞碎片,网织红细胞升高,乳酸脱氢酶升高,Coombs 试验阴性;
②血小板减少(<50x10^9/L);
③急性肾衰竭,表现为少尿、无尿,血肌酐升高,常较基础肌酐升高1.5倍以上[6,7]。
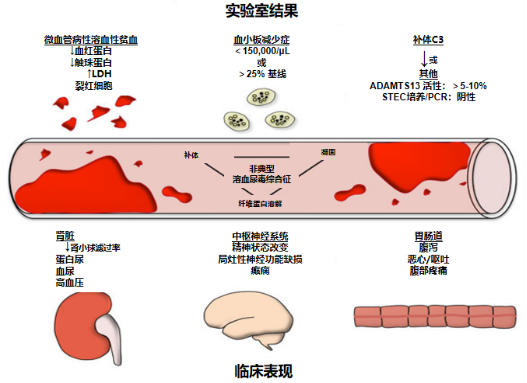
图2 . aHUS的临床表现
那么,什么情况会导致aHUS发病呢?我们需要注意的是aHUS的发作可能发生在任何年龄,在许多具有潜在补体危险因素的患者中可能表现为aHUS需要存在触发因素,触发因素包括:自身免疫性疾病、移植、妊娠、感染、药物和代谢性情况,这些均会使特定的aHUS诊断变得困难[8]。
有相关报告显示,急性aHUS发病的延迟或误诊可导致8%的死亡率,并且有50%–80%的患者进展为终末期肾功能衰竭,因此及时识别TMA的表现以及该表现的原因,随着患者病情的进一步恶化变得至关重要[8]。
当出现溶血合并肾功能相关三联征,或可从补体旁路途径失调入手
2种典型的补体介导的肾脏疾病是aHUS和C3肾小球病(C3G)[9]。“补体系统”目前已经不是一个新鲜的概念,早已有研究证明超过50种可溶性和膜结合蛋白形成补体系统,提供对微生物的天然防御并介导炎症反应。
随着机制的清晰,已证明补体失调和补体替代通路异常是aHUS的发病机制,并进一步激活引起膜攻击复合物沉积于包括肾脏、心脏和中枢神经系统在内的重要器官而引起内皮损伤。补体在先天免疫中起重要作用,可通过经典途径、凝集素途径和替代途径3种途径帮助宿主细胞清除病原体,这些途径最终会聚合形成C3转化酶。
旁路途径由C3水解生成C3b开始,C3b与B因子结合后被血清中的D因子裂解形成C3转化酶,C3b与C3转化酶结合形成C5转化酶,最终形成C5b-9攻膜复合物。旁路途径激活过程中主要受补体调节蛋白[补体因子H( CFH)、补体因子Ⅰ(CFI)],以及膜辅助因子蛋白(MCP)的调控,在CFH和MCP的协同作用下,CFI可通过促使C4b、C3b裂解失活而抑制C3转化酶的形成,从而负调控补体旁路途径的激活。补体调节蛋白基因的突变导致补体旁路途径过度激活,是aHUS发病的主因[10]。

图4. aHUS发生机制(图源:https://www.tipacilar.com/hemolitik-uremik-sendrom-hus/)
随着治疗技术水平的提高,越来越多的aHUS病人免于急性期死亡,进入维持性缓解或者慢性肾脏病阶段,对这些病人进行随访管理显得尤为重要。aHUS每一次复发会造成打击,加速终末肾病的到来。因此,维护良好的肾脏功能,延缓肾脏病的进展,防止aHUS的反复发作是aHUS随访治疗管理的重点。aHUS除了通常会影响肾功能以外,还会对其他器官功能和系统造成损害,通常需要涉及多学科诊疗,对涉及心脏、肺、胃肠道、神经系统的损害进行专门医疗护理。
综上所述,aHUS的发生与补体系统异常活化密切相关,当患者表现出溶血合并肾功能相关三联征时,医生需考虑患者是否存在补体旁路失调。目前对于该罕见疾病,血浆置换、免疫抑制治疗能够缓解病情、改善预后,补体抑制剂也已用于临床治疗,期待我国aHUS患者的生存状况会越来越好。
参考文献
[1] Loirat C ,et al. An international consensus approach to the management of atypical hemolytic uremic syndrome in children[J]. Pediatric Nephrology, 2016, 31(1):15-39.
[2] 易翠莉,余自华.补体旁路途径失调非典型溶血尿毒症综合征的发病机制及诊疗进展[J].中华儿科杂志,2016,54(07):554-557.
{3] Hideki Kato, et al. Clinical guides for atypical hemolytic uremic syndrome in Japan. Clin Exp Nephrol . 2016 Aug;20(4):536-543.
[4] Cofiell R , Kukreja A , Bedard K , et al. Eculizumab reduces complement activation, inflammation, endothelial damage, thrombosis, and renal injury markers in aHUS.[J]. Blood, 2015, 125(21):3253.
[7] 刘思英,等.新生儿家族性非典型溶血性尿毒综合征1例基因分析并文献复习[J].华中科技大学学报(医学版),2021,50(04):497-503.
[10] 张抒扬,罕见病诊疗指南(2019年版),人民卫生出版社,2019年11月.
*本文撰稿/发布由阿斯利康提供支持,仅供医疗卫生专业人士参考


