MAbs:全球抗体偶联药物(ADC)临床开发图景
时间:2023-09-23 08:16:43 热度:37.1℃ 作者:网络
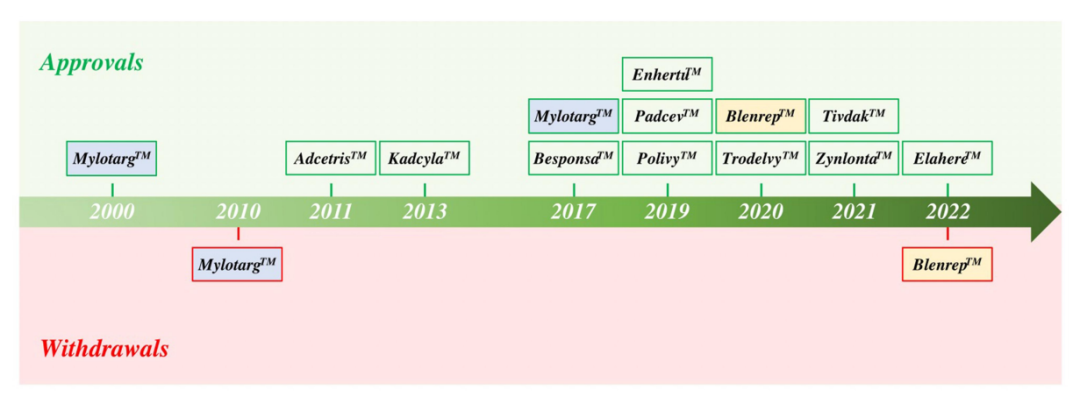
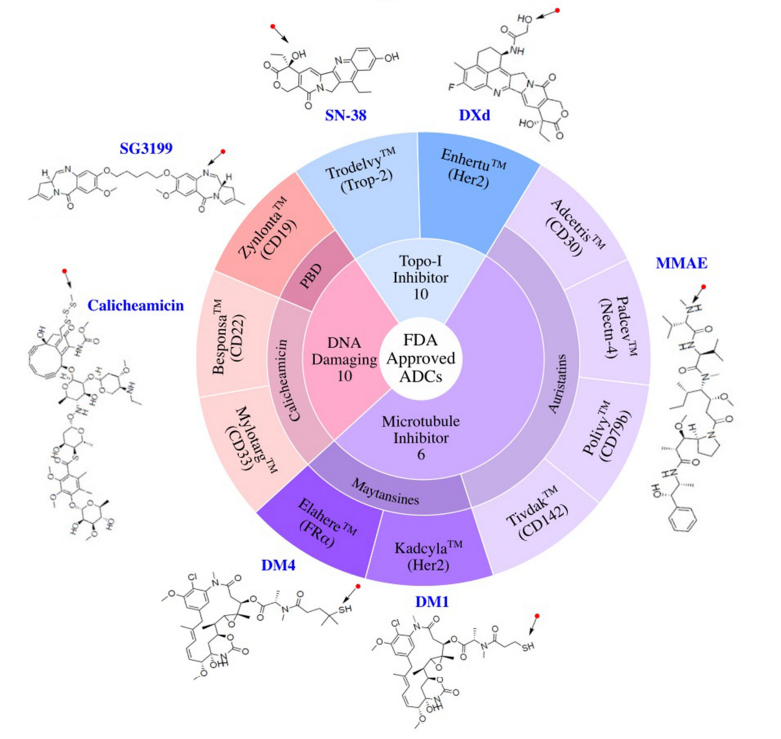
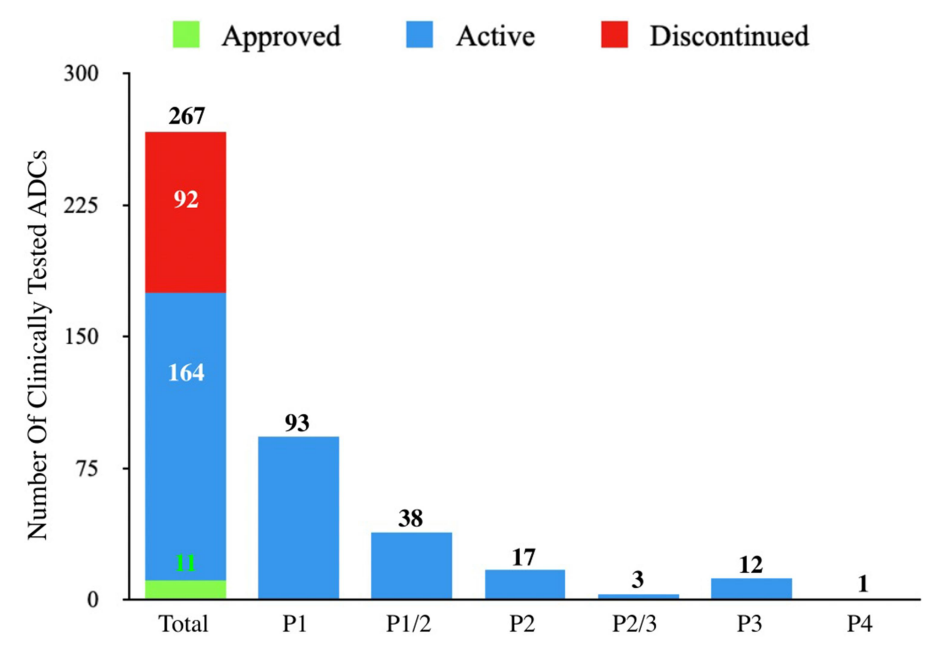
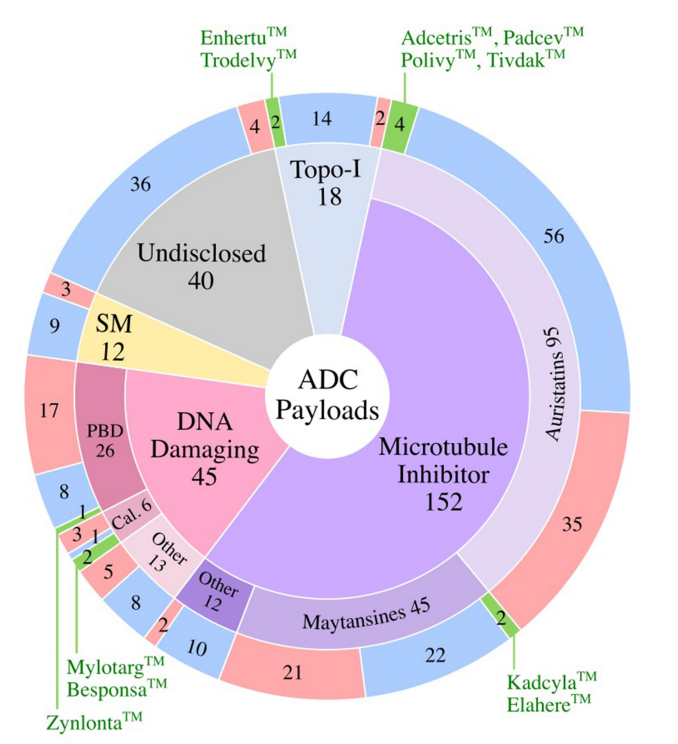
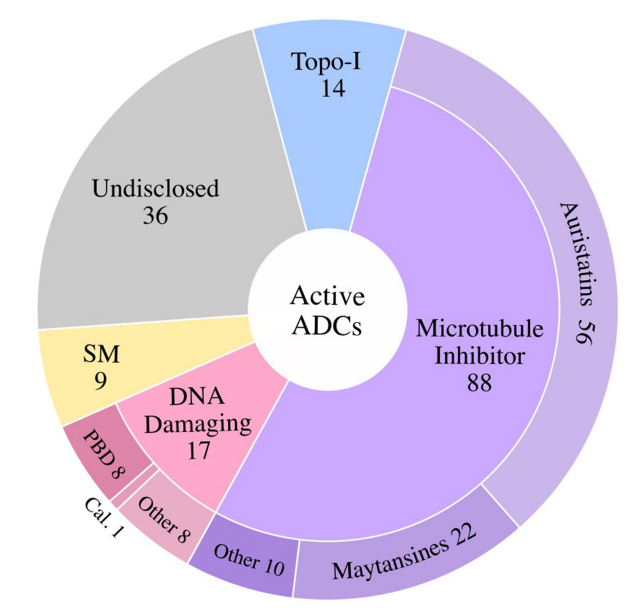
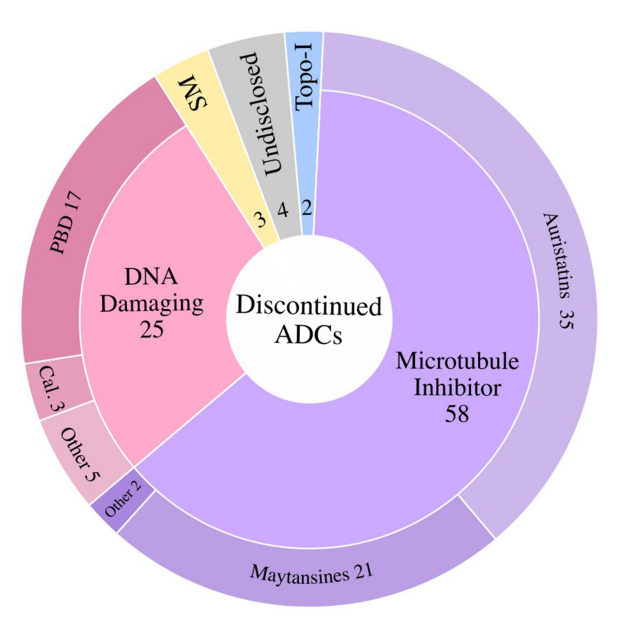
2000年,随着美国食品药品监督管理局(FDA)批准Mylotarg用于治疗急性粒细胞白血病(AML),一类新的精准靶向药物,抗体偶联药物(ADC)开始进入临床。ADC分子将抗体介导的肿瘤抗原靶向的精确性与强效细胞毒性药物结合在一起,提供了一种通过限制正常组织中的有效载荷暴露来减少肿瘤外毒性的方法。 自Mylotarg首次注册以来的23年里,已有260多个ADC在临床上针对各种肿瘤适应症进行了测试,其中有12个ADC药物获得了FDA的批准。目前仍有上百个正在临床测试但尚未批准的ADC药物,以及在临床试验后停止使用的候选药物。这些临床测试的ADC涉及不同的靶向肿瘤抗原、连接子和有效载荷选择,通过对这些ADC临床试验的进一步分析,将为未来更多ADC药物的开发获得更快、更安全的途径。 截止2022年底,FDA已经批准了12种ADC,其中6种分别用于血液系统恶性肿瘤和实体瘤恶性肿瘤。已批准的12个ADC中有9个获得了加速有条件批准,有2个(Mylotarg和Blenrep)的批准被撤回。出于安全性和临床效益的考虑,Mylotarg于2010年被撤回,但在2017年以较低剂量联合化疗再次获得批准。Blenrep于2022年撤回,因为验证性试验未达到必要的批准后疗效终点。 在目前FDA批准的11种ADC中,有6种使用微管抑制剂有效载荷。三个使用DNA损伤剂的有效载荷,而两个使用抑制拓扑异构酶I的有效载荷。这些有效载荷的效力范围包括从高效力的DNA损伤剂PBD(IC50~pM)到低效力的拓扑异构酶I抑制剂SN-38(IC50~2M)。 自1997年首次ADC临床试验以来的26年里,在1200多项临床试验中又测试了266个ADC。在此期间,54个ADC项目已正式停止,38个ADC已从公司管线中删除。 靶向的肿瘤抗原 迄今为止,共有106种肿瘤抗原被ADC候选药物靶向。11个批准的ADC靶向10种独特的癌症抗原:5个ADC靶向血液学癌症抗原,6个靶向实体瘤。一些热门抗原是多种ADC的靶标,包括HER2(41个)、Trop-2(14个)、CLDN18.2(11个)和EGFR(11个)。 连接子 连接子分为两大类:可分裂的和不可分裂的。在临床ADC中,54%使用可裂解的连接子,这代表了最常用的连接子类别。11个临床批准的ADC中有10个使用蛋白酶可裂解连接子。在临床测试的ADC中,16%使用不可裂解的连接子,31%的临床测试ADC未披露连接子。 有效载荷 有效载荷分为四大类:1)微管抑制剂,2)DNA损伤剂,3)拓扑异构酶I抑制剂,以及4)靶向小分子(SM)。微管破坏剂是经过临床测试的最大的有效载荷类别(57%)。11个批准的ADC中有7个使用微管抑制剂有效载荷。DNA损伤剂构成ADC的第二大有效载荷类别(17%)。在7%的临床测试ADC中使用了拓扑异构酶I抑制剂。在11个批准的ADC中,有两个使用拓扑异构酶I抑制剂有效载荷。除了这些传统的化疗药物有效载荷外,大约5%的ADC偶联了靶向小分子,如Bcl-xL抑制剂,以及免疫调节剂,如TLR和STING激动剂。这类非化疗有效载荷中还没有任何候选药物获得批准。此外,15%的临床测试ADC的有效载荷未公开。 偶联方法 在267个临床ADC中,111个利用了非特异性氨基酸偶联,72个利用了位点特异性偶联,有84个未公开偶联方法。在利用位点特异性偶联的候选ADC中,有2个获得批准(Enhertu和Trodelvy)。 在164个临床活跃的ADC中,约7%处于3期临床测试阶段。这些ADC靶向以下肿瘤抗原:BCMA、CEACAM5、c-Met、HER2、HER3、NaPi-2b和Trop-2。 大多数ADC使用微管抑制剂有效载荷(~54%),其次是DNA损伤剂(10%)和拓扑异构酶I抑制剂。约22%的ADC未披露有效载荷。在微管抑制剂ADC中,aurestatins占比最高,其次是maytansines。在DNA损伤有效载荷类别中,PBD占临床活跃ADC的约50%。 临床活性ADC靶向的癌症抗原中,约16%靶向血液肿瘤抗原、约80%靶向实体肿瘤抗原。活跃ADC中最常见的靶向肿瘤抗原包括HER2(32个)、Trop-2(11个)、CLDN18.2(11个)和EGFR(8个)。 ADC的终止开发可归因于以下三个原因中的一个或多个:1)由于不可忍受的毒性导致治疗益处不足,2)由于疗效不足导致治疗益处不优于当前的护理标准,和3)商业考虑。 由于毒性导致治疗益处不足的潜在因素包括1)非肿瘤靶向毒性,2)对需要更高生物暴露的抗原使用非常高效的有效载荷,3)导致有效载荷在肿瘤外释放的不稳定连接子,4)可能由ADC的胞饮作用引起的靶外毒性,和5)有效载荷向毒性更强的代谢物的代谢转化。大约29%的临床测试ADC将毒性作为项目终止的原因。如bivatuzumab mertansine,靶向CD44v6,其在皮肤角质形成细胞中表达,可导致致命的表皮坏死松解症。 微管抑制剂有效载荷占到了已终止ADC的63%,其次是DNA损伤有效载荷(~27%)。拓扑异构酶I抑制剂、靶向小分子和未公开的有效载荷共同构成了剩余的10%。对需要更高生物暴露的抗原使用高效能有效载荷可能是导致几种终止开发ADC产生难以忍受的毒性的一个因素。 除了无法忍受的毒性外,疗效不足也是ADC终止开发的原因之一。导致疗效不足的因素包括1)肿瘤靶抗原密度低或内化特性差,2)有效载荷效力不足,3)异质性DAR,ADC产物导致有效载荷的次优剂量,4)肿瘤外有效载荷释放或肿瘤中药物释放不完全,5)由于较差的PK特性导致ADC快速清除,6)未能证明疗效优于标准护理,以及7)肿瘤中通过药物外排转运蛋白升高介导的耐药性。 由于未能证明优于标准化疗对照组,7种ADC被终止开发:rovalpituzumab tesirine(DLL3)、depatuxizumab mafodotin(EGFRvIII)、AMG 595(EGFRv III)、AGS16F(ENPP3)、glembatumumab vedotin(gpNMB),和lifastuzumab vedotin(NaPi-2b)。 剩余22种终止开发的ADC临床信息尚未公布,在这22个ADC中,有50%的公司提到了投资组合优先顺序或战略考虑,但其余50%的公司没有给出终止的原因。 目前,在267种接受肿瘤适应症测试的ADC中,有11种获得了FDA的批准,有多达92个已经终止开发。分析这些终止开发的ADC药物的相关因素有助于为下一系列分子的设计和选择提供重要信息。新的生物工程修饰已在临床前被证明可以提高治疗指数,采取一种综合的、多因素的方法,仔细选择靶点,同时优化抗体、连接子和有效载荷,并与适应症相匹配,ADC药物有望迎来下一波新的获批高峰。 参考文献: 1.Exploration of the antibody–drug conjugate clinical landscape. MAbs. 2023; 15(1): 2229101.