中华医学会第一届全国罕见病学术年会(CSRD 2023):Ⅰ型神经纤维瘤病治疗的新进展
时间:2023-09-24 23:12:42 热度:37.1℃ 作者:网络
2023年9月22-23日,由中华医学会、中华医学会罕见病分会主办的中华医学会第一届全国罕见病学术年会(CSRD 2023)于北京国际饭店隆重召开。本次大会邀请国内外罕见病领域知名专家进行专题报告、指南解读、病例讨论、大会发言及论文交流等内容。
本次大会,来自首都医科大学附属北京儿童医院的王晓玲教授为我们分享《Ⅰ型神经纤维瘤病治疗的新进展》议题。梅斯医学整理重点分享给各位。

神经纤维瘤疾病负担沉重 治疗手段亟待突破
流行病学:NF1发病率很低,但占神经纤维瘤病96%
神经纤维瘤病是一类常染色体显性遗传性疾病,临床上分3类:1型神经纤维瘤病(NF1)、2型神经纤维瘤病、施万细胞瘤病。
其中,NF1在美国、法国、澳大利亚、韩国等多个国家被列为罕见病。

生理功能:NF1基因编码一种肿瘤抑制因子——神经纤维蛋白
正常情况下,神经纤维蛋白能够维持癌基因Ras失活状态,下调Ras-Raf肿瘤信号通路活性,从而导致细胞增殖减少和存活率降低。

发病机制:NF1基因突变是造成细胞增殖失控的“罪魁祸首”
NF1突变可导致生长因子介导的信号通路失调。
NF1基因突变造成神经纤维瘤蛋白减少或缺失,进而导致Ras通路相关的细胞增殖和存活失控。

临床诊断:标准明确但由于认知不足,目前NF1诊断率极低
NF1诊断标准:基于特征性临床表现,满足以下两项或两项以上即可确诊。
典型的临床表现:
(1)视路胶质瘤
(2)≥6个咖啡牛奶斑:青春期前直径(最长径)>5mm或青春期后直径>15mm
(3)特征性骨病变:如蝶骨翼发育不良,胫骨前外侧弯曲(胫骨发育不良)或长骨假关节
(4)≥2个Lisch结节(虹膜错构瘤)或≥2个脉络膜异常
(5)双侧腋窝或腹股沟区雀斑
(6)≥2个任何类型的神经纤维瘤或1个状神经纤维瘤
(7)NF1基因杂合变异
(8)父母一方通过以上标准诊断为NF1
临床表现:复杂多样,分为三种类型,其中pNF危害最为严重
pNF是沿神经干及其分支分布的弥漫性神经纤维瘤,多呈浸润性生长,破坏周围正常组织和器官,带来毁容、疼痛和功能障碍等,甚至危及生命。
pNF在NF1患者中的发生率:30-50%。

pNF好发于头颈部、躯干及四肢,以头颈部最多见。

疾病进展:约8-13%pNF可恶变为MPNST ,5年总生存率仅为35-50%
pNF中有着大量增生的施万细胞和其他神经纤维支持成分,如神经束膜细胞、成纤维细胞、血管和浸润其中的肥大细胞。
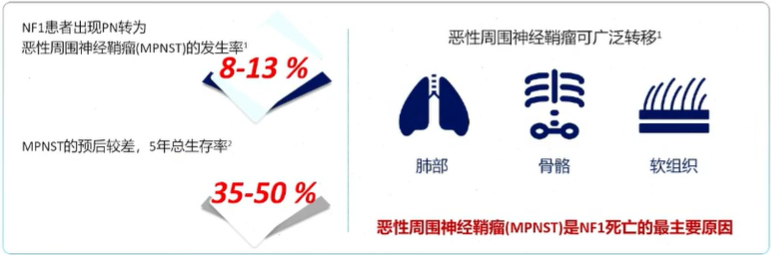
疾病负担:NF1累及全身多系统,多在儿童期发病危害广泛且严重
NF1可累及皮肤、骨骼、神经等各个系统,导致全身多种症状;
NF1多在儿童期发病,随着年龄增长,引起逐渐加重的疼痛、畸形、毁容、残疾/功能障碍;
NF1也会造成患者终身认知障碍、学习障碍和社交功能受损;
NF1患者生存年数平均减少15年,引发恶性肿瘤和心脏疾病时导致患者死亡的主要原因;
NF1患者具有频繁的临床问题,终身住院率是普通人群的4倍,带来沉重的经济和社会负担。
临床治疗:手术是最常用的治疗方式,但仍存在一定局限性
手术难以根治的原因及局限性:
无法解决所有病灶:PN沿一条或者几条神经根生长,很难通过手术解决所有病灶。
手术难度大、术中出血多:PN由广泛的神经和血管组织与正常组织混合而成,手术切除难度大、术中出血多。
复发率>50%:PN可在不完全切除术后重新生长,术后约50%以上的患者会复发。
手术引起新的不适症状:手术本身可能会使患者出现新的不适,最常见的为神经功能障碍。
现有的治疗手段中,还需要更有力更方便的武器,NF1的临床治疗仍然存在着重大的未满足的需求。
靶向药物为NF1-pNF的临床治疗提供新思路
NF1的坎坷寻药之路:花费40年和1亿美金寻找NF1治疗药物

MEK抑制剂研发历程:早期MEK抑制剂多因毒性较大而停止临床开发
尽管MEK抑制剂靶点明确,但研发历程并非一帆风顺:第一代MEK抑制剂多因药学性质不理想,毒副作用较大而被停止临床开发。

MEK抑制剂研发历程:第二代MEK抑制剂不仅疗效提高且毒性降低
第二代是一类更强效且毒性更低的以二苯胺为母核结构的一系列MEK非竞争性抑制剂,在降低毒性的基础上还增加了抗肿瘤疗效。
在儿童肿瘤基金会筛选之下,进行了神经纤维瘤临床试验,为NF1靶向药物的开发奠定了基础。

MEK抑制剂试验思路:抑制MEK为NF1-pNF患者带来治疗新思路
回顾Selumetinib的研究经历:
- 细胞研究:有效抑制MEK 1/2蛋白生物活性,IC50值为14.1±0.79 nM,抑制肿瘤细胞的增殖。
- 小鼠研究:在多个小鼠荷瘤模型中抑制纤维瘤的生长,可以有效缩小NF1-pNF病灶。
- Ⅰ期研究:在治疗儿童NF1-PN的 期研究初探索中实现71%的部分缓解,有效降低患儿的疾病负荷。
- Ⅱ期研究:在治疗儿童NF1-PN的期研究中68%的患儿实现瘤体缩小20%,不良反应多为1,2级。
从这个药物看到了治疗NF1-pNF希望,有效抑制MEK为临床治疗提供了新的思路和新的武器。
临床前研究:展现出优异的药物侯选物特性
司美替尼是一种口服型、非ATP竞争型的小分子MEK1/2抑制剂。
作为单一药物或联合其他化疗或靶向药,在体外、体内肿瘤模型中均显示出治疗潜力。

动物试验:小鼠研究中,司美替尼对pNF展现出较强的病灶缓解能力
2016年由美国国家癌症研究中心(NCI)主持的Ⅰ期临床试验,同时研究了Selumetinib小鼠体内的血药浓度变化以及和空白对照相比pNF体积的变化,体现了其较强的pNF病灶缓解能力。
研究结果支持了MEK抑制剂在NF1相关纤维瘤,特别是pNF的评估,研究者对后续的临床试验增添了信心。

SPRINTⅠ期试验,剂量探索:司美替尼在成人患者中吸收良好、组织分布适中
Ⅰ期试验中以胶囊剂型给药,确定了成人患者最大耐受剂量为75mg,每日两次。
可实现快速吸收(tmax 1.0-1.6h),平均清除半期约为7.5小时,不容易造成药物蓄积;绝对生物利用度达到62-71%。
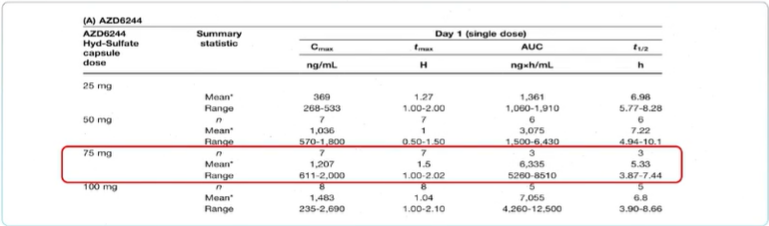
最初Selumetinib是以口服混悬液剂型开发的,由于低溶解度、潜在剂量限制等原因,又改为了胶囊剂;75mg胶囊给药的生物利用度是100mg混悬液的263%,在研究中显示出良好的安全性、以及PK/PD特征。
SPRINTⅠ期试验,儿童NF1-pNF研究初探索:司美替尼在儿童中最大耐受剂量为25mg/㎡
研究评估了儿童NF1-pNF中的最大耐受剂量及;最大耐受剂量被确定为25mg/㎡(bid),约为成人推荐剂量的60。
本研究中,25mg/㎡组仅有1例出现3级黄斑丘疹,被认为为可接受的副反应,因此25mg/㎡被确定为最大耐受剂量。

美国国家癌症研究所癌症治疗评估项目(CTEP)赞助的SPRINTⅠ期临床试验中,24名有NF1和不能手术的PN儿童接受了司美替尼的治疗,以确定最大耐受剂量和评价血浆PK。司美替尼每日给药两次,剂量为每平方米体表面积 20~25~30mg,28天为1周期。
司美替尼在儿童中以25mg/㎡ bid给药与成人75mg bid血药浓度变化相似
对比儿童和成人的PK研究,可以看到两者的PK特征相似。
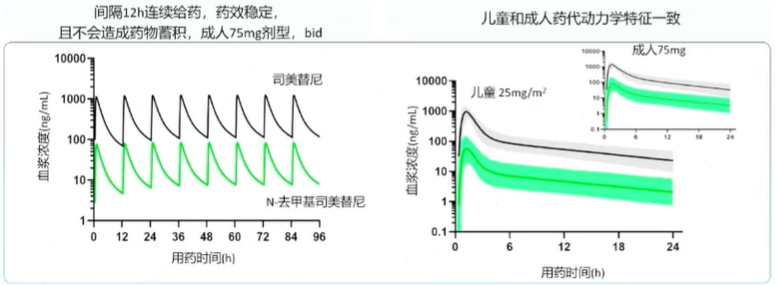
Patel等人开发的模型模拟了成人及儿童中使用司美替尼的PK特性,结果提示儿童25mg(1㎡BSA)与成人75mg(1.73㎡BSA)间药物血浆浓度随时间的变化曲线相似,且成人试验中间隔12h连续给药血浆药物浓度稳定。
SPRINTⅠ期试验(两个案例case)司美替尼为NF1-pNF患者药物治疗带来曙光

SPRINTⅡ期试验:评估治疗儿童NF1-pNF的疗效及安全性
NCI主持的一项开放标签、单臂Ⅱ期临床研究,入组50名诊断为NF1、无法手术的pNF(至少有一种并发症),可口服胶囊的2-18岁儿童患者,在Ⅰ期试验的基础上进一步探索与评估司美替尼的疗效与安全性。

主要结局是pNF的客观缓解率(ORR),次要目标为评估该药治疗是否与临床获益相关;采用多种评分标准评估疼痛、生活质量、认知功能变化等方面。
SPRINTⅡ期试验:NF1-pNF患儿确认的部分缓解率PR高达68%
2年内每4个治疗周期进行一次MRI容积测定,2年后每6个治疗周期进行一次MRI容积测定。
至首次缓解的中位时间为8个周期(4-20),至最佳缓解的中位时间为16个周期(4-36)。
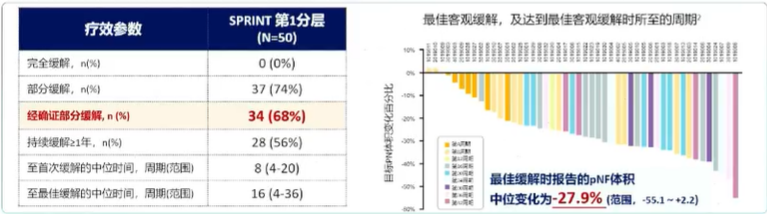
经磁共振成像容积测定,达到客观确认的部分缓解(PR)的患者约有68%;至首次缓解的中位时间为8个周期,至最佳缓解的中位时间为16个周期;达到最佳缓解时报告的pNF病灶体积中位变化降低了27.9%。
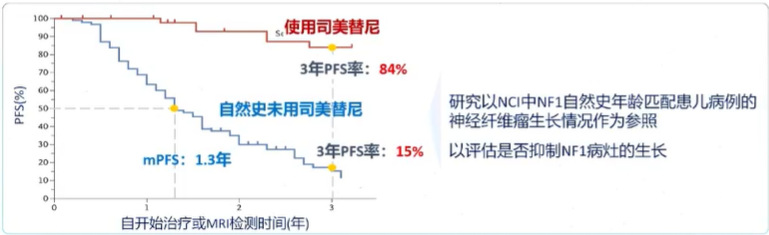
SPRINTIⅡ期试验除了纤维瘤体积缩小之外,无进展生存期PFS显著获益
试验中司美替尼组患者3年无进展生存期PFS率高达84%,未用药组仅有15%;自然病程患者中位无进展生存期仅为1.3年,提示Selumetinib的长期疗效较好。
SPRINTⅡ期试验,司美替尼安全性和耐受性良好、不良反应多为1-2级
安全性良好:
最常见的毒性反应是1级和2级胃肠道症状(恶心、呕吐或腹泻)、肌酸磷酸激酶水平无症状升高、痤疮样皮疹和甲沟炎,无需减量即可控制。
共14名患者(28%)因毒性反应而减少剂量;其中5名患者(10%)因研究人员认为可能与药物有关的毒性作用而放弃继续治疗。
所有患者均未出现左心室射血分数的症状性改变或视网膜浆液性脱离或其他威胁视力的眼部影响。
依从性良好:
患儿接受了36个周期(范围0至47)的治疗,按前12个周期的药片数量计算,大多数患者的药物依从性超过95%。
部分患者在减少剂量/中断给药后观察到缓慢再生长,提示需长期坚持用药。
Selumetinib上市历程:使用工期临床数据获FDA批准快速上市
2020年基于Ⅱ期临床数据FDA批准了英国阿斯利康公司开发的MEK 1/2抑制剂Selumetinib上市;适应症为2岁及以上儿童的1型神经纤维瘤病(NF1)有症状的,无法手术的从状神经维瘤(PNF)。目前已在14个国家/地区上市。

Selumetinib上市历程,对比自然病程队列,值得借鉴的思路与做法
这项单臂Ⅱ期试验,如果采用非干预的对照组,一是患者量难以收集,二是伦理挑战很大,因此研究者们通过同年龄儿童患者的病史采集形成了外部合成的对照组,并与试验组通过年龄匹配进行了对照研究,从而增强了整体试验数据的参考价值。这是非常值得我们借鉴的思路与做法,尤其对于罕见病的临床研究。

Selumetinib上市历程
2022年6月国家药品监督管理局(NMPA)药品审评中心(CDE)受理阿斯利康Selumetinib上市申请。2023年4月28日在中国正式获批上市。

中国首个且唯一获批的药物,开启中国NF1-PN药物治疗新纪元

司美替尼经口服可被快速吸收利用

司美替尼推荐服用剂量25mg/m2,每日两次

司美替尼为胶囊作为胶囊剂型,尺寸小,易于患儿服用
最初是以口服混悬液剂型开发的,由于低溶解度、潜在剂量限制等原因,又改为了胶囊剂;75mg胶囊给药的生物利用度是100mg混悬液的263%,在研究中显示出良好的安全性、以及PK/PD特征。
为什么给药前2小时和给药后1小时不得摄入食物或除水以外的饮料?
给药方法:
给药前2小时和给药后1小时内不得摄入食物或除水以外的饮料;
请用水吞服完整的“科赛优”胶囊,请勿咀嚼、溶解或打开胶囊;
如果在服用“科赛优”后出现呕吐,请勿再补服该剂量,但仍继续下次计划给药。

司美替尼使用需要根据患者不良反应的情况进行用药调整

基于良好的临床数据,司美替尼被国内外多项指南一致推荐为儿童NF1-PN适应证标准治疗药物
2020年法国国家指南、我国2021年儿童及青少年NF诊疗规范、NF1临床诊疗专家共识及2023年Ⅰ型神经纤维瘤病多学科诊治指南(2023版)均推荐司美替尼用于治疗NF1-PN。
司美替尼引领NF1-PN治疗新格局,为患者带来希望

2023年9月18日,神经纤维瘤病被我国纳入《第二批罕见病目录》



