转甲状腺素蛋白心脏淀粉样变(ATTR-CA):症状与体征,流行病学,病因,诊断与治疗
时间:2023-09-25 08:24:55 热度:37.1℃ 作者:网络
转甲状腺素蛋白心脏淀粉样变(transthyretin cardiac amyloidosis,ATTR-CA),也称为ATTR-CM,属浸润性心肌病变,是除免疫球蛋白轻链心脏淀粉样变(immunoglobulin light chain cardiac amyloidosis,AL-CA)之外最常见的心脏淀粉样变(cardiac amyloidosis,CA)。转甲状腺素蛋白(transthyretin,TTR)由肝脏合成,是血中转运视黄醇结合蛋白-维生素A复合物和甲状腺素的蛋白,正常情况下为四聚体,当解离成单体并错误折叠为淀粉样物质后沉积于心肌间质时导致心肌病变,最终进展为进行性心力衰竭(心衰),即为ATTR-CA,也称为转甲状腺素蛋白淀粉样变心肌病(transthyretin amyloid cardiomyopathy, ATTR-CM)。
ATTR-CA患者生活质量差、生存率低,野生型(wild-type,ATTRwt)患者的中位生存期为诊断后43~57个月,突变型(mutant,ATTRm)患者的生存期取决于突变基因,其中Val122Ile突变型患者的中位生存期仅为诊断后31个月[4]。ATTR-CA患者死亡原因多为心原性,包括猝死和心衰。本病临床认识不足、临床表现缺乏特异性、既往缺乏治疗手段,导致误诊率高、诊断延迟、预后差。随着无创诊断技术的发展和有效药物的问世,更多ATTR-CA患者得到诊治。本工作组基于国内外有关ATTR-CA诊断与治疗的研究进展和经验,制定了符合中国诊疗常规的共识,期望能够使中国ATTR-CA患者得到早期诊断与治疗。
一、症状与体征
转甲状腺素蛋白淀粉样变性 (ATTR-CM) 的症状因类型而异。 携带野生型 ATTR-CM 的人可能没有任何症状。 如果出现症状,通常会在 65 岁以后出现。
家族性 ATTR-CM 症状最常首次出现在 50 岁以上的人群中。但是,症状最早可能在 20 多岁或晚至 80 多岁时出现。
转甲状腺素蛋白淀粉样变性 (ATTR-CM) 的症状与心力衰竭症状相似,包括:
- 呼吸急促(尤其是躺下或进行少量体力活动时)。
- 胃胀。
- 混乱或思维困难。
- 咳嗽或喘息(尤其是躺下时)。
- 水肿(腿部、脚踝和脚部的液体滞留)。
- 心律失常(心率不规则或过快),尤其是心房颤动。
- 心悸。
- 疲劳。
- 头晕或昏倒。
最近一个简单的模型有助于识别本疾病,可以在线使用:转甲状腺素蛋白心脏淀粉样变性(ATTR-CA)诊断的预测模型和评分(T-Amylo)
二、临床分型/遗传分型
根据有无TTR基因突变可以将转甲状腺素蛋白淀粉样变(ATTR)分为遗传型/突变型(ATTRm)和野生型(ATTRwt)。ATTRm为常染色体显性遗传病,目前已知超过130种基因突变可导致ATTRm,其中以Val30Met突变最为常见,其次为Val122lIle。患病率存在地域差异,全球患者数量约为10 186(5 526~38 468)例,属于罕见疾病。ATTRm表型可以为周围神经病变(polyneuropathy,PN)、心肌病变或者混合病变。据2016年大型多中心ATTR调查研究THAOS的注册数据显示,全球范围内ATTR-CA患者中突变型比例较高,野生型仅占12% ,但是存在明显地域差异,美国野生型占49%,欧洲野生型仅有5%,考虑与ATTRm具有地域性(葡萄牙多见)以及对ATTRwt的认识和诊断手段差异有一定关系。导致ATTRm-CA的突变以Val122Ile、Thr60Ala、Leu111Met和Ile68Leu 4种最为多见,Val122Ile主要见于非洲裔美国人,Thr60Ala多见于爱尔兰裔,后2种突变多见于意大利人和丹麦人。
三、流行病学
一项横断面调查显示,在最初诊断为肥厚型心肌病的患者中,通过基因检测发现有5%为ATTRm-CA[10]。ATTRwt好发于60岁及以上人群,既往亦被称为系统性老年性淀粉样变(systemic senile amyloidosis,SSA),发病存在明显性别差异,90%以上患者为男性[11]。一项85岁以上人群的尸检研究显示其中25%的人群心脏中有TTR沉积[12]。对60岁及以上射血分数保留的心衰(heart failure with preserved ejection fraction,HFpEF)和左心室肥厚(left ventricular hypertrophy,LVH)的患者进行99锝m(99Tcm)双羧双磷酸盐(99Tcm-DPD)核素扫描,发现其中13.3%的患者最终诊断为ATTRwt-CA[13]。在接受经导管主动脉瓣置换术的老年患者中,通过99Tcm-DPD或99Tcm焦磷酸盐(99Tcm-PYP)核素检测发现其中16%合并ATTRwt-CA[14, 15]。ATTRwt主要累及心脏,导致心室壁增厚、进行性心衰和心律失常[10]。老年合并LVH的HFpEF或主动脉瓣置换患者的核素检查结果提示,与ATTRm不一样,ATTRwt可能并不是罕见疾病,只是尚未被认识。
日本的一项研究显示,2010~2018年期间,日本ATTRwt-CM的患病率为155.8~191.1例/百万人,ATTRm-CM的患病率为3.2~5.1例/百万人。一项系统评价结果显示,ATTRm-CM的患病率估计为5.2例/百万人,发病率估计为0.3例/百万人。
目前已知有30多种能在体内形成淀粉样纤维的前体蛋白,其中容易导致心肌病变的主要有免疫球蛋白轻链(light-chain,LC)、TTR和血清淀粉样蛋白A 3种。TTR主要由肝脏产生,由127个氨基酸组成,相对分子质量约为56 000,负责转运甲状腺素和视黄醇[17]。正常情况下TTR为可溶性四聚体,不会形成淀粉样纤维。当衰老(ATTRwt)或者TTR基因单个核苷酸发生突变(ATTRm)时,四聚体状态的TTR解离为单体,随后错误折叠为淀粉样纤维沉积于组织中,导致淀粉样变[17]。
1、临床表现
(1).年龄和性别:ATTRwt-CA患者确诊年龄为47~94岁,绝大多数在75岁以上,80%~90%以上为男性,而ATTRm-CA患者的年龄在多数60岁以上,70%为男性。
(2).心脏表现:ATTR-CA最常表现为心衰和心律失常[8, 10]。CA是限制型心肌病和HFpEF的主要病因,临床表现主要是活动后气短和右心衰竭(颈静脉充盈、腹水和外周性水肿),超声心动图检查左心室射血分数(LVEF)通常>50%[3, 8],但是随着TTR进一步沉积,LVEF可降低。此外患者还可出现心律失常,包括心房颤动(房颤)和传导阻滞,其中ATTRwt-CA患者传导阻滞发生率为73.5%,房颤发生率为63%~67%,起搏器置入率为29%~40%[3, 8, 18],传导阻滞甚至可以为ATTRwt-CA的首发表现[11];ATTRm-CA患者传导阻滞发生率为73.6%,房颤发生率为52%,起搏器置入率为8.7%[8]。ATTR-CA患者体位性低血压的发生率为11%,由于心输出量减低和心律失常,还可引起晕厥和心脏性猝死[8]。心原性栓塞也可出现,甚至可以是首发表现。尸检研究显示ATTR-CA患者中有14.5%存在心脏血栓,8%发生致死性栓塞事件[19]。此外主动脉瓣狭窄也可为ATTRwt-CA的表现之一,合并率为6%~16%[14, 15],特别是对于存在低流速、低压力阶差的重度主动脉瓣狭窄的老年患者,应考虑ATTRwt的可能。
(3).心脏外表现:ATTR还可沉积在心脏以外的组织脏器引起各种表现[8, 17, 20, 21]。ATTRm常见的心脏外表现有多发周围感觉运动神经病变(通常被称为家族性淀粉样多发PN)[17],表现为首发于下肢、自远端至近端的神经性疼痛和/或感觉异常,之后出现运动功能受损,肌肉无力和无法行走。自主神经功能受累也比较常见,表现为出汗障碍、便秘与腹泻交替以至营养不良和体重下降、体位性低血压、勃起障碍和尿潴留等[17]。ATTRm患者眼部和中枢神经系统也可受累,眼部表现有玻璃体混浊(絮状淀粉样蛋白沉积)、青光眼及角膜炎,中枢神经系统受累是由软脑膜淀粉样血管病所致,可引起局灶性神经功能缺损、癫痫、脑出血和痴呆[21]。ATTRwt患者的神经表现、眼部异常较为少见[7, 8, 9, 11],淀粉样物质易沉积于腰椎管及腕管软组织引起腰椎管狭窄和双侧腕管综合征,前者发生率为14%,后者的发生率高达33%~60%。而且腕管综合征可在心脏症状出现前10年左右发生。ATTRm患者也可出现腕管综合征,但是往往合并PN和自主神经功能异常。ATTRm患者由于TTR沉积于肾脏也可能会出现蛋白尿(少量至大量不等)和/或肾功能不全,甚至发生需要透析的终末期肾病[22]。总之,由于该疾病的异质性及多系统的表现,与其他疾病存在重叠,易造成延迟诊断和误诊。
2、辅助检查
(1)心电图:CA的经典心电图表现有QRS波低电压以及Q波或T波的假性梗死征象[8, 9, 11]。然而,ATTR-CA中低电压发生率为22%~46%,甚至有10%~25%的患者会出现LVH[8, 9, 11]。没有低电压并不能除外ATTR-CA。假性梗死图形发生率约为50%。此外60%~75%的患者出现传导阻滞的心电图表现,56%~63%的患者合并房颤[8, 9, 11]。心脏传导系统异常可以是ATTR-CA患者的首发表现[11]。
(2)超声心动图:超声心动图是筛查、识别CA不可或缺的影像学手段,但不能用于确诊ATTR-CA,尤其是不能鉴别ATTR-CA和AL-CA。一些貌似无特异性的超声影像学表现若同时存在,则高度提示CA的可能,如双心房增大、心室壁增厚(左、右心室壁均可)而心室腔无扩大、心肌内颗粒样强回声、房室瓣增厚、房间隔增厚、少量心包积液以及限制性舒张功能异常等[23, 24]。左心室壁肥厚通常为对称性,但有研究显示ATTR-CA中非对称性肥厚可达23%[11]。LVEF基本正常或略有降低,LVEF降低在ATTRwt-CA患者中并不少见,为37%~50%,且与生存率降低相关[3, 8]。用LVEF评价ATTR-CA患者心脏收缩功能敏感性较差,而应变显像(表现为纵向应变峰值绝对值降低)可以更早地发现收缩功能异常,尤其是出现特征性的“心尖保留”模式,即左心室基底和中段的纵向应变(longitudinal strain,LS)降低而心尖部正常,有助于区分CA与其他原因造成的LVH[24, 25]。
(3)生物标志物:对于AL-CA,血、尿免疫固定电泳和血清游离轻链测定有助于鉴定前体蛋白来源(单克隆免疫球蛋白)。但是到目前为止,临床尚无能够检测血中TTR单体的方法。B型利钠肽(BNP)、N末端B型利钠肽原(NT-proBNP)和肌钙蛋白是评价CA严重程度的生物标志物,三者均与其预后相关[3, 26]。淀粉样蛋白浸润心肌会导致利钠肽升高。在同等左心室质量指数和肾功能情况下,相较于ATTR-CA,AL-CA利钠肽水平更高,因为游离轻链通过调节p38丝裂原活化蛋白激酶直接诱导BNP分泌[27]。利钠肽可以在ATTRm-CA患者出现心脏症状之前就升高,尤其是在无症状的TTR基因突变携带者或只有神经症状的ATTRm患者中[28]。细胞凋亡效应可导致CA患者肌钙蛋白升高,有时会造成CA被误诊为急性冠状动脉综合征。虽然利钠肽、肌钙蛋白等生物标志物均不具有特异性,但其异常持续升高可为CA诊断提供线索。
(4)心脏磁共振成像(CMR):CMR不仅可以评价心脏的结构和功能,还可以显示心肌的组织学特征。CMR示79%的ATTR患者存在非对称性室间隔肥厚,18%的患者为对称性LVH,还有3%的患者左心室几何结构正常[29],常合并右心室肥厚。钆是一种细胞外物质,不能进入完整的心肌细胞,在正常心肌组织中会被迅速冲洗,但会在瘢痕组织或淀粉样物质沉积区(间质扩张区)被动积聚,显示延迟增强征象(late gadolinium enhancement,LGE)。典型的“淀粉样LGE模式”是广泛的心内膜下LGE,不符合冠状动脉供血的区域分布。也可以表现为弥漫性透壁或心肌内片状LGE[30, 31]。心内膜下LGE常见于AL-CA,透壁LGE常见于ATTR-CA。有研究表明,CMR显示的透壁LGE征象与ATTR-CA患者的病死率相关[32]。相较于高血压和肥厚型心肌病,ATTR-CA时左心房和右心室LGE更多见[31]。LGE比超声心动图和CMR功能评估特异度和敏感度更好,甚至可以在无明显心肌肥厚时就出现典型的表现。当心肌弥漫受累时,由于缺少正常心肌参考,LGE会出现假阴性,相位敏感反转恢复序列可以提高其诊断效能。此外钆对比剂可引起肾脏系统性纤维化,中重度肾病患者禁用。T1 Mapping是一种通过图像信号强度定量组织T1弛豫时间的成像分析技术,可以分别在不使用和使用对比剂后进行测定。合并肾功能异常的患者,可选用无对比剂T1 Mapping技术(native T1 Mapping)测量心肌固有信号,ATTR-CA患者的native T1值显著高于肥厚型心肌病患者[33]。注射对比剂后,可通过血液和心肌信号变化比值和血液对比剂分布体积计算得出细胞外体积分数(extracellular volume fraction,ECV)。同样,ATTR患者的ECV也显著高于肥厚型心肌病患者。联合native T1和ECV可以更好地诊断ATTR-CA,ECV还能独立预测ATTR-CA患者的死亡风险[33]。但是CMR不能准确区分AL-CA和ATTR-CA,虽然二者的CMR表现有所不同。
(5)放射性核素骨闪烁扫描术:最初用于骨显像的99Tcm磷酸盐衍生物被发现可以与心脏组织中的TTR紧密结合,可能与TTR纤维中较高的钙成分相关。99Tcm-DPD、99Tcm-PYP、99Tcm羟基亚甲基二磷酸盐(99Tcm-HMDP)用于诊断ATTR-CA敏感度和特异度均很好,可与其他病因进行区分,如肥厚型心肌病。研究显示在临床疑诊CA患者中进行99Tcm磷酸盐衍生物骨显像,如果心肌摄取为2或3级同时血清/尿液中单克隆免疫球蛋白阴性,诊断ATTR-CA的特异度和阳性预测值均为100%,并可在超声心动图或CMR出现异常之前就能识别出心肌病变[34]。目前国内可以使用的骨显像剂是99Tcm-PYP,需要对操作要点(包括患者选择、显像技术、图像质量控制与报告等关键环节)进行规范,以更好地促进国内针对ATTR-CA诊断的核素显像规范开展和临床应用推广。目前国际标准99Tcm磷酸盐衍生物核素扫描心肌摄取2~3级考虑ATTR-CA可能,2级是指心肌摄取等于肋骨摄取,3级是指心肌摄取大于肋骨摄取,伴有肋骨摄取明显减低/肋骨无摄取。
正电子发射断层摄影术(PET)在诊断CA方面也显示出了一定的前景,主要使用的示踪剂有18F-氟哌啶醇(18F-Florbetapir)、18F-氟比他班(18F-Florbetaben)和11C-匹兹堡复合物B(11C-PIB),但目前尚缺乏标准化的临床实施方案。PET示踪剂可以定量评估淀粉样蛋白负荷。另外,PET图像通常与CT或MRI融合,具有比单光子发射计算机断层成像术更高的空间分辨率。然而,以上示踪剂既结合TTR也结合轻链淀粉样沉积物,无法区分AL-CA和ATTR-CA,因此主要应用于早期筛查和治疗随访。
(6)活检:心内膜心肌活检是诊断CA的金标准,刚果红染色是目前最常用的检测淀粉样变的病理学方法。淀粉样蛋白在苏木素-伊红染色光镜下表现为心肌间质内的均匀粉染、无细胞结构的嗜酸性物质。由于其β褶片状结构,会与线性染料刚果红结合,并在偏振光下呈现苹果绿的双折射[36]。淀粉样纤维在电子显微镜下为随机排列的无分支纤维,直径为7.5~10.0nm,可以作为光镜的补充。心脏外组织活检的阳性率取决于淀粉样变的类型和所检查的组织。一般来说,AL型的心脏外组织活检(腹部脂肪、牙龈、皮肤、唾液腺或胃肠道黏膜)阳性率高于ATTRm型和ATTRwt型,如脂肪活检的阳性率AL型>70%,ATTRm型为67%,而ATTRwt型仅为14%[36]。因此,脂肪活检阴性结果不足以除外ATTR-CA诊断,应考虑进行心内膜心肌活检。
刚果红染色阳性显示为淀粉样变,随后应确定淀粉样纤维的前体蛋白类型,可通过免疫组织化学或激光显微切割和/或质谱完成。免疫组织化学是最广泛使用的蛋白分型方法,但其敏感度较低,而且容易出现ATTR假阳性,这是由于即使标本中没有淀粉样蛋白沉积,也可能有很强的背景染色(抗体与病理标本中的循环蛋白结合所致)。激光显微切割和/或质谱技术可对淀粉样变进行准确的诊断和分型,是淀粉样纤维的前体蛋白分型新的金标准[37]。
随着诊断成像技术的进步,CA的诊断模式发生了转变。在血清和尿液中未检测到单克隆免疫球蛋白的情况下,使用99Tcm磷酸盐衍生物核素显像阳性(心肌摄取2或3级)可以准确诊断ATTR-CA而无需进行组织活检[34]。但对于不符合上述条件的患者,明确CA诊断仍需组织活检(特别是心内膜心肌活检)和淀粉样纤维的前体蛋白分型。
(7).基因检测:建议所有确诊为ATTR的患者均进行基因检测,因为在不完全外显和晚发导致家族史缺失的情况下,仅凭临床检查和组织学技术无法区分ATTRm和ATTRwt[38]。发现致病突变基因对ATTRm的预后判定、治疗选择、家族筛查和遗传咨询均很重要。
3、ATTR-CA的“警示征”:识别ATTR-CA疑似患者,对于明确诊断和改善ATTR-CA患者预后非常重要。本共识列出9条ATTR-CA“警示征”,对于具有1条及以上特征的患者应考虑CA特别是ATTR-CA的可能:(1)老年心衰(LVEF≥40%),左心室无扩大伴原因不明的LVH;(2)超声心动图示LVH而心电图无QRS高电压表现;(3)肌钙蛋白持续低水平升高;(4)老年人低压差、低流速主动脉瓣狭窄,伴右心室肥厚;(5)因低血压(特别是体位性低血压)不耐受血管紧张素系统抑制剂和/或β受体阻滞剂;(6)多发PN,特别是伴有自主神经功能异常(不明原因腹泻与便秘,体位性低血压,尿潴留、尿失禁等);(7)家族性PN;(8)老年人双侧腕管综合征和/或腰椎管狭窄;(9)反复双眼白内障。
4、鉴别诊断:
(1)CA与其他临床疾病的鉴别:CA可能会被误诊为其他原因导致的心肌肥厚,例如高血压导致的LVH、肥厚型心肌病。CA患者,特别是ATTR-CA患者的室壁肥厚可能会更明显(>17 mm),还可以出现右心室肥厚,这在高血压患者中并不常见。CA常常合并房间隔和房室瓣的增厚以及心包积液,组织多普勒显示有限制性左心室舒张功能异常,结合心电图低QRS波幅,有助于与肥厚型心肌病相鉴别。CA患者可以出现血清肌钙蛋白升高,要注意与急性冠状动脉综合征进行鉴别,要点是肌钙蛋白呈现持续性升高,不符合急性冠状动脉综合征的演变。如果合并LVH和心衰,更要考虑CA可能。CA特别是ATTR-CA是老年HFpEF的原因之一,特别是对于合并无法解释的LVH、肌钙蛋白升高、传导阻滞和/或低流速的主动脉瓣狭窄时,要考虑CA可能。
(2)ATTR与轻链淀粉样(AL)鉴别:诊断CA时需要区分是AL型还是ATTR型。诊断AL-CA的必要条件是体内检测到单克隆免疫球蛋白,鉴定的方法包括血清游离轻链(free light chain,FLC)和血清/尿免疫固定电泳(immunofixation electrophoresis,IFE)。单独每项检查对单克隆免疫球蛋白的检出率为69%~91%,血清FLC联合血和尿IFE的检出率可以达到98%~99%[39, 40]。由于敏感度低,不推荐血清蛋白电泳用于筛查单克隆免疫球蛋白。血清FLC、血和尿IFE这三项检查均阴性者可以排除AL,但是阳性并不一定是AL,因为在65岁及以上的人群中,高达3%的人存在意义不明的单克隆免疫球蛋白血症(monoclonal gammopathyof undetermined significance,MGUS)。游离轻链由肾小球滤过排泄,肾功能不全会使其血清浓度和比值升高。合并MGUS或者因肾功能不全导致血清游离轻链升高的老年ATTR-CA患者可能被误诊为AL-CA[41]。对于这种情况,99Tcm磷酸盐衍生物核素检查有助于CA分型,阴性者考虑AL-CA可能性大,阳性者则需要组织活检特别是心内膜心肌活检加淀粉样蛋白鉴定才能最终明确诊断,因为AL-CA也可能出现核素检查阳性。
(3)浸润性心肌病的其他原因。包括心脏结节病、心脏血色素沉着症、法布里氏病、粘多糖沉积症
(4)肥厚型心肌病。
5、诊断路径对于出现“警示征”的高危人群,可考虑进入ATTR-CA确诊流程(图1)。
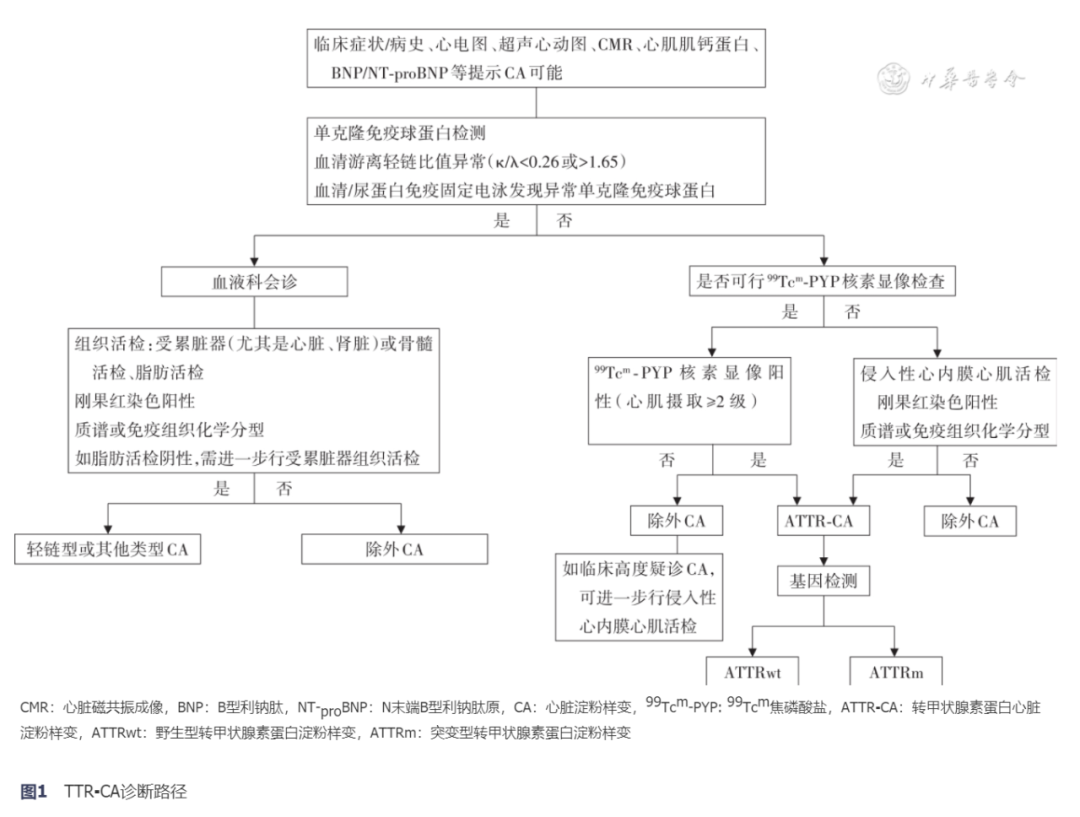
完善心电图、超声心动图和CMR检查并进行单克隆免疫球蛋白(血清和尿IFE以及血清游离轻链)检测。如果心电图、超声心动图和CMR高度提示CA可能,则进入以下步骤。
(1).单克隆免疫球蛋白检测异常(血清FLC、血清/尿IFE):如血清FLC比值异常、血清/尿IFE阳性,应请血液科会诊,进一步行受累脏器(尤其是心脏或肾脏)或骨髓、脂肪活检,推荐首选受累脏器(心脏或者肾脏)进行活检。如果脂肪活检阴性,考虑进一步行受累脏器组织活检。如组织病理刚果红阳性,原则上需要进行淀粉样蛋白分型(推荐首选质谱,对于成熟的操作中心也可以考虑免疫组织化学或免疫荧光)。如果能进行99Tcm-PYP核素扫描检查,也可根据该项检查结果决定是否进行分型,即阴性者可不做分型,阳性者则需进行分型。
(2).单克隆免疫球蛋白检测无异常:可采用99Tcm-PYP核素扫描进行确诊,条件不具备时建议行侵入性心内膜心肌组织活检进行确诊。99Tcm-PYP核素扫描阳性者可诊断ATTR-CA,阴性者基本除外CA,但如果临床仍高度疑诊CA,也可进一步行心内膜心肌组织活检以明确诊断。此种情况可见于一些特定基因突变的ATTRm。
(3).基因检测:患者确诊ATTR-CA后还需进行基因检测明确有无TTR基因突变。
6、分级
Grogan 等人根据肌钙蛋白 T (>0.05 ng/ml) 和 Nt-proBNP (>3,000 pg/ml) 的阈值。 描述了 Mayo Clinic wATTR-CM 分期系统。 该系统将疾病分为 3 个阶段,定义如下:


