【专题论著】| 乳腺癌内乳前哨淋巴结活检核素示踪技术优化研究
时间:2023-10-02 14:17:15 热度:37.1℃ 作者:网络
[摘要] 背景与目的:山东省肿瘤防治研究院(山东省肿瘤医院)乳腺病中心前期研发新型核素示踪技术,显著提高了内乳前哨淋巴结(internal mammary sentinel lymph node,IMSLN)显像率,但该技术获得的IMSLN显像率相较于腋窝前哨淋巴结(axillary sentinel lymph node,ASLN)仍然存在一定差距。本研究旨在通过优化新型核素示踪技术,进一步提高IMSLN显像率,推动内乳前哨淋巴结活检(internal mammary sentinel lymph node biopsy,IM-SLNB)广泛应用。方法:前瞻性入组159例原发性乳腺癌患者,分为优化核素示踪技术组(n=81,A组)和新型核素示踪技术组(n=78,B组)。A组在超声引导下将99mTc-硫胶体平均注射在腺体最丰富的3个区域腺体实质内(总放射强度1.0~1.3 mCi;0.8~1.0 mL/点)。B组在超声引导下将99mTc-硫胶体平均注射在乳腺6点和12点腺体实质内(总放射强度1.0~1.3 mCi;0.8~1.0 mL/点)。术前进行单光子发射计算机断层扫描(single photon emission computed tomography,SPECT)/计算机体层成像(computed tomography,CT)淋巴显像,术中γ探测仪探测前哨淋巴结。比较两组患者IMSLN及ASLN显像率的差异,同时分析可能影响IMSLN显像率的因素。结果:术前SPECT/CT IMSLN显像率在两组间差异无统计学意义(P=0.806)。术中IMSLN显像率A组显著高于B组(87.65% vs 70.51%,P=0.008)。亚组分析显示,A组年龄≤50岁和>50岁患者术中IMSLN显像率分别为92.31% 和 83.33%(P=0.315),B组年龄≤50岁患者术中IMSLN显像率显著高于>50岁患者(81.58% vs 60.00%,P=0.037)。A组IMSLN的中位体外放射性计数显著高于B组(160.50 vs 59.00,P=0.005)。结论:优化核素示踪技术能有效地增加核素内乳区淋巴引流及摄取,可在不影响ASLN显像率的同时显著提高IMSLN显像率,有利于IM-SLNB推广应用。
[关键词] 乳腺癌;内乳前哨淋巴结;前哨淋巴结活检;新型核素示踪技术
内乳淋巴结(internal mammary lymph node,IMLN)和腋窝淋巴结(axillary lymph node,ALN)同属于乳腺淋巴引流的“第一站” 淋巴结[1]。腋窝前哨淋巴结活检术(axillary sentinel lymph node biopsy,A-SLNB)已经彻底改变了乳腺癌患者的管理,成为腋窝标准处理模式[2-6]。内乳前哨淋巴结活检术(internal mammary sentinel lymph node biopsy,IM-SLNB)作为IMLN的微创诊断技术,可以完善乳腺癌的区域淋巴结分期并指导IMLN的精准治疗策略[7-9]。既往应用传统示踪技术所达到的内乳前哨淋巴结(internal mammary sentinel lymph node,IMSLN)显像率较低,平均为13%(0%~37%)[10- 12],导致大多数患者由于缺少IMSLN定位而无法进行IM-SLNB。虽然本中心前期研发的新型核素示踪技术(双象限/乳晕周边腺体内、大体积、超声引导)显著提高了IMSLN显像率(71.1% vs 15.5%,P <0.001)[13- 14],但该技术获得的IM-SLN显像率相较于腋窝前哨淋巴结(axillary sentinel lymph node,ASLN)仍然存在一定差距。本研究旨在通过优化新型核素示踪技术,使IMSLN显像率进一步提高,以推动IMSLNB广泛应用于临床。
1 资料和方法
1.1 临床资料
2021年9月—2022年9月山东省肿瘤医院乳腺病中心收治的经病理学检查证实的cT1-3N0-2M0原发性乳腺癌患者被纳入前瞻性研究。本研究通过山东省肿瘤医院伦理委员会审批,所有患者均签署知情同意书。研究设计见图1。排除标准:① 妊娠期乳腺癌;② 炎性乳腺癌;③ 接受新辅助治疗患者;④ 既往接受乳腺、腋窝及内乳区手术;⑤ 转移性乳腺癌。
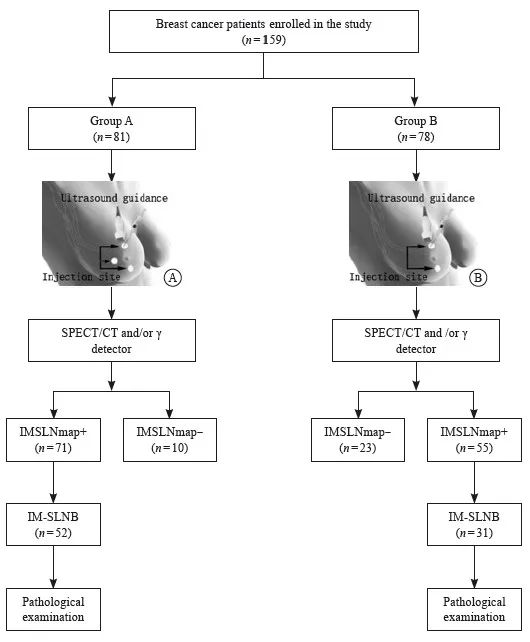
图1 研究设计
Fig. 1 Study design
A: Three point injection, total radiation intensity 1.0-1.3 mCi, 0.8-1.0 mL per point; B: Two point injection, total radiation intensity 1.0-1.3 mCi, 0.8- 1.0 mL per point.
1.2 放射性示踪剂制备
99mTc-硫胶体试剂盒(配备直径为200 nm的过滤器以控制胶体颗粒的大小)购自北京师宏药业有限公司,由本院核医学科制备硫胶体试剂,标记时控制煮沸时间为5 min,标记率>90%,制备后6 h内注射完毕(术前2~18 h注射),注射前用生理盐水稀释至所需体积大小。所有患者均在超声引导下进行注射,注射后避免对注射部位进行按摩并使用生物胶或贴膜轻轻覆盖注射点,防止放射性示踪剂外溢污染。
1.3 放射性示踪剂注射方法
本研究根据99mTc-硫胶体注射方法的不同将患者分为优化核素示踪技术组(A组)和新型核素示踪技术组(B组)。① A组:将99mTc-硫胶体(总放射强度1.0~1.3 mCi;0.8~1.0mL/点)平均注射在3个不同区域的乳腺腺体实质内。注射部位原则上选择乳腺腺体最丰富的3个区域,乳晕外距乳头2~4 cm处,且3个注射点注射后形成的放射性示踪剂注射区域尽可能不重合。② B组:将9mTc-硫胶体(总放射强度1.0~1.3mCi;0.8~1.0 mL/点)平均注射在乳腺6点和12点腺体实质内,乳晕外距乳头2~4 cm处。如肿瘤位于6点或12点位置,可于6点或12点位就近注射。
1.4 术前淋巴显像(lymphoscintigraphy,LSG)
所有患者均在99mTc-硫胶体注射后2~18 h行LSG。采用Toshiba GCA 901AHG型单光子发射计算机断层扫描(single photon emission computed tomography,SPECT)/计算机体层成像(computed tomography,CT)进行LSG(矩阵256×256或512×512,放大倍数为1),术中γ探测仪探测前哨淋巴结。患者采取仰卧位,双上肢上举,分别行患侧前位和侧位显像,将显像示注射点以外的其他部位出现放射性浓集处(即“热点”)定义为LSG阳性。对于术中γ探测仪探测到放射性热点定义为SLN显像阳性。
1.5 SLNB
临床ALN阴性的乳腺癌患者行A-SLNB。术中γ探测仪探测到的IMSLN均行IM-SLNB。IM-SLNB采用经肋间路径进行,在完成乳房及腋窝常规手术后,使用γ探测仪探测并定位IMSLN,于放射性浓集处的胸骨旁相应肋间水平撑开胸大肌(如患者为保乳手术且肿瘤位于外侧象限,需在此处增加3 cm皮肤切口),暴露肋间肌,平行肋骨切开肋间肌,使用γ探测仪寻找、定位IMSLN,切除后送常规病理学检查[15-16]。术中所有患者均使用γ探测仪探测IMLN及ALN,取出的IMSLN及ASLN均进行体外放射性计数,并记录相关数据。
1.6 统计学处理
计量资料呈正态分布时采用t检验,呈非正态分布时采用Mann-Whitney U检验;计数资料的比较采用χ2检验或Fisher精确概率法。采用双侧检验,检验水准α=0.05。数据统计分析应用SPSS 22.0软件。P<0.05为差异有统计学意义。
2 结 果
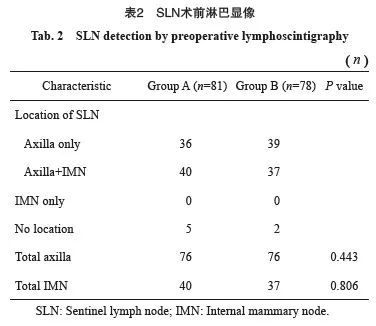
本研究共入组159例原发性乳腺癌患者,其中A组(81例):年龄31~68岁,中位年龄51岁;B组(78例):年龄23~69岁,中位年龄51岁。患者的基线特征见表1。
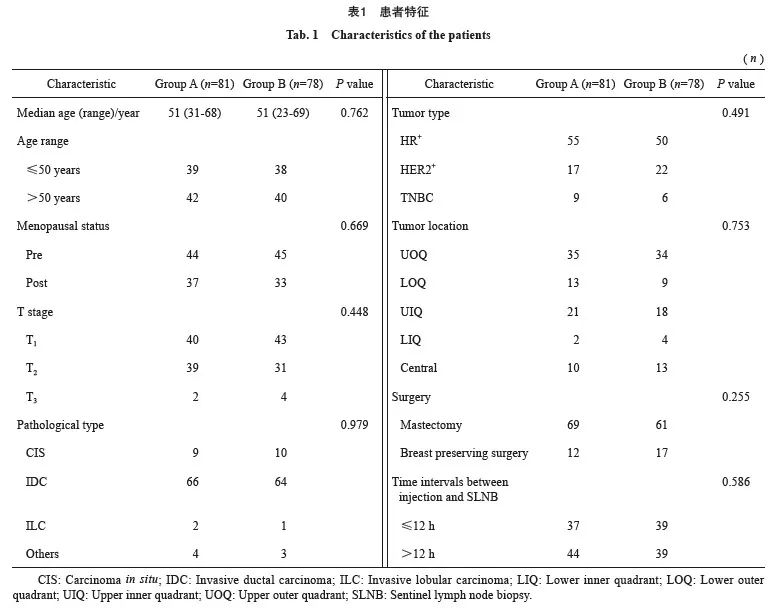
2.1 不同注射方法SPECT/CT术前及术中LSG率比较
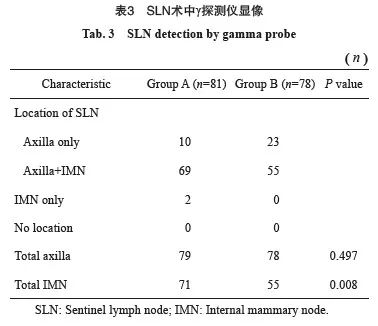
优化核素示踪技术组(A组)具有较高的术前LSG率。术前LSG结果显示,A组IMSLN显像率为49.38%(40/81),新型核素示踪技术组(B组)IM-SLN显像率为47.44%(37/78),两组间差异无统计学意义(P=0.806),A组ASLN术前LSG率为93.83%(76/81),B组ASLN术前LSG率为97.44%(76/78),两组差异无统计学意义(P=0.443,表2)。
术中γ探测仪探测结果显示,A组IM-SLN术中显像率显著高于B组[87.65%(71/81)vs 70.51%(55/78),P=0.008],ASLN术中显像率两组间差异无统计学意义[97.53%(79/81) vs 100.00%(78/78),P=0.497,表3]。
2.2 IM-SLN术中显像率的影响因素分析
优化核素示踪技术组(A组)IMSLN术中显像率与患者年龄、月经状态、肿瘤大小、肿瘤位置、病理学类型、分子分型无关(P均>0.05),在年龄亚组分析中,A组年龄≤50岁和>50岁患者IMSLN显像率分别为92.31%(36/39)和83.33%(35/42)(P=0.315)。但是新型核素示踪技术组(B组)年龄≤50岁患者IMSLN显像率显著高于>50岁患者[81.58%(31/38)vs 60.00%(24/40),P=0.037]。A组IMSLN术中显像率在核素放射强度及核素注射体积各亚组分析中差异均无统计学意义(P>0.05)。
2.3 IM-SLNB相关结果
2.3.1 IM-SLNB成功率
两组患者中,145例行A-SLNB,14例直接行ALN清扫术。术中γ探测仪IMSLN显像成功的126例患者中,41例患者拒绝行IM-SLNB,85例患者接受IM-SLNB,IM-SLNB成功率为97.65%(83/85),2例IM-SLNB失败皆因IMSLN所在肋间隙过窄。
2.3.2 IMSLN检出率及转移率
接受IM-SLNB的患者中,共检出127枚IMSLN,中位检出数目1.53枚(1~3枚),其中第一肋间40枚(31.50%),第二肋间60枚(47.24%),第三肋间27枚(21.26%)。IMSLN主要集中在第一至第三肋间。优化核素示踪技术组(A组)IMSLN中位体外放射性计数显著高于新型核素示踪技术组(B组)[160.50(28~2 539)vs 59.00(9~1 382),P=0.005 ]。ALN总的转移率为42.14%(67/159),成功接受IM-SLNB的患者中, IMLN总的转移率为16.87%(14/83),术后病理学检查证实为IMLN阳性的患者均伴有ALN的转移。
2.3.3 IM-SLNB并发症
接受IM-SLNB的患者中,3例患者出现胸膜损伤,术后未见气胸,6例患者术中出现内乳血管出血,均成功解决。
2.4 IM-SLNB指导淋巴分期和辅助治疗策略
本研究14例IMSLN阳性患者均发生淋巴分期改变,IM-SLNB使16.87%(14/83)的患者的淋巴分期发生改变。基于不良的原发肿瘤特征和(或)ALN转移,这14例患者均有化疗适应证,IM-SLNB不影响辅助全身治疗,而14例(14/83)IMSLN阳性患者可单独进行IMLN放疗,29例(29/83)ALN阳性、IMSLN阴性患者可避免进行IMLN放疗。
3 讨 论
乳腺癌区域淋巴结状况是重要的预后指标,并可指导术后辅助治疗方案的制订,因此,准确评估淋巴结转移状况始终是乳腺癌研究的热点问题。本研究在新型核素示踪技术的基础上,在超声引导下于腺体最丰富的3个区域大体积皮丘式腺体内注射(注射局部形成体积较大的类似于皮丘的肿物),相较于新型核素示踪技术,优化核素示踪技术在不影响ASLN显像率的同时显著提高IMSLN显像率,获得了较高体外放射性计数的IMSLN,更有助于IM-SLNB的推广应用。
研究[17-19]显示,乳腺腺体内局部注射的放射性核素颗粒通过穿过毛细淋巴管内皮细胞间隙及内皮细胞囊泡转运的吞饮作用进入淋巴管,继而转运至淋巴结,被淋巴结内的巨噬细胞摄取吞噬而显像。新型核素示踪技术显著提高了传统注射技术下IMSLN显像率[13],而我们的优化核素示踪技术,继续增加注射区域,可进一步提高IMSLN显像率。究其原因,首先是增加注射区域可能会进一步增加核素颗粒与内乳区引流毛细淋巴管的接触机会,增加核素颗粒内乳区淋巴引流及摄取,这与Mudun等[12] “多于1点的腺体实质内注射可以提高IMSLN显像率”观点一致。但如果注射部位过多,一方面会增加操作时间及风险,另一方面会增加患者注射局部的胀痛不适感。其次,注射部位选择腺体最丰富的区域,很大可能选择了内乳区淋巴引流最丰富的部位。鉴于新型核素示踪技术大体积注射可显著提高IMSLN显像率[13],本研究中每点注射体积均较大,大体积皮丘式注射一方面可能会增加核素颗粒与内乳区引流淋巴管的接触面积,另一方面大体积注射造成注射局部组织液张力增加及锚丝牵拉,使核素颗粒更容易进入毛细淋巴管[17]。
能否确保核素示踪剂注射至乳腺最丰富的腺体实质内是影响IMSLN显像率的重要因素,对于操作者需要一定的经验。根据本中心的临床经验,我们推荐注射时可参考如下操作技巧:注射时宜保证注射至腺体实质内,不可注入乳房后间隙,如腺体较薄,可注射在腺体浅层。3个区域的选择推荐如下(推荐级别依次递减):以乳头为中心呈放射状将乳腺4个象限平均分为8个部分。推荐Ⅰ:3个注射点尽量选择在外侧象限,推荐左乳3、6、12点,右乳6、9、12点,或者外侧象限的任意3个部分;推荐Ⅱ:如需要选择内侧象限,为避免产生透光现象对IMLN显像的干扰,内侧象限尽可能只选择1个注射点,推荐左乳9点、右乳3点,或内侧象限任意1个部分;推荐Ⅲ:3个注射点在1个象限内,推荐1个部分注射2点,另1个部分注射1点;推荐Ⅳ:内侧象限任意3个部分(图2)。
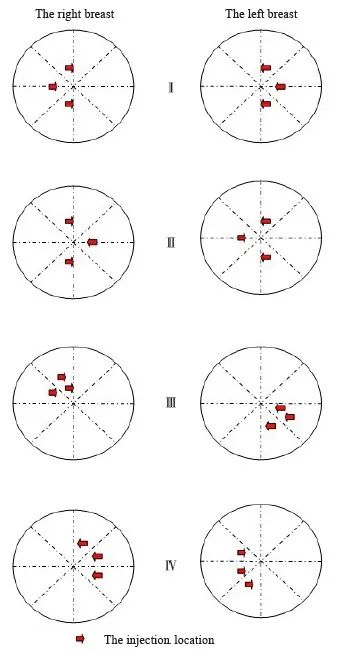
图2 3个注射区域的选择推荐
Fig. 2 Recommended choices for 3 injection areas
本研究仍然有一定的局限性。首先是样本量较少且为单中心研究,需要大样本量的多中心试验进行验证,同时还需要验证IM-SLNB的准确性,即IMSLN能否代表区域淋巴结的转移状况。本中心正在开展前瞻性多中心临床验证研究(CBCSG027、NCT03024463),选择IMSLN显像且高危转移风险的患者在IM-SLNB后进行第一至第三肋间的IMLN解剖,以验证IM-SLNB的准确性,目前结果尚未公布。
优化核素示踪技术能有效地增加核素内乳区淋巴引流及摄取,可在不影响ASLN显像率的同时显著提高IMSLN显像率,有利于IM-SLNB推广应用。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] HULTBORN K A, LARSSON L G, RAGNHULT I. The lymph drainage from the breast to the axillary and parasternal lymph nodes, studied with the aid of colloidal Au198[J]. Acta radiol, 1955, 43(1): 52-64.
[2] KRAG D N, ANDERSON S J, JULIAN T B, et al. Sentinellymph- node rep compared with conventional axillarylymph-node disp in clinically node-negative patients with breast cancer: overall survival findings from the NSABP B-32 randomised phase 3 trial[J]. Lancet Oncol, 2010, 11(10): 927-933.
[3] GIULIANO A E, BALLMAN K, MCCALL L, et al. Locoregional recurrence after sentinel lymph node disp with or without axillary disp in patients with sentinel lymph node metastases: long-term follow-up from the American College of Surgeons oncology group (alliance) ACOSOG Z0011 randomized trial[J]. Ann Surg, 2016, 264(3): 413-420.
[4] GIULIANO A E, BALLMAN K V, MCCALL L, et al. Effect of axillary disp vs no axillary disp on 10-year overall survival among women with invasive breast cancer and sentinel node metastasis: the ACOSOG Z0011 (alliance) randomized clinical trial[J]. JAMA, 2017, 318(10): 918-926.
[5] WETZIG N, GILL P G, ESPINOZA D, et al. Sentinel-lymphnode- based management or routine axillary clearance? Fiveyear outcomes of the RACS sentinel node biopsy versus axillary clearance (SNAC) 1 trial: assessment and incidence of true lymphedema[J]. Ann Surg Oncol, 2017, 24(4): 1064-1070.
[6] GALIMBERTI V, COLE B F, VIALE G, et al. Axillary disp versus no axillary disp in patients with breast cancer and sentinel-node micrometastases (IBCSG 23-01): 10- year follow-up of a randomised, controlled phase 3 trial[J]. Lancet Oncol, 2018, 19(10): 1385-1393.
[7] ASADI M, KRAG D. Internal mammary sentinel lymph node biopsy in clinical practice[J]. Int J Surg, 2016, 36(Pt A): 332-334.
[8] BI Z, CHEN P, LIU J J, et al. Internal mammary sentinel lymph node biopsy after neoadjuvant chemotherapy in breast cancer [J]. J Breast Cancer, 2018, 21(4): 442-446.
[9] QIU P F, ZHAO R R, WANG W, et al. Internal mammary sentinel lymph node biopsy in clinically axillary lymph nodepositive breast cancer: diagnosis and implications for patient management[J]. Ann Surg Oncol, 2020, 27(2): 375-383.
[10] S H I M A Z U K , T A M A K I Y , T A G U C H I T , e t a l . Lymphoscintigraphic visualization of internal mammary nodes with subtumoral injection of radiocolloid in patients with breast cancer[J]. Ann Surg, 2003, 237(3): 390-398.
[11] RODIER J F, VELTEN M, WILT M, et al. Prospective multicentric randomized study comparing periareolar and peritumoral injection of radiotracer and blue dye for the detection of sentinel lymph node in breast sparing procedures: FRANSENODE trial[J]. J Clin Oncol, 2007, 25(24): 3664-3669.
[12] MUDUN A, SANLI Y, OZMEN V, et al. Comparison of different injection sites of radionuclide for sentinel lymph node detection in breast cancer: single institution experience[J]. Clin Nucl Med, 2008, 33(4): 262-267.
[13] QIU P F, CONG B B, ZHAO R R, et al. Internal mammary sentinel lymph node biopsy with modified injection technique: high visualization rate and accurate staging[J]. Medicine (Baltimore), 2015, 94(41): e1790.
[14] QIU P F, WANG X E, WANG Y S. Indications for individual internal mammary node irradiation[J]. Lancet Oncol, 2021, 22(2): e40.
[15] 王永胜, 赵荣荣, 刘雁冰, 等. 精准医学时代乳腺癌内乳前哨淋巴结活检适应证的探讨[J]. 中华肿瘤杂志, 2019, 41(4): 251-256.
WANG Y S, ZHAO R R, LIU Y B, et al. Discussion on the indications of internal mammary sentinel lymph node biopsy in breast cancer in the era of precision medicine[J]. Chin J Oncol, 2019, 41(4): 251-256.
[16] 毕 钊, 刘静静, 陈 鹏, 等. 乳腺癌新辅助化疗后内乳区前哨淋巴结活检研究[J]. 中国癌症杂志, 2019, 29(2): 131-135.
BI Z, LIU J J, CHEN P, et al. Internal mammary sentinel lymph node biopsy in breast cancer patients after neoadjuvant chemotherapy[J]. China Oncol, 2019, 29(2): 131-135.
[17] TANIS P J, NIEWEG O E, VALDÉS OLMOS R A, et al. Anatomy and physiology of lymphatic drainage of the breast from the perspective of sentinel node biopsy[J]. J Am Coll Surg, 2001, 192(3): 399-409.
[18] YU J M, LI G, LI J B, et al. The pattern of lymphatic metastasis of breast cancer and its influence on the delineation of radiation fields[J]. Int J Radiat Oncol Biol Phys, 2005, 61(3): 874-878.
[19] BRESLIN J W, YANG Y, SCALLAN J P, et al. Lymphatic vessel network structure and physiology[J]. Compr Physiol, 2018, 9(1): 207-299.


