ATVB 哈尔滨医科大学田进伟/李水洁/孙斌课题组合作揭示晚期动脉粥样硬化非编码RNA调控自噬新机制
时间:2023-10-08 17:20:11 热度:37.1℃ 作者:网络
晚期动脉粥样硬化是心脑血管疾病的主要原因之一,尽管抗血小板和降脂治疗已取得一定成就,但晚期动脉粥样硬化的残余风险仍然存在。尤其是高风险、脂质丰富且斑块薄弱的易损斑块,它们已被证明是动脉粥样硬化事件的独立预测因子。因此,深入研究晚期动脉粥样硬化的病理生理和潜在机制对于改善心血管疾病的治疗具有重要意义。
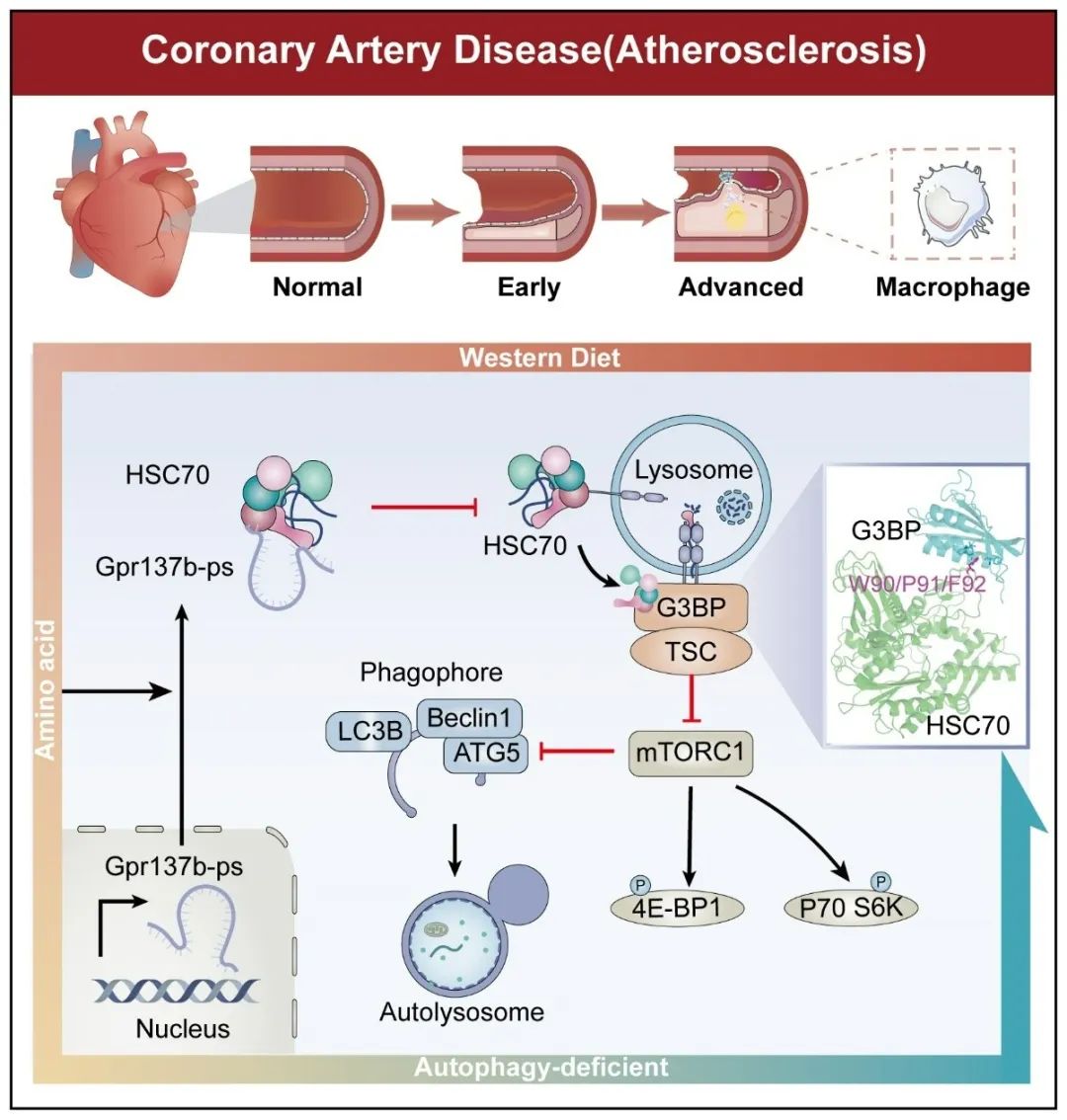
研究发现,氨基酸-mTORC1-自噬信号通路在晚期动脉粥样硬化的发展中起到至关重要的作用,其激活与斑块形成密切相关。恢复受损的巨噬细胞自噬功能被认为是治疗晚期动脉粥样硬化的一个重要方法。因此,研究如何抑制mTORC1信号通路有助于减少斑块的形成。此外,长链非编码RNA在基因表达或RNA与蛋白质相互作用中发挥作用,为我们深入了解晚期动脉粥样硬化的病理生理过程以及制定新的治疗策略提供了宝贵的见解。
2023年9月28日,哈尔滨医科大学附属第二医院心血管内科田进伟教授与哈尔滨医科大学药学院李水洁教授/孙斌教授课题组合作在Arteriosclerosis, Thrombosis, and Vascular Biology在线发表了题为“Long Noncoding RNA Gpr137b-ps Promotes Advanced Atherosclerosis via the Regulation of Autophagy in Macrophages”的研究论文,揭示了长链非编码RNA Gpr37b-ps通过调控巨噬细胞自噬,加速晚期动脉粥样硬化进展,为晚期动脉粥样硬化的治疗提供了新的方向。

该研究发现,在小鼠晚期动脉粥样硬化的斑块中,lncRNA Gpr137b-ps表达明显增加。通过在小鼠晚期动脉粥样硬化模型中沉默Gpr137b-ps,能激活斑块中巨噬细胞的自噬过程,减少斑块内巨噬细胞浸润,进而降低动脉斑块的负担,为晚期动脉粥样硬化的治疗提供了新的潜在靶点。
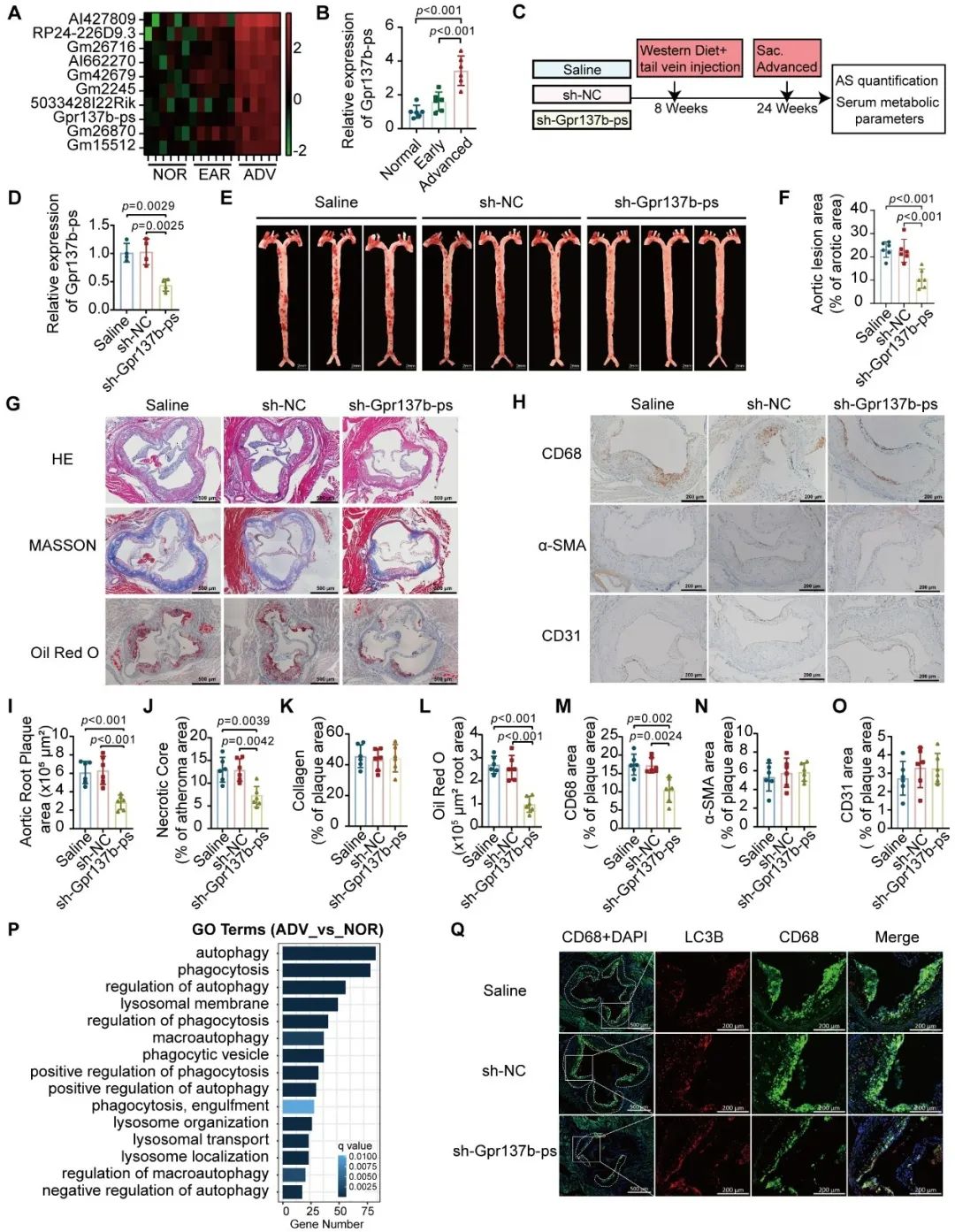
通过在巨噬细胞中分别沉默和过表达Gpr137b-ps,探究其对基础和饥饿诱导的自噬活性的影响。进一步分析显示,Gpr137b-ps主要影响自噬的起始、延伸和成熟阶段。此外,Gpr137b-ps的沉默可促进氨基酸-mTORC1-自噬信号通路的激活,为理解晚期动脉粥样硬化的发展提供了重要线索
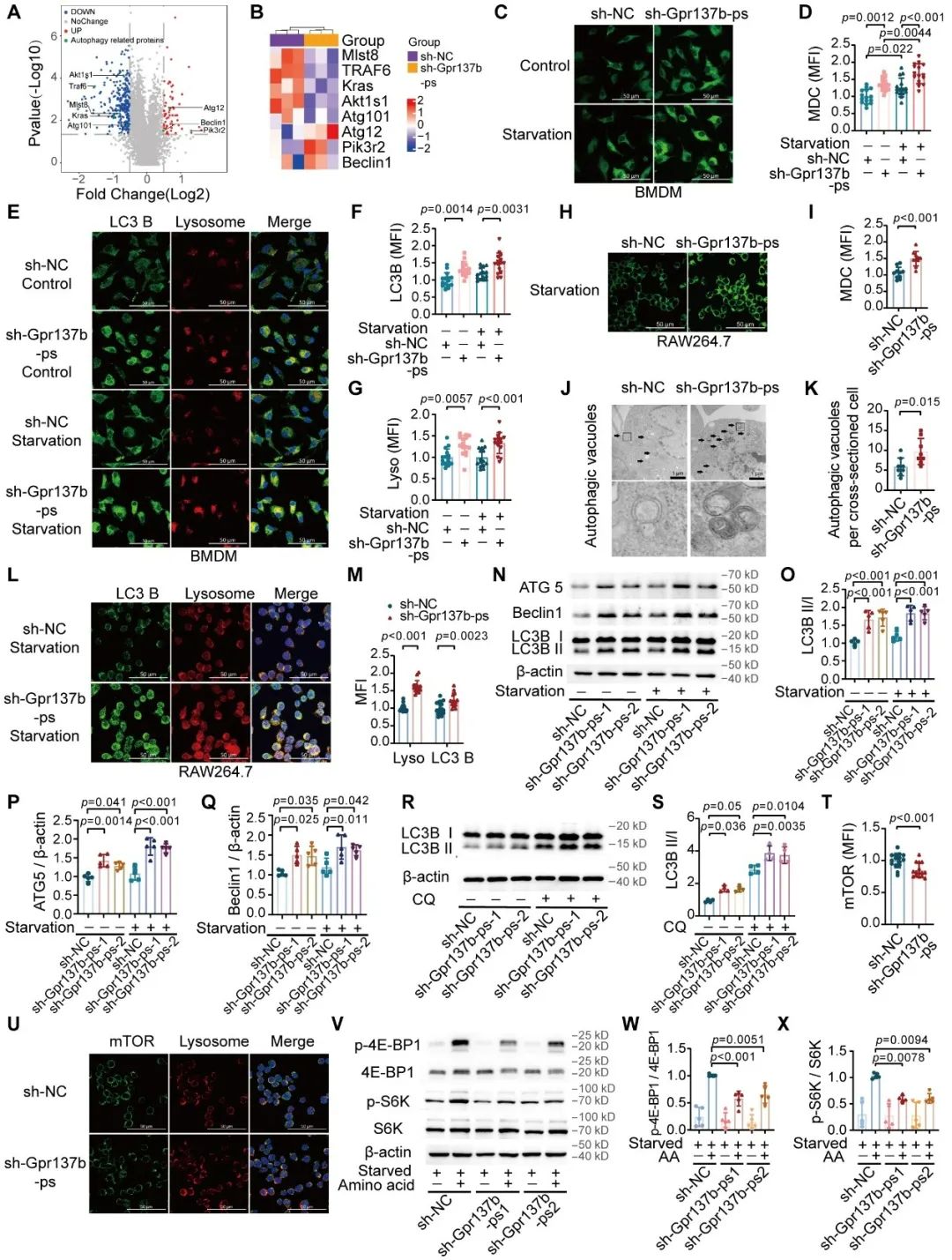
该研究发现Gpr137b-ps主要位于细胞质中,通过质谱分析鉴定出HSC70是其重要结合蛋白,进一步验证了Gpr137b-ps与HSC70的结合关系。然而Gpr137b-ps的表达水平对HSC70的表达没有影响,但可以通过调控HSC70的蛋白结合能力来影响氨基酸-mTORC1-自噬过程。通过Rescue试验进一步证实HSC70是Gpr137b-ps在自噬中的关键下游效应分子。
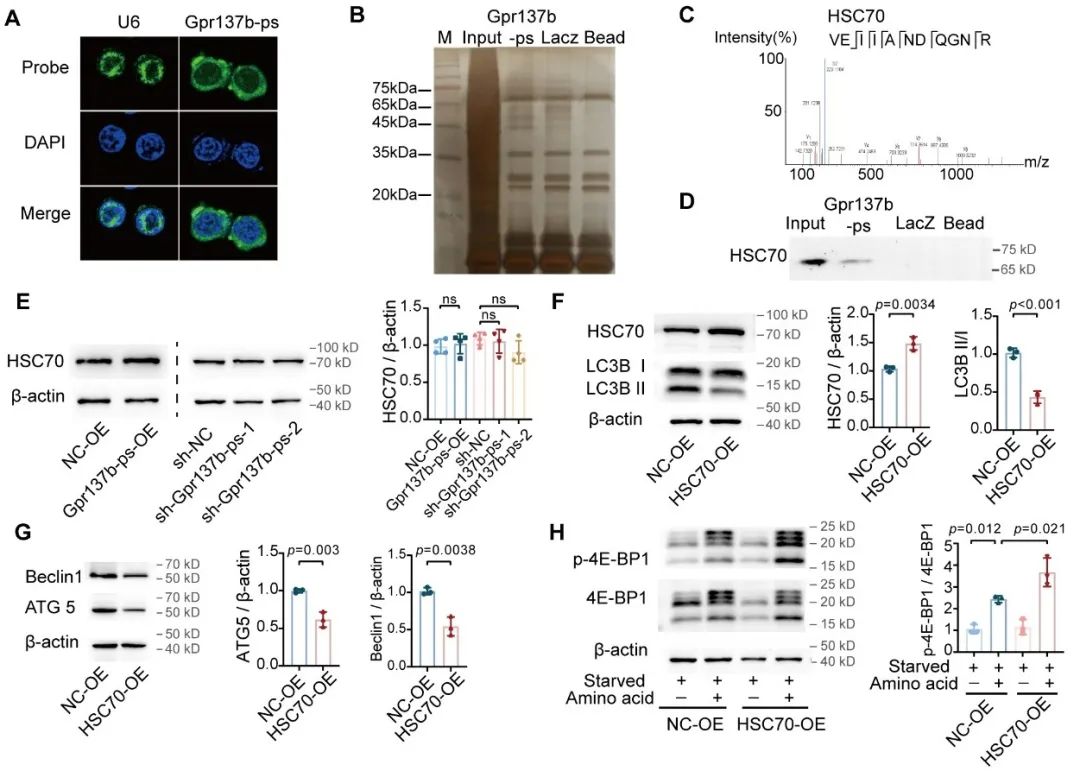
作为mTORC1信号通路的调控分子,G3BP在血管中的表达和分布与HSC70高度一致。Gpr137b-ps通过影响HSC70和G3BP之间的相互作用,以及G3BP与下游靶点TSC2和LAMP2A的结合,从而调控mTORC1-自噬信号通路。通过计算机模拟,预测了HSC70与G3BP的结合可能是通过HSC70的W90-F92基序与G3BP的NTF2结构域之间的蛋白质相互作用来实现的。
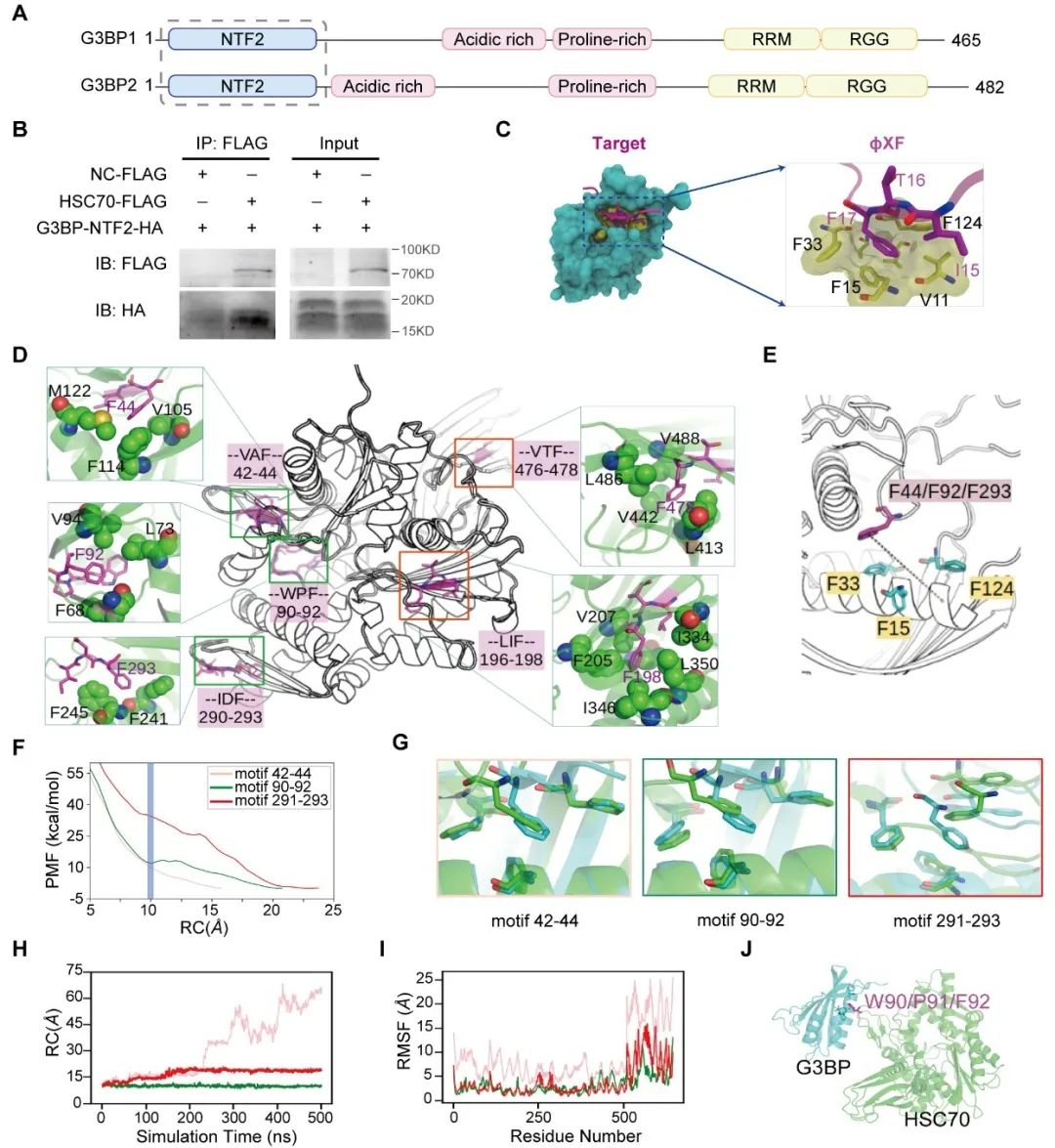
综上所述,通过在小鼠晚期动脉粥样硬化模型中沉默Gpr137b-ps,显著减少了巨噬细胞的聚集和斑块负担。进一步揭示了Gpr137b-ps通过干扰HSC70与G3BP结合,激活氨基酸-mTORC1信号通路,从而抑制巨噬细胞的自噬功能。这为晚期动脉粥样硬化的理论研究提供了重要依据,并为发现潜在的治疗靶点提供了新的方向。
本研究是由哈尔滨医科大学附属第二医院心血管内科的田进伟教授领导的团队与哈尔滨医科大学药学院的李水洁教授以及孙斌教授的团队合作完成的,共同第一作者包括博士曲文博和心肌缺血重点实验室的研究员周鑫,田进伟、李水洁和孙斌教授是本研究的通讯作者。这项研究得到了国家自然科学基金项目和黑龙江省应用技术研究与开发计划等项目的资助。
原文链接:
https://www.ahajournals.org/doi/10.1161/ATVBAHA.123.319037


