林奇综合征/林奇样综合征/FCCTX,基因检测如何辨别“真假美猴王”
时间:2023-11-01 14:38:45 热度:37.1℃ 作者:网络
什么是林奇综合征?
林奇综合征(Lynch综合征,以往也称遗传性非息肉病性结直肠癌)是一种常染色体显性遗传疾病,是由DNA错配修复(MMR)基因(MLH1、MSH2、MSH6和PMS2)或EPCAM基因胚系致病性变异引起的,占所有结直肠癌(CRC)病例的 2-6%,Lynch综合征(LS)患者在子宫内膜、卵巢、胰腺和前列腺等部位发生结肠外肿瘤的风险也显著增加。

▲林奇综合征相关的常见癌种
LS终生发生癌症的风险取决于受影响的基因,MLH1和MSH2发生CRC的风险最高,而MSH6和PMS2的风险较低。根据前瞻性林奇综合征数据库(PLSD),25-75 岁的MSH2和MLH1携带者的总体癌症发病率为 75-85%,MSH6为 42-63%, PMS2为 34%,其中结直肠癌最为常见,MLH1发生CRC风险为 48-57% ,MSH2为 47–51% ,MSH6为 18–20%, PMS2为 10% 。LS家族中第二常见的癌症是女性子宫内膜癌,终生患病风险为 30-60%。LS家族中可能发生的其他癌症(包括卵巢癌、胃癌、泌尿道癌、小肠癌、胰腺癌和胆管癌),预估每种癌症的终生风险为 10% 或更低 。由于LS患者患癌症的风险很高,因此以降低癌症发病率和死亡率为目标制定监测策略非常重要。如建议LS患者在20-25 岁或比家族中已确诊的最年轻患者早 2-5 年开始结肠镜检查,每 1-2 年检查 1 次。对于MSH6和PMS2变异携带者,可以考虑稍晚年龄开始结肠镜检查,建议女性患者从 30 岁开始每 1-2 年进行一次子宫内膜活检筛查。
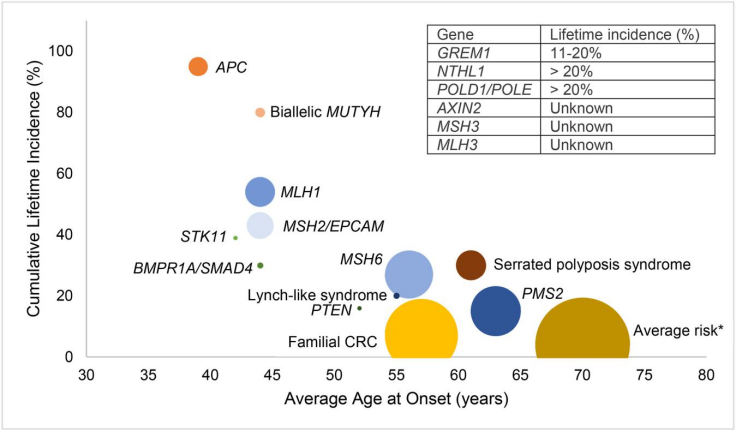
▲按基因或综合征划分的结直肠癌终生发病率和平均发病年龄,圆圈的大小代表患病率大小
Clinical Gastroenterology, [101840]. https://doi.org/10.1016/j.bpg.2023.101840
什么是林奇样综合征?
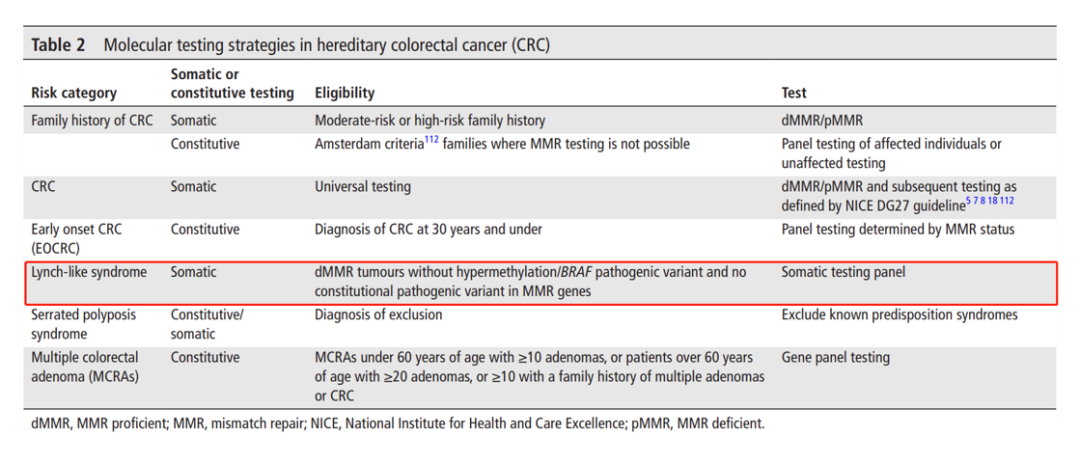
由于缺乏LS特有的临床症状,在临床中通常会进行微卫星不稳定性(MSI)检测或MMR蛋白的常规初筛,若初筛显示MMR蛋白缺失或MSI-H的患者,建议使用包含MMR基因的检测panel进行胚系测序以明确Lynch综合征诊断,Sanger测序可用于验证家系中已知变异的定点检测。
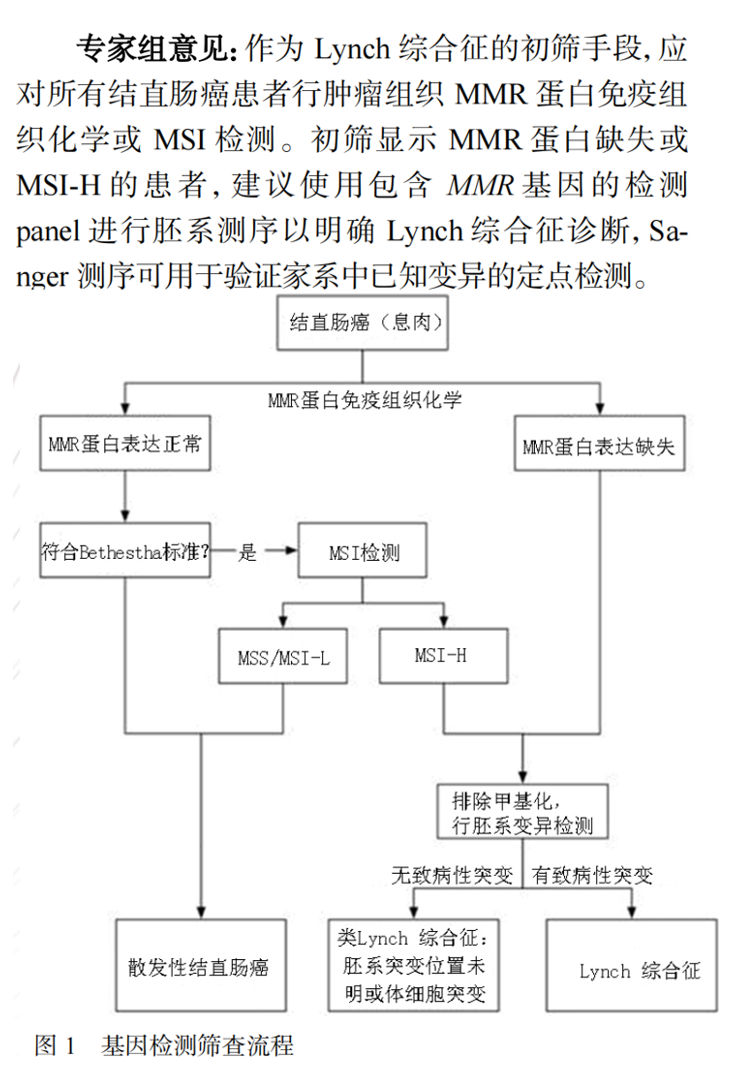
▲中国家族遗传性肿瘤临床诊疗专家共识(2021 年版)—家族遗传性结直肠癌
然而,一些患者既没有MMR基因胚系突变,也不存在BRAF体细胞突变或MLH1超甲基化,但是会发现MSI-H或MMR蛋白缺失,这种情况下称为林奇样综合征(lynch-like syndrome,LLS)。

▲Lynch综合征相关性子宫内膜癌筛查与防治中国专家共识(2023年版)
已发表的数据显示,使用当前的诊断方法,约一半以上的dMMR CRC患者可归类为LLS。与LS患者类似,疑似LLS的患者同样在较年轻时就患有癌症(53.7 岁 vs. 45 岁),但是LLS患者结直肠癌的发病率低于LS,其他部位的肿瘤发生率也是如此。
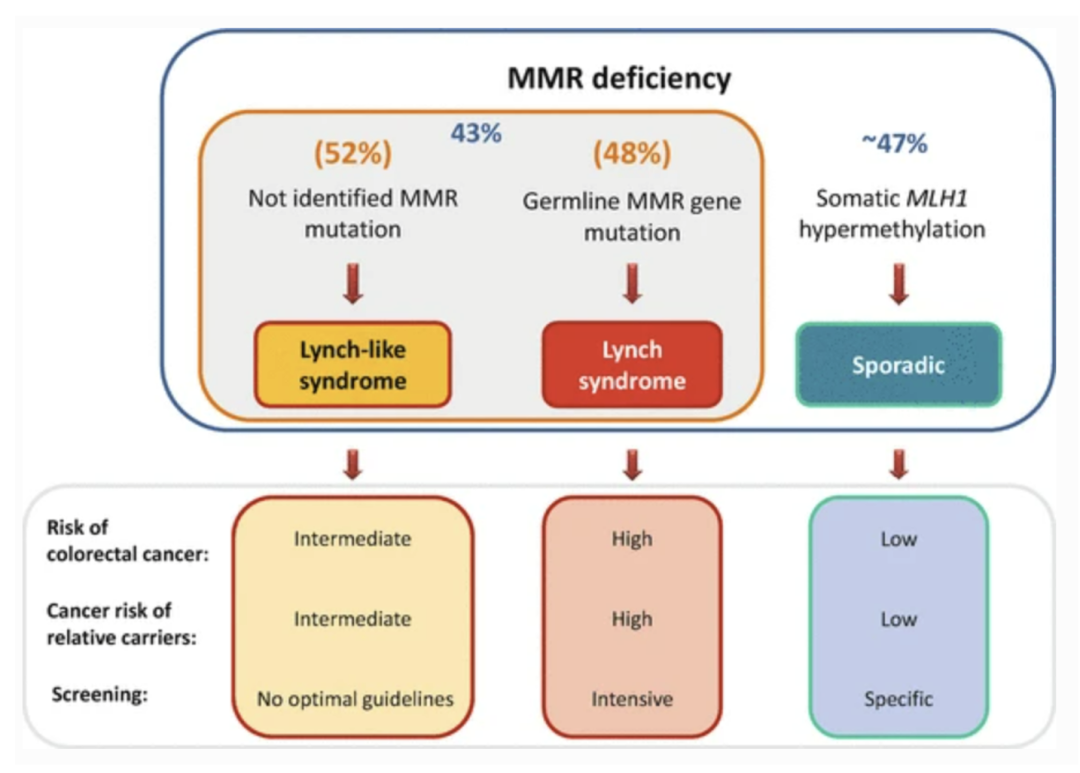
▲dMMR患者的诊断率和相关风险
Appl Clin Genet. 2014;7:183–93.
林奇样综合征发生的可能原因是什么?
LLS有几种可能的解释。首先,一些LLS患者可能实际上患有林奇综合征,因为MMR基因中可能存在一些当前基因技术无法检测到的胚系突变,例如属于内含子和启动子序列的突变。另一种解释是,除了通过基因突变导致的MMR经典失活之外,还有其他分子机制可以使MMR失活,如MMR基因表达变化的调节,导致与Lynch综合征具有非常相似的肿瘤表型 。最近有研究表明其他分子机制,例如miRNA,可以控制MMR基因表达并确定其在促进结肠肿瘤发生中的失调。另外,林奇样综合征患者也可能在MMR基因以外的基因中存在胚系突变,通常LLS患者的诊断年龄比散发病例要年轻,而且其中一些患者有LS相关肿瘤的家族史,这一事实表明,其他基因的胚系突变也可能与癌症发展有关。
据报道,一些错配修复缺陷(dMMR)患者存在MUTYH和POLE基因胚系突变。MUTYH基因突变可导致MUTYH相关性息肉病(MAP),大约 1-3% 的LLS病例携带MUTYH双等位基因突变。此外,POLE和POLD1核酸外切酶结构域的突变会导致超突变表型,从而使人们在年轻时很容易患上轻型结直肠息肉病。POLE和POLD1突变在某些情况下可能与 dMMR相关。Jansen等人对 62 例LLS患者POLE、POLD1的核酸外切酶结构域进行检测,其中有 2 例携带胚系突变,7 例携带体细胞突变,而这 9 例患者中 6 例携带体细胞MMR变异,证明了错误的校对可能是其中一些肿瘤的起始事件,导致MMR的丢失,从而导致微卫星不稳定(PMID:26648449)。
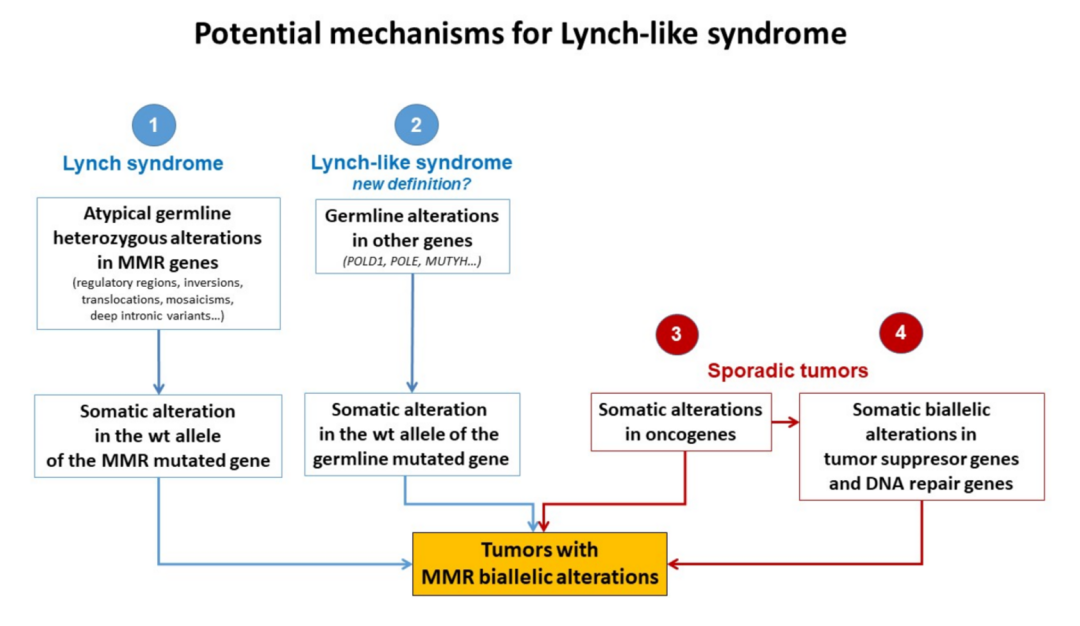
▲林奇样综合征的潜在机制
Cancers 2022, 14(5), 1115; https://doi.org/10.3390/cancers14051115
随着NGS技术的大范围应用,LLS患者也发现了其他基因的胚系变异,如EXO1、RFC1、RPA1、ERCC6、RAD54L和PALB2等。除此之外,LLS也可能为散发性起源,与肿瘤发生进展相关基因的体细胞变异或MMR双等位基因变异相关。
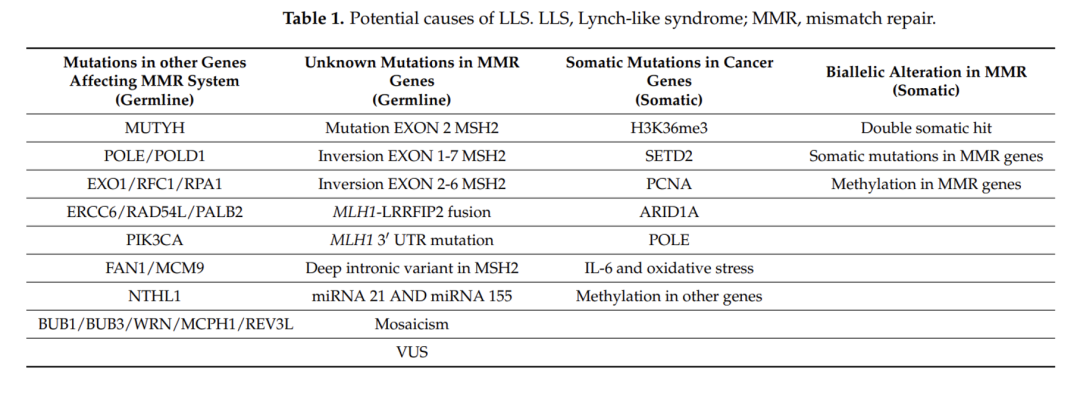
▲林奇样综合征的潜在机制
Cancers 2022, 14(5), 1115; https://doi.org/10.3390/cancers14051115
2020 年有学者对 113 名可疑LLS的患者(MSI-H和/或MMR表达缺失,但既无MMR基因胚系突变,也无EPCAM基因缺失)MMR基因体细胞变异筛查,在总共 97 名(85.8%)患者中检测到MMR基因和/或LOH的体细胞变异,其中在 72 个肿瘤(63.7%)中检测到出现体细胞双打击DH [其定义为在同一基因中检测到两个或多个致病性(PV)或可能致病性变异(LPV),或者与相同基因座杂合性缺失(LOH)相关的一个 PV/LPV],这些患者大多数是结肠癌,其次是子宫内膜癌,有意思的是DH患者有 37.5% 年龄在 50 岁以下,7 名年龄在 30 岁以下。在 24 个肿瘤(21.2%)中检测到体细胞单次打击(SH,定义为仅检测到一种PV/LPV或仅一种LOH) ,其余 17 个肿瘤(15%)未检测到MMR体细胞变异。所有DH/SH均涉及MLH1、MSH2和MSH6基因,但不涉及PMS2。另外,研究者对 41 个肿瘤样本分析了 14 基因panel的NGS数据,包括 30 个在MMR基因上检测到DH的肿瘤。结果在总共 20 个肿瘤样本中(包括 17 个DH肿瘤、2 个SH肿瘤和 1 个没有MMR体细胞变异的肿瘤)鉴定出了APC(大多数)、 POLE、PTEN基因的致病性变异。该研究结果进一步深入了解了LLS的潜在机制,MMR体细胞失活变异是早发性LLS的主要原因,其途径不同于散发的迟发性病例。
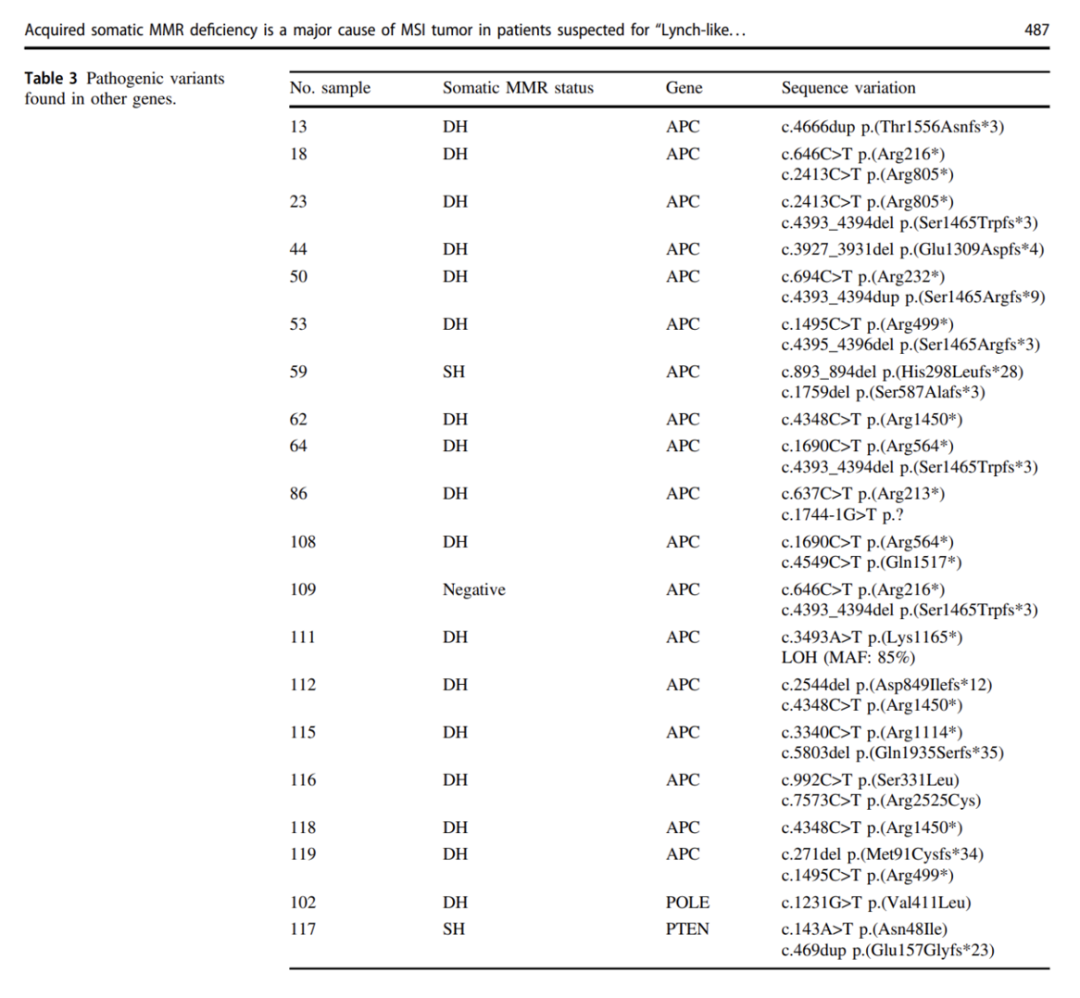
▲LLS患者发生除MMR基因外的其他基因致病性变异
Eur J Hum Genet. 2021 Mar; 29(3): 482–488.
指南/共识建议疑似林奇样综合征应做什么基因检测
《Lynch综合征相关性子宫内膜癌筛查与防治中国专家共识(2023年版)》提到:存在MMR蛋白缺陷或MSI-H状态,但随后的胚系检测证明为阴性的患者可能患有LLS,检测应扩展到包括体系或胚系DNA聚合酶Pol ɛ(POLE)和δ(POLD1)的外切酶结构域(exonuclease domains,EDMs)的检测以及体系MMR基因的检测。
▲Lynch综合征相关性子宫内膜癌筛查与防治中国专家共识(2023年版)
2019 年 11 月,英国胃肠病学会(BSG)、大不列颠及爱尔兰肛肠协会(ACPGBI)以及英国癌症遗传学组(UKCGG)共同发布了遗传性结直肠癌的管理指南建议:若没有高甲基化/BRAF突变且没有胚系致病性变异的MMR缺陷型肿瘤应进行CRC基因panel肿瘤体细胞突变检测。如果鉴定为MMR双体细胞致病变异,基于CRC家族史(FHCC),管理先证者及其一级亲属(first degree relative,FDR)。如果没有或只有一个体细胞突变,先证者及其一级亲属应作为per LS患者进行管理。

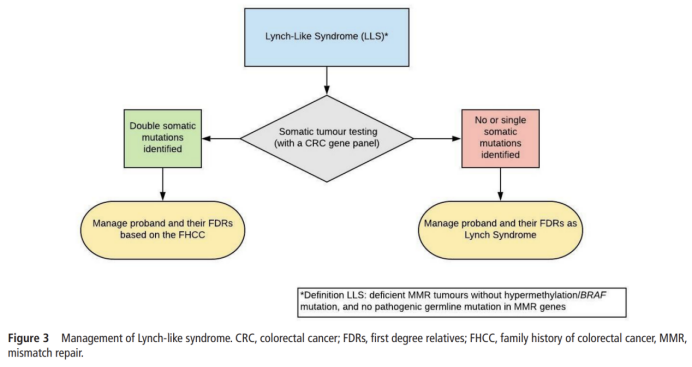
▲2019 BSG/ACPGBI/UKCGG遗传性结直肠癌管理指南(PMID: 31780574)
2019 BSG/ACPGBI/UKCGG遗传性结直肠癌管理指南还建议对“林奇样综合征”患者及其一级亲属进行与林奇综合征类似的管理,2 年进行一次结肠镜检查。
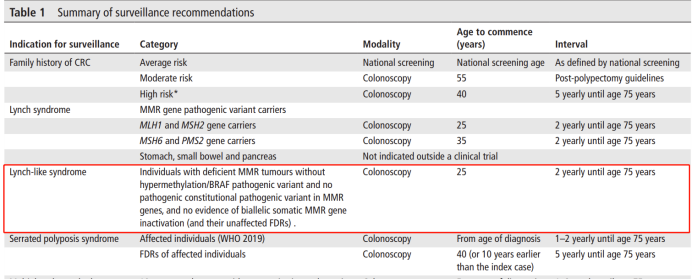
▲2019 BSG/ACPGBI/UKCGG遗传性结直肠癌治疗指南(PMID: 31780574)
什么是家族性结直肠癌X型”(FCCTX或FCCX)?
除了LS和LLS,还有第三种不同的临床定义组,即所谓的“家族性结直肠癌X型”(FCCTX或FCCX),可被视为LS的一个亚组,因为两者的临床表现非常相似,其特点是患者及其家庭成员的不同世代都有几例早发型非息肉性遗传性结直肠癌病例,都满足阿姆斯特丹的临床标准,然而,FCCTX与LS的分子水平有所不同,FCCTX患者的MMR基因不存在任何变异,因此不存在微卫星不稳定和(或)错配修复蛋白缺失。

▲遗传性结直肠癌临床诊治和家系管理中国专家共识(2018年)
随着下一代测序技术的进步,一些FCCTX可以归因于其他癌症相关基因突变导致的。最近的全基因组研究已经确定了FCCTX的几个假定候选基因,但只能解释一小部分原因,FCCTX的遗传机制在很大程度上仍然未知,正如“X 型”所暗示的意思。LS、LLS及FCCTX这三组具有不同的临床和分子特征:
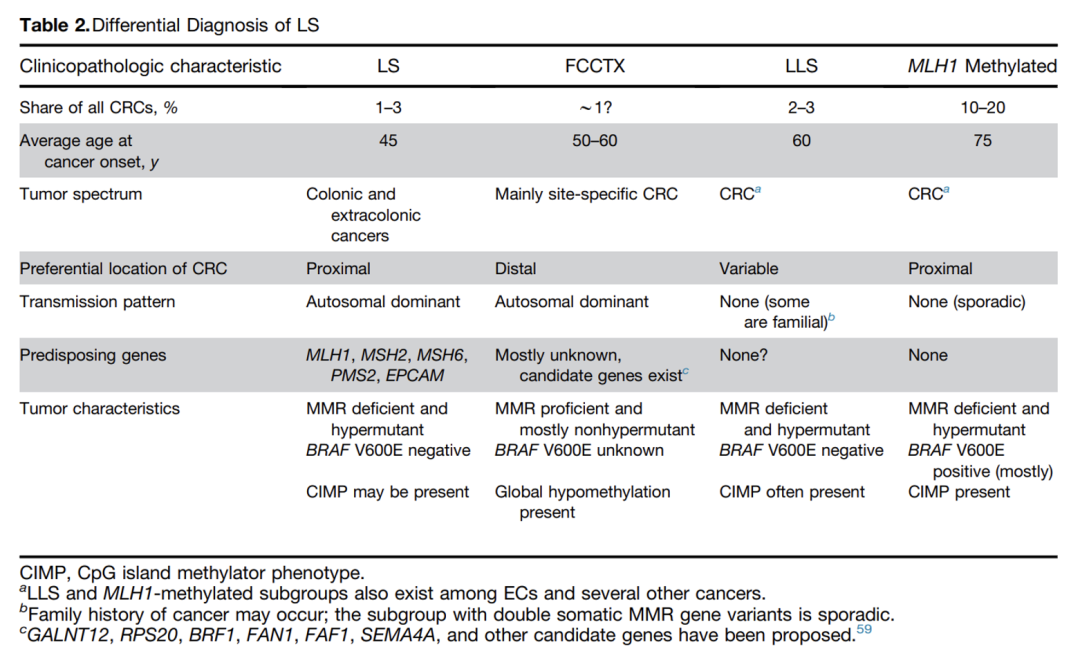
▲林奇综合征的鉴别要点
Gastroenterology 2023;164:783–799
比较这三组发生CRC的风险,显示LS风险最高,LLS次之,FCCTX最低(PMID:34469588)。由于FCCTX发生CRC的风险要低得多,指南对于该类患者并未推荐密集的监测频率。ESMO遗传性胃肠癌临床实践指南建议,FCCTX患者应每 3-5 年接受一次结肠镜监测,从 40 岁或比家族中已确诊的最年轻患者早 10 年开始。

▲ESMO遗传性胃肠癌临床实践指南



