读书报告 | KEYNOTE-495/KeyImPaCT试验:生物标志物导向的帕博利珠单抗联合治疗在初治晚期非小细胞肺癌的中期
时间:2023-11-04 17:41:11 热度:37.1℃ 作者:网络
导读
尽管帕博利珠单抗在非小细胞肺癌中具有很好的疗效,但由于肿瘤微环境的异质性,只有一小部分肺癌患者会有反应。18基因T细胞炎症基因表达谱(Tcellinf GEP,简称GEP)和肿瘤突变负担(TMB)可预测肺癌患者帕博利珠单抗治疗的反应性且成正相关。KEYNOTE-495/KeyImPaCT研究是一个以这两个生物标志物为导向、随机的二期研究,以GEP和TMB定义的4种状态不同生物学特性的肿瘤,分别为 GEPlowTMBnon-high(I组)、GEPlowTMBhigh(II组)、GEPnon-lowTMBnon-high(III组)、GEPnon-lowTMBhigh(IV组),随机接受帕博利珠单抗+ lenvatinib,帕博利珠单抗+ quavonlimab或帕博利珠单抗+ favezelimab的治疗。ORR范围:I组的为0-12.0%,II组为27.3-33.3%,III组为13.6-40.9%,IV组为50.0-60.0%。III组帕博利珠单抗+ lenvatinib的ORR达到预定的疗效阈值。每个治疗组的安全性与每个组合的已知安全性一致。这些数据证明了前瞻性以这两个生物标志物TcellinfGEP和TMB来评估一线帕博利珠单抗联合治疗晚期NSCLC临床活性的可行性,值得进一步研究(Nat Med.2023 Jul 10. doi: 10.1038/s41591-023-02385-6)。
背景资料

程序性死亡1(PD-1)或其配体PD-L1抑制剂已被批准用于晚期非小细胞肺癌(NSCLC)的一线单药或联合化疗。尽管PD-1抑制剂帕博利珠单抗在NSCLC中具有临床疗效,但只有一小部分患者会有反应,这可能是由于肿瘤微环境的异质性。
KEYNOTE-028 中发现18基因t细胞炎症基因表达谱(TcellinfGEP)和肿瘤突变负担(TMB)可预测肿瘤对帕博利珠单抗治疗的反应,都是正相关。
KEYNOTE-495/KeyImPaCT研究是,在2个TcellinfGEP和TMB生物标志物定义的4种状态不同生物学特性的肿瘤,TcellinfGEPlowTMBnon-high(组I)、TcellinfGEPlowTMBhigh(II组)、TcellinfGEPnon-lowTMBnon-high(III组)、TcellinfGEPnon-lowTMBhigh(IV组),基于3种帕博利珠单抗联合方案在晚期NSCLC患者中的分别疗效如何。
由TcellinfGEP和TMB状态定义的肿瘤,是具有不同生物学特性的肿瘤。我们采用Pembrolizumab与lenvatinib(靶向血管内皮生长因子受体1-3,成纤维细胞生长因子受体1-4,血小板衍生生长因子受-α,RET和KIT的多激酶抑制剂)或者quavonlimab(抗ctla -4抗体,作为免疫启动剂)或favezelimab(抗lag -3抗体)联合作为治疗选择。
本研究中进行的双生物标记物的前瞻性评估可能进一步帮助识别最有可能对帕博利珠单抗联合治疗有反应的非小细胞肺癌(和其他肿瘤类型)患者。
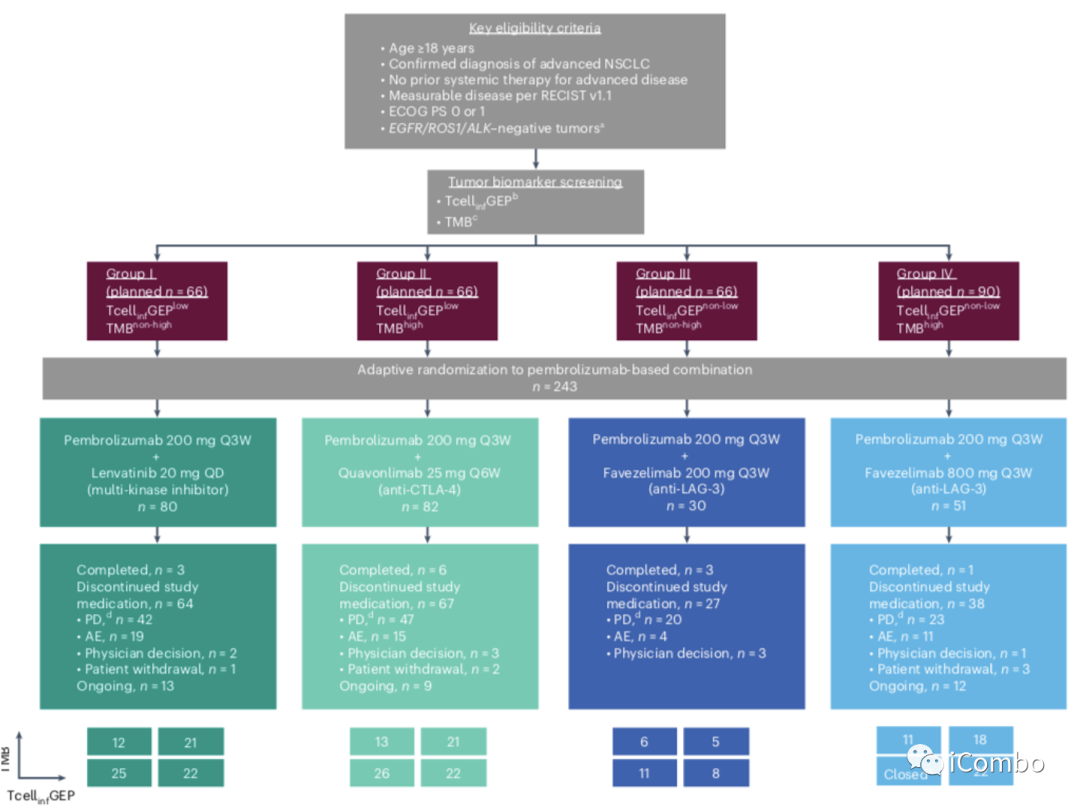
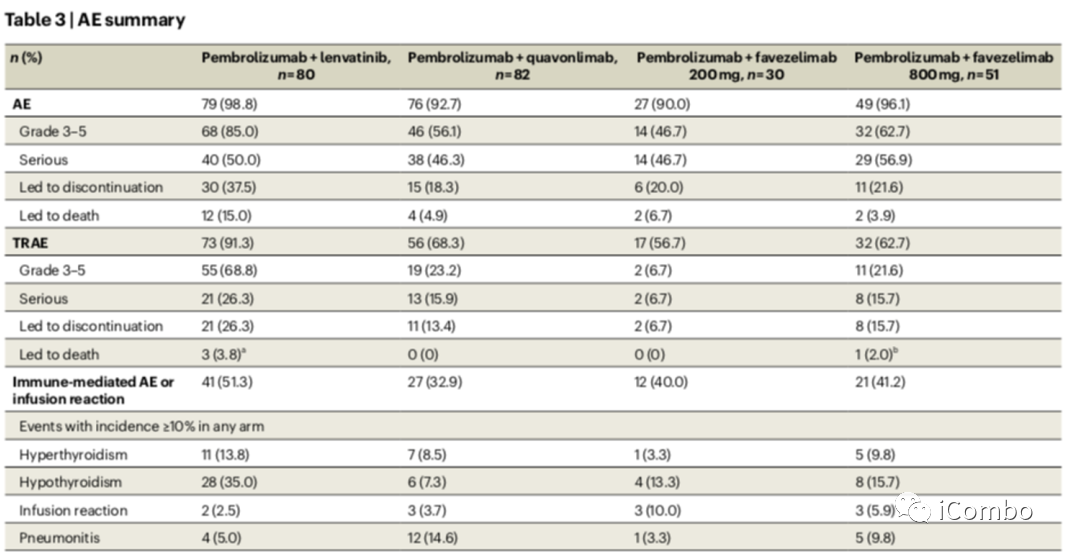
不良反应
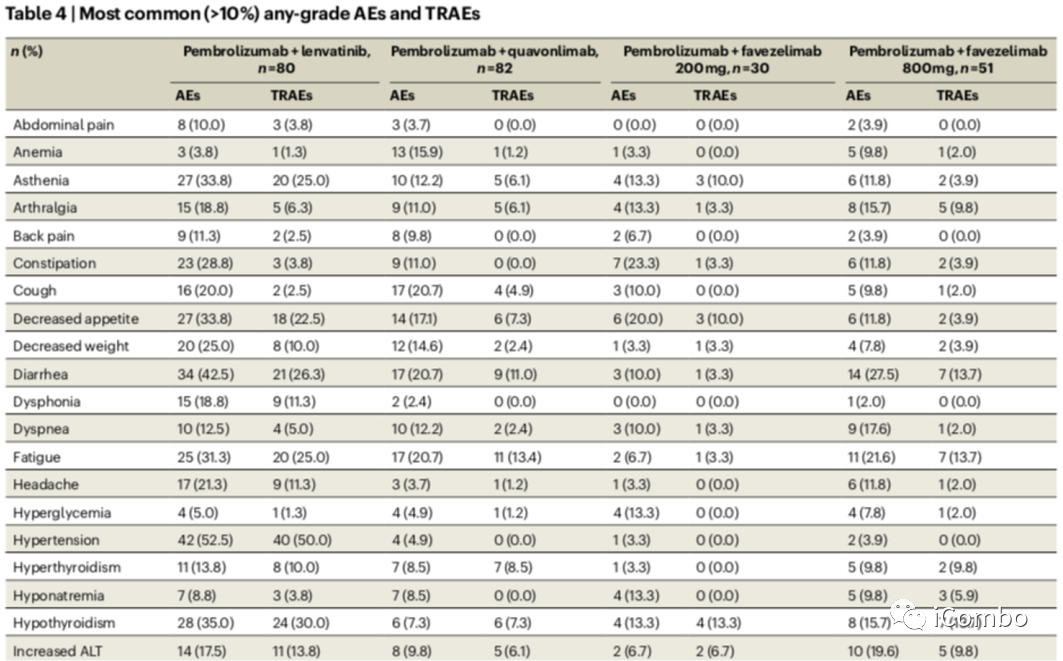
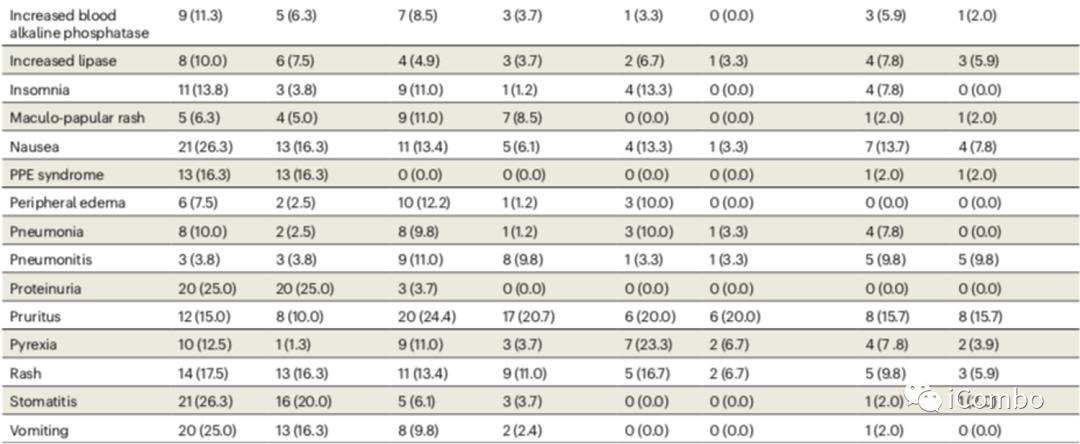
不良反应及疗效
所有治疗组中≥90.0%的患者报告了不良事件(AE),所有治疗组中≥56.7%的患者报告了治疗相关不良事件(TRAEs)。在所有治疗组中,分别有≥46.7%和≥6.7%的患者报告了3-5级AE和TRAEs所有患者中最常见的免疫介导的不良事件是甲状腺功能减退(46/243, 18.9%)、甲状腺功能亢进(24/243, 9.9%)和肺炎(22/243, 9.1%);243例患者中有11例(4.5%)发生输液反应。
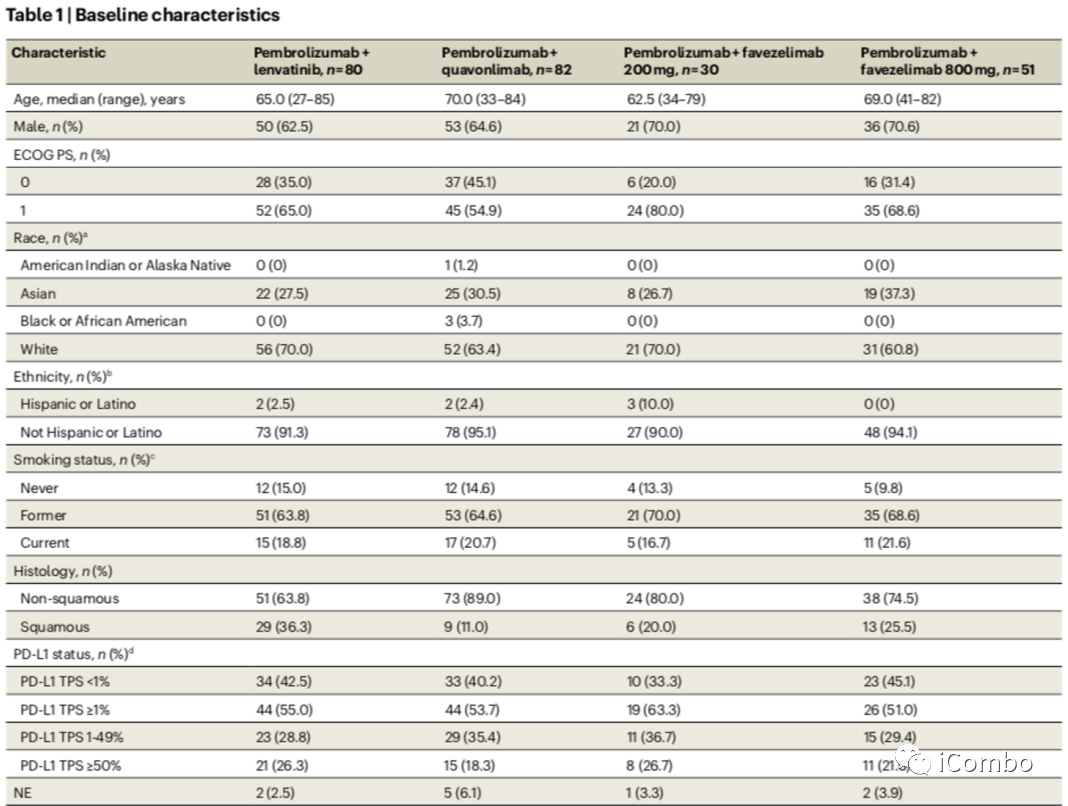
探索性生物标志物分析当跨治疗组仅通过TMB状态评估ORR时,tmb高肿瘤患者的缓解率为41%至48%,tmb非高肿瘤患者的缓解率为11%至26%。当通过各治疗组的PD-L1状态评估ORR时,肿瘤比例评分(TPS)<1%的患者的缓解率为17%至32%,TPS≥1%的患者的缓解率为26%至42%,TPS≥50%的患者的缓解率为48%至55%()。在PD-L1 TPS <1%和tmb非高肿瘤患者中,双TMB和PD-L1状态的orr从0%到24%不等,在PD-L1 TPS≥1%和tmb高肿瘤患者中,ORR从47%到64%不等。
结果和结论
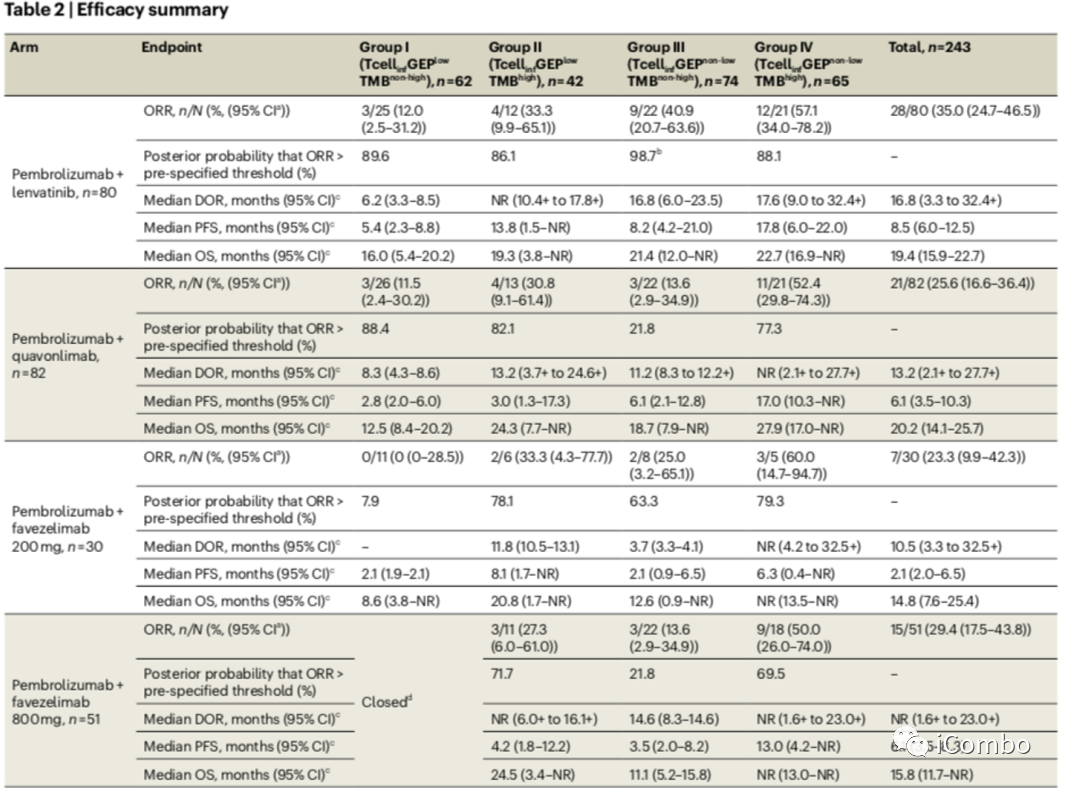
在I组中,有效率从0%到12.0%。在这个生物标志物定义的亚组中,ORR高于预先指定阈值(>5%)的后检概率为:帕博利珠+ lenvatinib组为89.6%,帕博利珠+ quavonlimab组为88.4%,帕博利珠+ favezelimab 200mg组为7.9%。I组62例患者中有9例(14.5%)的靶病变大小减少≥30%。中位反应持续时间(DOR)从6.2个月到8.3个月不等;中位PFS为2.1~5.4个月;中位OS为8.6 ~ 16.0个月。
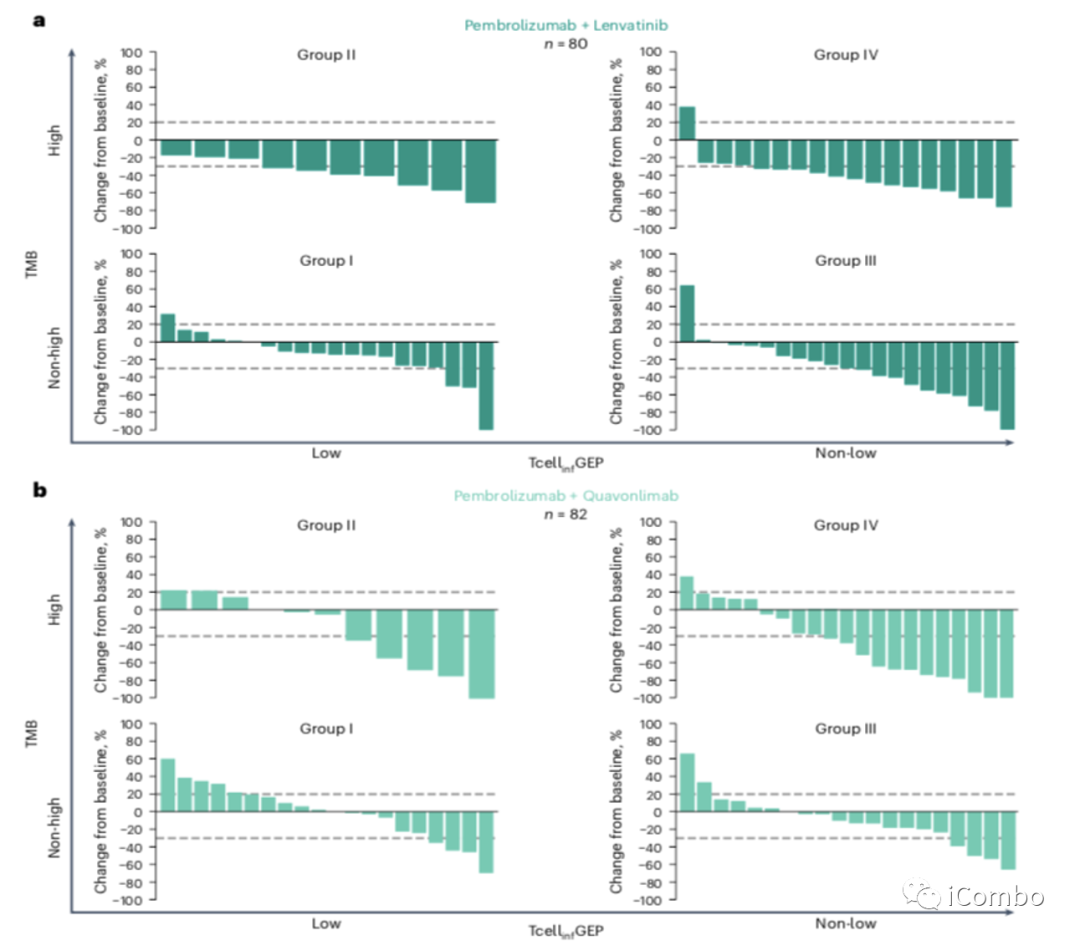
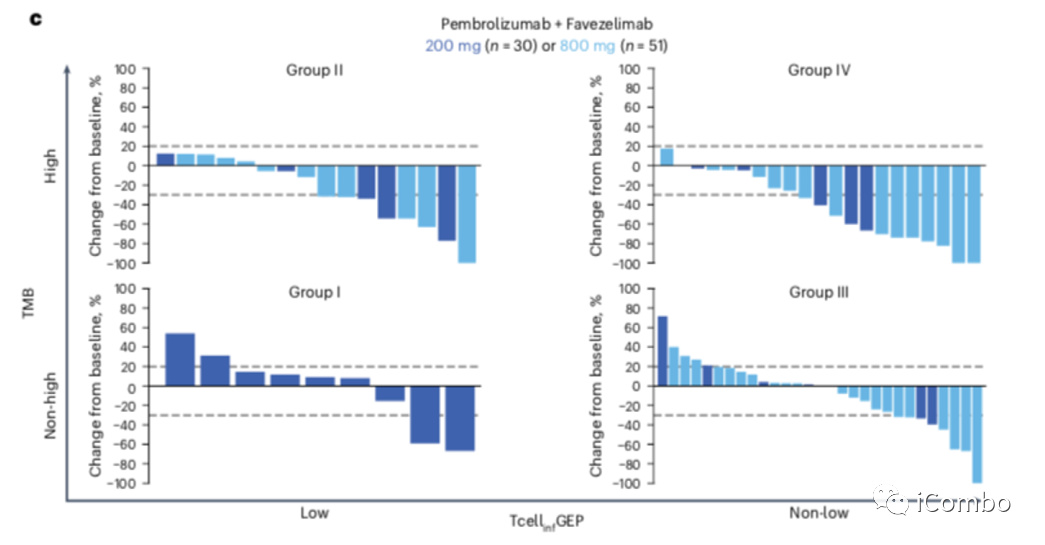
在II组中,缓解率从27.3%到33.3%。ORR高于预先指定阈值(>20%)的后检概率为:帕博利珠+ lenvatinib组为86.1%,帕博利珠+ quavonlimab组为82.1%,帕博利珠+ favezelimab 200mg组为78.1%,帕博利珠+ favezelimab 800mg组为71.7%。II组42例患者中有20例(47.6%)观察到靶病变大小减少≥30%(图2)。中位DOR范围为11.8个月至未达到(NR);中位PFS为3.0~13.8个月;中位OS为19.3~24.5个月。
III组中,ORR从13.6%到40.9%。ORR高于预先指定阈值(>20%)的概率为:帕博利珠+lenvatinib组为98.7%,帕博利珠+ quavonlimab组为21.8%,帕博利珠+ favezelimab 200mg组为63.3%,帕博利珠+ favezelimab 800mg组为21.8%。帕博利珠+ lenvatinib治疗组在III组达到预先指定的疗效条。III组74例患者中有22例(29.7%)观察到靶病变大小减小≥30%。中位DOR范围为3.7个月至16.8个月;中位PFS为2.1月至8.2月;中位OS从11.1个月到21.4个月不等。
IV组中,ORR从50.0%到60.0%。ORR高于预先规定阈值(>45%)的后检概率为:帕博利珠+ lenvatinib组为88.1%,帕博利珠+ quavonlimab组为77.3%,帕博利珠+ favezelimab 200mg组为79.3%,帕博利珠+ favezelimab 800mg组为69.5%。IV组65例患者中有38例(58.5%)观察到靶病变大小减少≥30%。中位DOR范围为17.6个月至NR;中位PFS为6.3月至17.8月;中位OS从22.7个月到NR。
讨论
KEYNOTE-495/KeyImPaCT研究的中期分析结果显示,GEPnon-lowTMBhigh(IV组)在所有治疗组合中都有良好的抗肿瘤活性和持久的反应。具体来说,III组接受帕博利珠+ lenvatinib治疗的患者,根据该亚组的帕博利珠单药治疗的历史反应率,反应通过了预先指定的20%的疗效条,根据协议定义的统计阈值,后验概率至少为95%。pembrolizumab + favezelimab治疗组没有通过预先规定的疗效条,但在IV组以及PD-L1 TPS≥1%和TMBhigh状态的患者中显示出高ORR的趋势。帕博利珠+ quavonlimab和帕博利珠+ favezelimab(200mg和800mg)治疗组未通过预先规定的疗效。
虽然在四个生物标志物定义的亚组中观察到不同的缓解率,但IV组显示出所有三种基于帕博利珠的联合治疗的最佳缓解率(ORR, 50.0%-60.0%)的趋势,并且从帕博利珠单药的历史ORR(ORR, 13-43%)的数字上有所增加;这一趋势在PFS和OS中是一致的。当帕博利珠与lenvatinib(12.0%)或quavonlimab(11.5%)联合使用时,I组表现出适度的反应,与favezelimab联合使用时无活性。
这些分析表明,使用双重TcellinfGEP和TMB评估患者入组的可行性。在这项特殊的试验中,肿瘤TcellinfGEP和TMB评估被前瞻性地用于识别先前未经治疗的晚期NSCLC患者,以接受三种基于帕博利珠的联合治疗方案。在筛选的患者中,该研究的数据返回成功率很高(>90%),TcellinfGEP和TMB评估的周转时间对于临床应用是合理的。每一种联合用药的安全性都与其他药物联合用药的研究结果一致。探索性生物标志物分析显示,TMBhigh和PD-L1 TPS≥1%的肿瘤患者的反应率更高,而TMBnon-high和PD-L1 TPS <1%的肿瘤患者的反应率适中;这些发现分别与第四组和第一组观察到的趋势一致。这些发现表明,无论炎症状态是由TcellinfGEP还是PD-L1定义,该生物标志物亚组都有富集。然而,考虑到这些分析的探索性和每个亚组的小样本量,也应该谨慎看待这些分析。


