IVD新技术:微流体在临床液体活检中应用
时间:2023-11-04 17:41:12 热度:37.1℃ 作者:网络
介绍
小细胞外囊泡(sEVs;< 200nm),含有脂质、核酸和蛋白质,sEV存在于所有体液中,因此是无创诊断和预后生物标志物的极好来源,包括癌症、感染、神经退行性病变。基于超速离心(UC)、梯度离心等传统sEV分离方法存在一系列局限性,包括处理时间长、收率低(5%至40%)、分离sEV完整性低和设备成本高。尽管许多新sEV分离方法已经减轻了上述一些问题,但它们远非理想,会引入其他问题比如纯度低及样本损失等。
在过去的十年中,微流体技术已经越来越多地被用作sEV处理和分离的基本工具,根据分离模式的不同,微流体分离sEV的策略可以分为被动和主动两类。被动分离方法不需要施加外力,而是通过使用大小相关的水动力或复杂的通道结构来分离sEV。相反,主动分离方法需要应用外力场,尤其是声场、电场和磁场来操纵sEV。主动方法已成功地用于分离血源性sEV,其特点是分离效率高,但设备制造和操作复杂,这限制了在临床环境中的使用。被动微流体系统也已成功地用于从全血中分离sEV,但受到了分离效率和回收率低、通量低的限制。在临床环境中,迫切需要制造成本低廉,操作简单,不需要专业知识,涉及最少的样品制备,并产生一致和可重复的结果,同时提供高分离纯度和回收率的EV分离系统。
近日,一组来自瑞士的研究团队在杂志Science advances上发表了一篇题为“Direct isolation of small extracellular vesicles from human blood using viscoelastic microfluidics”的文章。文章中,作者提出了一种被动、高效、粘弹性和无标签的微流体装置,能够直接从人体血液中分离sEV。集成系统包括两个模块:细胞去除模块和sEV分离模块。为了证明该系统在临床液体活检中的有效性,作者从20名癌症患者(CP)和20名健康献血者(HD)的血液中分离出sEV,并将其浓度和大小与通过金标准UC获得的数据进行比较。与现有的sEV分离技术相比,此粘弹性微流控平台具有低成本、易于操作、高sEV回收率和高纯度的特点,可用于科研和临床研究。

图片来源:Science advances
主要内容
粘弹性sEV分离的芯片设计及工作原理
下图展示了微流控装置的结构和sEV从全血分离的潜在机制。简而言之,该装置由两个按顺序排列的模块组成:细胞去除模块和sEV分离模块。工作原理是通过流体流速,可以使较大的物种迁移到中心线,而较小的物种保持在靠近侧壁的位置,这样物种可以根据大小进行分离。在第一个模块中,微米级的血液成分,特别是白细胞、红细胞和血小板,被有效地从血液样本中去除。随后,现在“无细胞”的血液被无缝地引入第二个模块,在那里sEV被分离并与其他EV亚群分离。
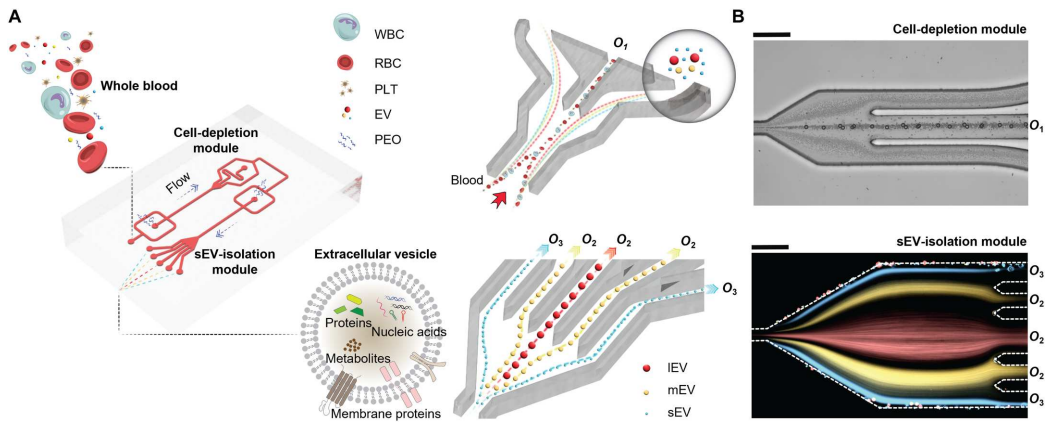
用于全血sEV分离的粘弹性微流体系统示意图
图片来源:Science advances
从复杂混合物中分离直径为100纳米的颗粒
为了确定最佳的流动参数,作者测量了直径为500 nm的颗粒的颗粒轨迹。通过优化,当I1、I2、I3的流速分别为200、2000、3000 μl/h时,500 nm的颗粒从指定出口排出。在此优化流动条件下,在细胞去除模块内(下图E,上排),大颗粒(12 μm、7 μm和3 μm)沿着中心线集中并通过出口O1排出,而小颗粒(1 μm、500 nm和100 nm)沿着靠近侧壁的流线移动,从而能够进入sEV隔离模块。在sEV分离模块内(下图E,下排),直径为1 μm和500 nm的颗粒被导向出口O2,而直径为100 nm的颗粒则通过出口O3被收集。对O3出口流出流体的分析表明,94.88%的颗粒粒径为100 nm,100 nm颗粒(sEV的代表)在O3出口的回收率为77%。这些数据证实了在连续流动下从复杂混合物中被动和高效地分离100纳米颗粒。
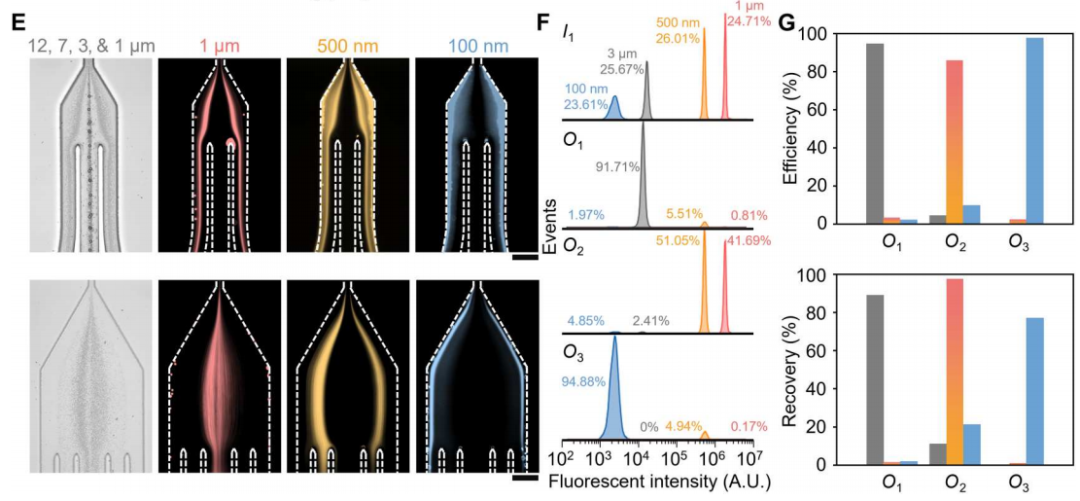
颗粒分离的理论预测与实验分析
图片来源:Science advances
从人血中直接分离sEV
为了展示粘弹性微流体装置在sEV分离中的应用,作者将荧光标记的sEV (mg -sEV)加入稀释的全血中。初始加标样品主要由白细胞、红细胞和血小板(88.6%)组成,其中少量(9.7%)为mg-sEV。几乎所有的白细胞和红细胞以及绝大多数PLT(97.1%)在细胞去除模块中被有效地去除,而lEV、mEV和剩余的血细胞在sEV分离模块中进一步去除。最后,从O3出口提取mg-sEV,纯度和回收率分别在97%和87%以上(下图A)。
接下来,作者进行了AFM和TEM测量,观察了在出口O3收集的分离sEV的形态。AFM图像描绘了圆形纳米结构,尺寸范围在50到100纳米之间。TEM测量如下图D所示,观察到典型的杯状结构(蓝色箭头所示),表明完整但脱水的膜性囊泡。TEM图像还证实了样品中脂蛋白的存在(用红色箭头标记),观察结果与先前对含sEV的血液样本的TEM研究一致。最后,通过WB分析进一步验证微流控装置在全血sEV分离中的有效性。从微流控装置分离的sEV样本和UC都表达了相似水平的外泌体蛋白HSP70、TSG101、CD81和CD9(下图E)。这证实了使用两种分离方法都可以有效地富集外泌体。

全血sEV分离物的微流控特性研究
图片来源:Science advances
用微流体和UC纯化的血源性sEV显示出
相似的蛋白质组成
为了进一步研究和比较UC和微流控装置分离的血源性sEV样品的蛋白质含量,提取两种sEV样品中的蛋白质,并使用质谱蛋白质组学进行分析。两种sEV分离方法检测到的肽和蛋白数量相似:UC来源sEV样品检测到的肽和蛋白数量为3114条,蛋白数量为210个;微流体来源sEV样品检测到的肽和蛋白数量为2711条,蛋白数量为172个。从检测到的蛋白质中,“囊泡腔(Vesicle lumen)”和“血液微粒(blood microparticles)”被确定为过度代表的成分,从而证实在标准的UC和基于微流体的分离工作流程中,EV相关蛋白都被富集(下图C)。总之,蛋白质组学分析证实,微流体方法在蛋白质组成方面表现出与金标准UC方法相似的性能。
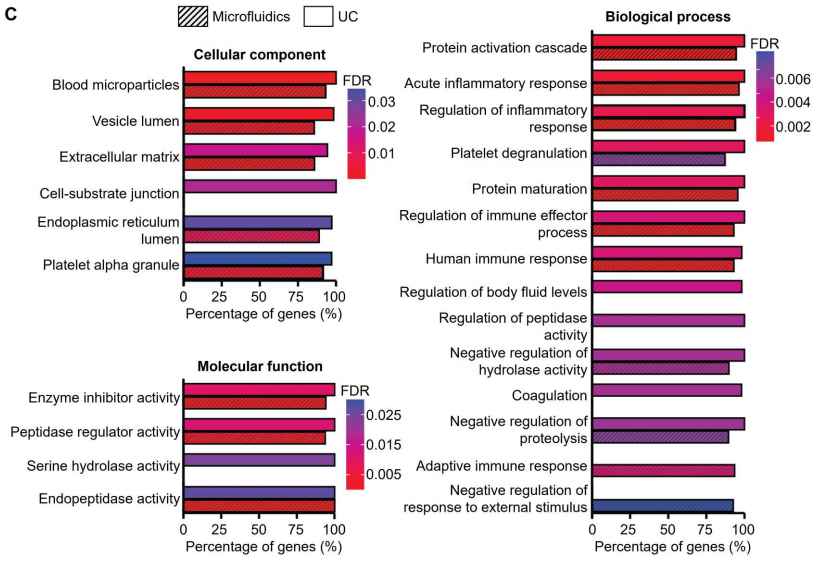
质谱法检测EV相关蛋白的pathway分析
图片来源:Science advances
从HDs和CPs收集的sEV的评估
为了充分评估微流控装置在分离sEV用于癌症诊断中的实用性,作者测量了20名癌症患者(CP)和20名健康献血者(HD)血液中分离sEV的浓度和大小分布,并将结果与金标准进行了比较。在两种方法分离的sEV衍生液体活检中,与HD相比,可以观察到CPs分泌的sEV浓度升高(下图A),这一观察结果与先前报道的结果一致。在使用相同的分离方法时,HDs和CPs形成的sEV的平均大小没有显著差异(下图B)。然而,与UC方法衍生的sEV相比,使用微流控装置分离的sEV的平均尺寸略小。这种差异可归因于UC使用高离心力,这通常会导致sEV的融合或聚集。因此,这些数据证实了微流控装置能够以高完整性分离sEV。
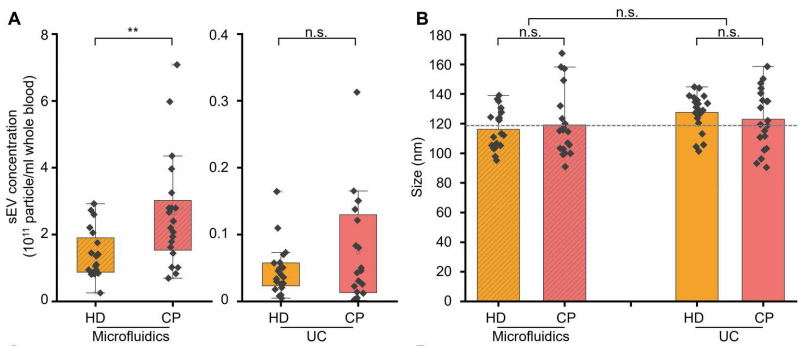
液体活检中sEV的微流控分离用于癌症诊断
图片来源:Science advances
监测sEV随血液储存时间的变化
最后,作者测量了10例HD活检中sEV的浓度和大小与血液储存时间的关系。作为血液老化过程的一部分,血细胞会脱落sEV,从而随着时间的推移增加血源性sEV的数量。下图C证实了这一预期,表明在29天的血液储存期间,sEV浓度显著增加。此外,下图D中的数据表明,在同一时间段内,颗粒尺寸的增加更为温和。因此,这些观察结果证实了微流体装置在额外监测血液质量方面的潜力。
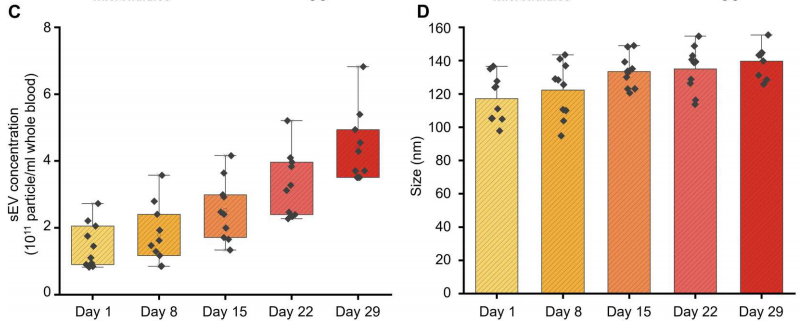
sEV的浓度和大小与血液储存时间的关系
图片来源:Science advances
总结与讨论
研究团队成功地开发了一种粘弹性微流体装置,能够连续和无标记地从人血液中分离sEV。该设备在一个单片系统中集成了两个单元操作:一个细胞去除模块,用于去除血细胞(白细胞、红细胞和血小板),一个sEV分离模块,用于将sEV与lEV和mEV分离开来。该装置在全血中显示出高效的sEV分离(纯度为97%,回收率为87%)。粘弹性微流体装置具有许多优点,包括操作成本低,易于使用,样品制备要求最小,分离纯度高,回收率高,尺寸分辨率好,使其成为sEV分选的理想选择。所有这些特性都是将该技术转移到临床环境时的关键考虑因素。临床研究证实,所开发的微流体装置能够分离和量化来自HD和CP的液体活检中含有的sEV。微流控方法能够处理小容量血液样本,具有高度可重复性(由于缺乏人工干预),并确保高sEV分离收率。此外,所提出的微流控芯片由单个玻璃面和不超过几克的有机硅聚合物组成,每个芯片的总成本低于1美元。所有这些特征在医学诊断和治疗中都具有重要的实用价值。


