JHALT:CD34+细胞如何影响移植心脏的供体内皮?
时间:2023-11-21 14:24:40 热度:37.1℃ 作者:网络
心脏移植是终末期心力衰竭的终极治疗选择。然而,宿主异体免疫反应的早期排斥和晚期动脉硬化仍然是心脏移植相关的两个主要问题。内皮功能障碍是这两种情况的核心。在移植后的早期阶段,内皮细胞(EC)是捐赠者特异性抗人类白细胞抗原(HLA)抗体的主要靶点,参与移植中微血管病变的发展。移植动脉硬化的晚期还与慢性免疫发作和完整内皮层的丧失有关,其特征是冠状动脉同心狭窄。
根据传统概念,受损的EC可以在器官移植中被邻近的捐赠者衍生的成熟ECs取代。同时积累证据支持宿主衍生细胞有助于EC替换受损。我们之前确定了居住在血管壁的活跃细胞群,其中CD34+细胞表现出分化为ECs的多能塑性。CD34首次被确定为造血细胞标记物,由各种细胞表达,并表现出分化和血管遗传潜力。我们最近的研究还描述了血管壁中的CD34+细胞异质性股骨损伤。然而,仍然需要有关移植心脏内再生内皮的EC来源的定量数据,即常驻细胞或受体细胞是否取代丢失的EC。
2023年8月25日发表在JOURNAL OF HEART AND LUNG TRANSPLANTATION的文章,我们向接受者的CD34+细胞提供了有助于心脏同种异体移植中内皮再生的直接证据。创新地,我们还证明了非骨髓衍生和循环的CD34+细胞是这一过程的主要贡献者。此外,我们描述了CD34+细胞消融导致心脏移植后EC再生减少。

我们分析了单细胞RNA测序数据,并构建了一个诱导的血统追踪小鼠,将心脏移植与骨髓移植相结合,以及心脏移植物病变中的副生物模型、细胞成分和内皮细胞群体。
研究结果显示,我们对移植心脏的单细胞RNA测序分析允许建立一个具有异质人群的内皮细胞图谱,包括动脉、静脉、毛细血管和淋巴内皮细胞。除了遗传细胞谱系追踪外,我们证明,在心脏同种异体移植中,捐赠细胞大多被受体细胞取代,在移植2周高达83.29%。
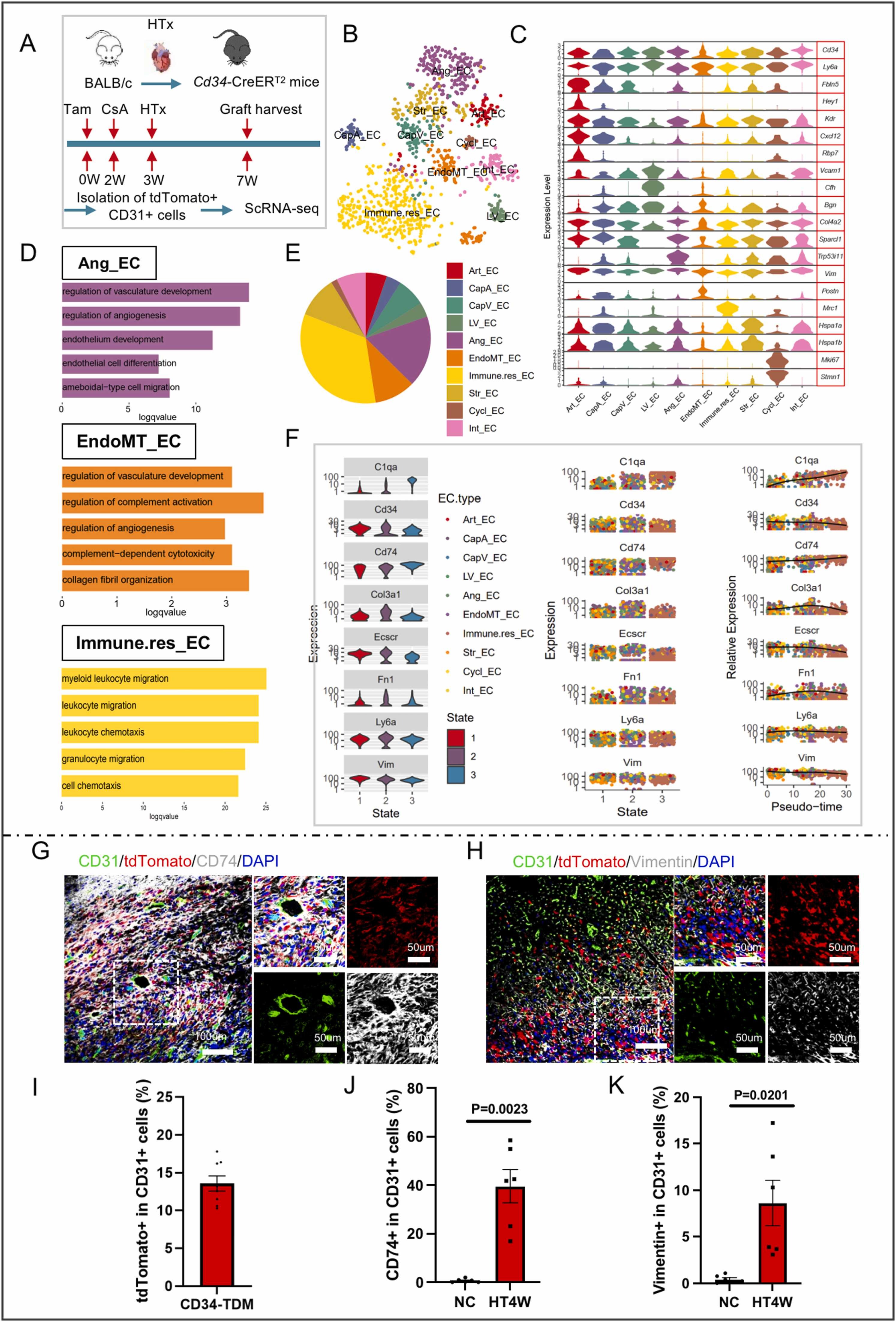
图1:接受者CD34+细胞重新填充心脏异体移植的EC
此外,受体非骨髓CD34+内皮祖细胞对细胞外基质组织和免疫调节有重大贡献,在移植心脏中具有更高的凋亡能力。在机械上,外周血源性人类内皮祖细胞通过血管内皮生长因子受体介导的途径分化为心内膜细胞。宿主循环CD34+内皮祖细胞可能通过CCL3-CCR5趋化性修复受损的供体内皮。宿主CD34+细胞的部分耗尽导致内皮再生延迟。
综上所述,我们对心脏异体移植中的内皮细胞进行了清晰的命运映射,并描述了循环宿主衍生的CD34+祖细胞有助于异体移植排斥,这可能具有临床影响,例如对心脏移植长期结果的潜在治疗效果。
原始出处
Chen T, Sun X, Gong H, Chen M, Li Y, Zhang Y, Wang T, Huang X, Wen Z, Xue J, Teng P, Hu Y, Zhang L, Yang J, Xu Q, Li W. Host CD34+ cells are replacing donor endothelium of transplanted heart. J Heart Lung Transplant. 2023 Dec;42(12):1651-1665. doi: 10.1016/j.healun.2023.08.015.


