Clin Exp Med:CAR-T治疗RRMM的细胞免疫长期随访分析
时间:2023-11-21 16:24:52 热度:37.1℃ 作者:网络
CAR-T治疗RRMM的细胞免疫
CAR-T治疗复发难治多发性骨髓瘤(RRMM)可获得良好缓解,客观缓解率(ORR)高达80-100%。当前对于CAR-T的急性不良反应(例如CRS和ICANS)已有相关共识指南,但对于晚期事件仍需进一步探索,例如on-target off-tumor效应、长期血细胞减少、免疫缺陷和感染等,很多报道都涉及免疫缺陷对CAR-T预后的不良影响,也探索了感染和重度淋巴细胞减少的诱发因素。事实上,MM最常见的死亡原因是基础疾病本身,可能与体液和细胞免疫缺陷有关。
对于接受 CAR-T 细胞治疗的 RRMM 患者,目前对免疫缺陷的机制和动力学以及相关风险因素知之甚少。《Clinical and Experimental Medicine》近日发表一篇研究,对接受不同靶点 CAR-T 的 RRMM 患者进行细胞免疫的长期随访,探讨细胞免疫重建过程,评价潜在的相关因素,通讯作者为徐州医科大学附属医院徐开林教授、曹江教授和徐州医科大学郑骏年教授。

研究方法
该研究纳入多家中心接受CAR-T的RRMM患者,CAR-T 输注后129例患者达到缓解 [(部分缓解,PR)或更佳] ,其中126例接受细胞免疫评价;3例因 CAR-T输注后早期死亡而排除(图1)。
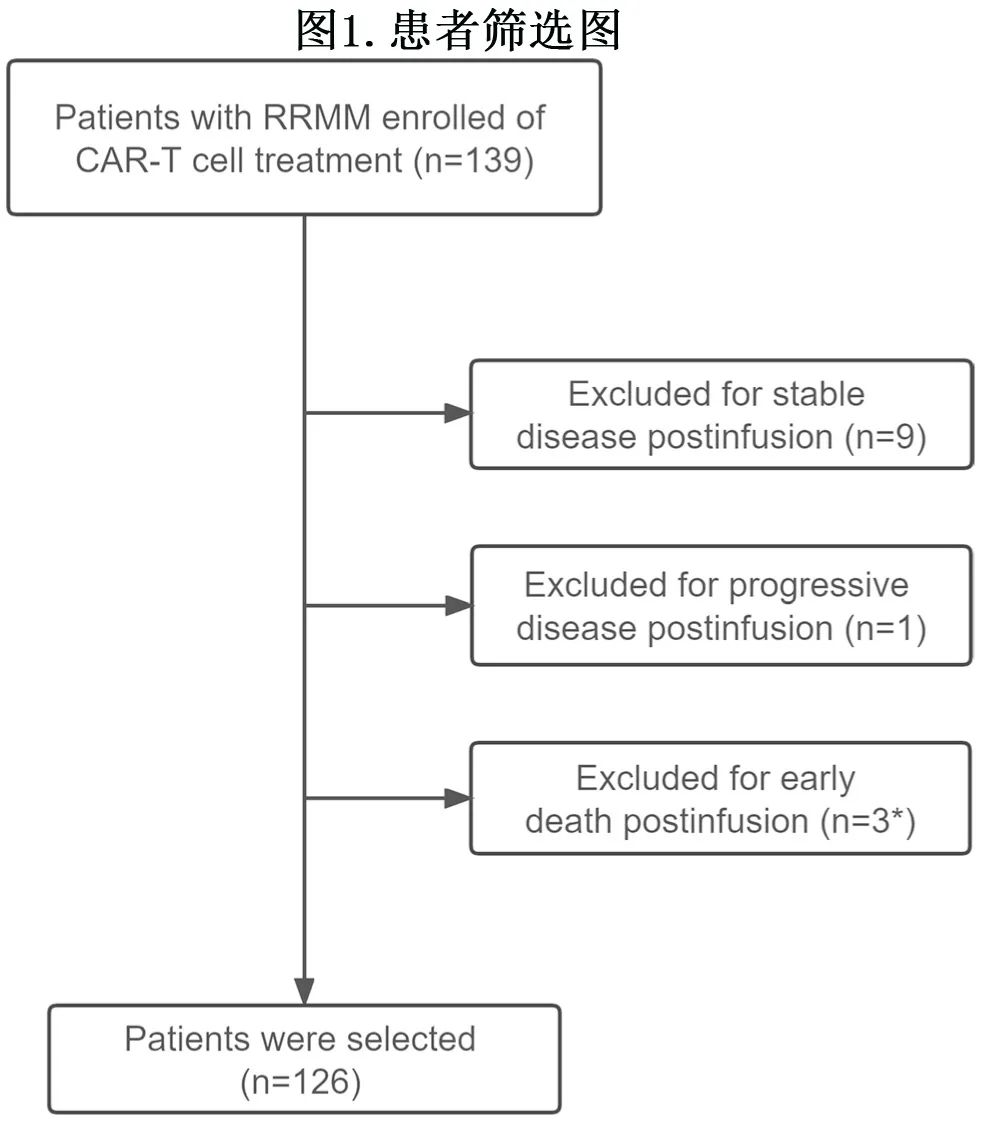
患者中28例接受单靶点抗 BCMA CAR-T,54例接受抗 BCMA 联合人源化抗CD19 (BCMA+CD19) CAR-T,44例接受抗 BCMA串联人源化抗 CD19 (BC19)CAR-T。输注前均接受环磷酰胺和氟达拉滨清淋(LD)化疗,D0时输注1×106个细胞/kg体重CAR-T细胞。
研究结果
患者特征
126例 RRMM 患者接受 CAR-T 输注并在 CAR-T 输注后获得缓解,包括58例 (46%)IgG 亚型、30例 (24%)IgA 亚型、10例 (8%)IgD 亚型、1例 (1%)IgM 亚型、22例 (17%) 轻链亚型和5例 (4%) 非分泌亚型。55例 (44%) 获得严格意义完全缓解 (sCR),31例 (25%) 获得完全缓解 (CR),26例 (21%) 获得非常好的部分缓解 (VGPR),14例 (11%) 获得PR。115例 (91%) 发生CRS,11例 (9%) 为≥3级;6例 (5%) 发生ICANS,2例 (2%) 为≥3级。34%(43/126) 的患者应用托珠单抗,64%(81/126) 的患者使用皮质类固醇。患者的基线和治疗特征见表1。在符合细胞免疫评价条件的126例患者中,中位随访时间为24.0个月。中位 PFS 为18.3个月,中位 OS 为43.3个月。

淋巴细胞动力学
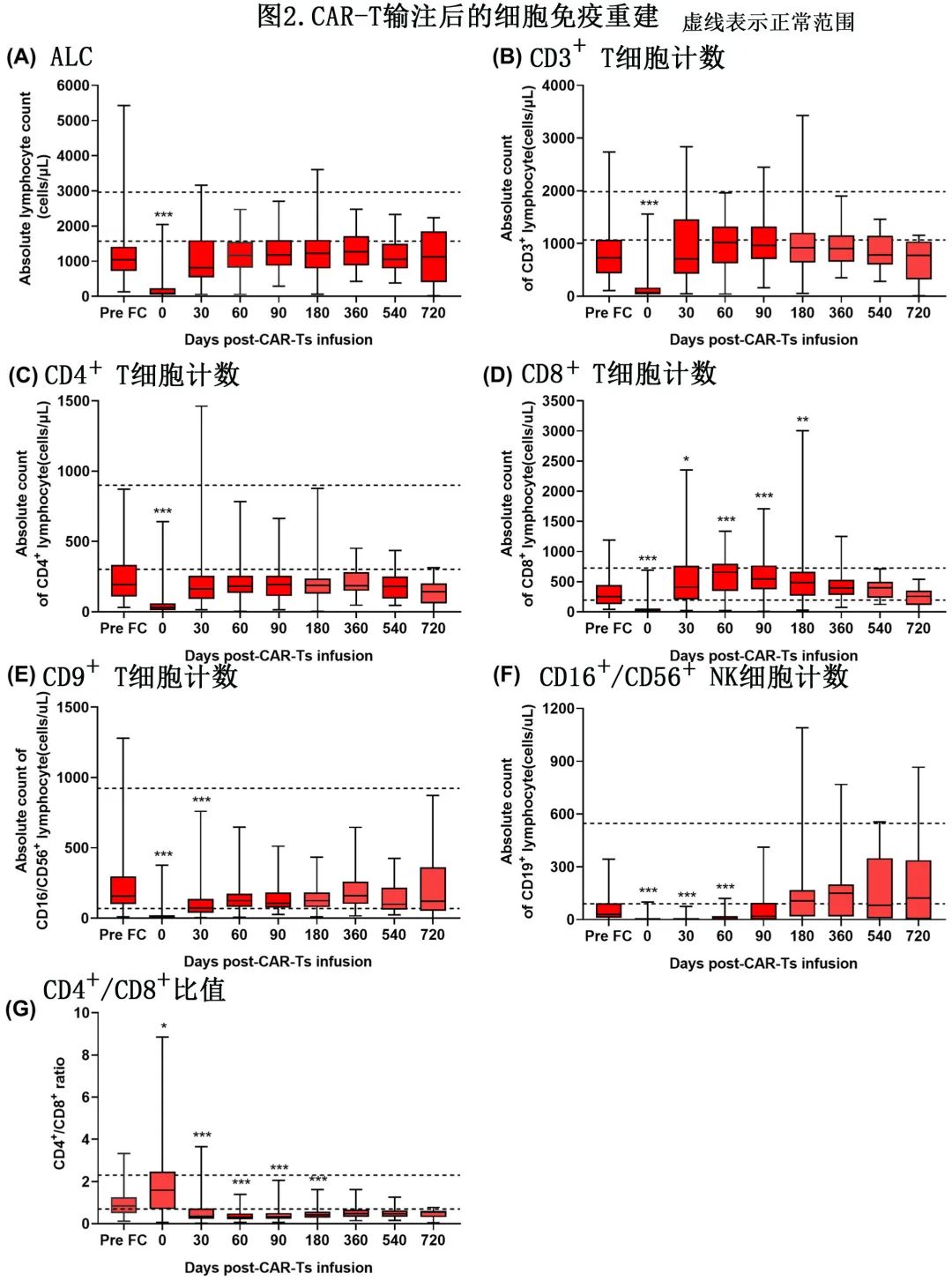
LD 化疗前的中位淋巴细胞绝对值(ALC)为1043个细胞/μL,LD前最后一次检测作为基线,基线时10%(13/126) 的患者发生重度淋巴细胞减少。因LD 化疗的预期毒性,D0时中位 ALC 为88个/μL,显著低于基线水平(图2A)。在 CAR-T 输注后的前30天内,99%(125/126) 的患者发生了重度淋巴细胞减少,大多数在180天内消退。D60 时中位 ALC 恢复至基线水平,但中位 ALC 未恢复至正常值下限 (LLN)水平(图2A)。
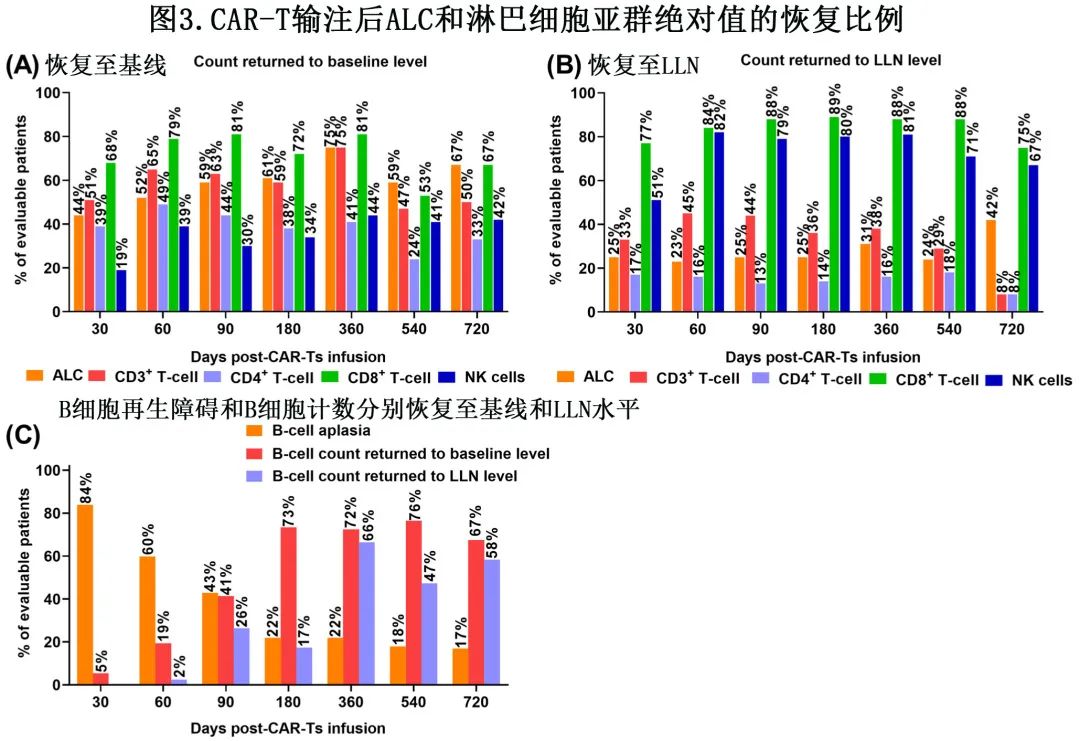
至 CAR-T 输注后D30、60、90、180、360、540和720,根据样本可检测性和删失事件,分别有44%(48/109)、52%(43/82)、59%(40/68)、61%(39/64)、75%(24/32)、59%(10/17) 和67%(8/12) 的患者的 ALC 逐渐恢复至基线水平。CAR-T输注后D30、60、90、180、360、540和 720 天,ALC 恢复至 LLN 水平的患者比例分别为25%(27/109)、23%(19/82)、25%(17/68)、25%(16/64)、31%(10/32)、24%(4/17) 和42%(5/12)(图3A, B)。
淋巴细胞亚群的动力学
使用临床 CBC 和定量B、T和 NK 细胞亚群的流式细胞术组合,评价细胞免疫重建随时间的变化。基线时中位CD4+ T细胞计数和CD8+ T细胞计数分别为196个细胞/μL和254个细胞/μL。LD 化疗后,D0的淋巴细胞亚群绝对值较基线水平显著下降(图2A–F),D0 时中位CD4+ T细胞计数和CD8+ T细胞计数分别为31个细胞/μL和23个细胞/μL。CAR-T 输注后前30天内,共有96%(121/126) 的患者CD4+ T细胞计数<200/μL。D360 和 D720 的中位CD4+ T细胞计数分别为185个细胞/μL和144个细胞/μL,分别有66%(21/32) 和75%(9/12) 的患者CD4+ T细胞计数<200/μL。总体而言,随访过程中中位CD4+ T细胞计数仍持续低于基线和 LLN 水平(图2C)。至 CAR-T 输注后D30、60、90、180、360、540、720,CD4+ T细胞计数已逐渐恢复至基线水平的患者比例分别为39%(43/109)、49%(40/82)、44%(30/68)、38%(24/64)、41%(13/32)、24%(4/17)、33%(4/12);恢复到 LLN 水平的患者比例分别为17%(18/109)、16%(13/82)、13%(9/68)、14%(9/64)、16%(5/32)、18%(3/17) 和8%(1/12)(图3A, B)。
与CD4+ T细胞不同,CD8+ T细胞的恢复在淋巴细胞亚群中最快。中位CD8+ T细胞计数在 D30 时已恢复到显著高于基线水平,随访时始终高于基线和 LLN 水平(图2D)。此外D30、60、90和180的 CD4/CD8 比值显著低于基线水平,并在CAR-T输注后 D720 内保持倒置(图2G)。另一方面,中位 NK 细胞计数在 D30 时仍显著低于基线水平但在 D60 时恢复至基线(图2E)。
BCMA 在成熟B细胞上表达,CD19是在成熟和发育 B 细胞上表达的 B 淋巴细胞表面标志物。为了评价CAR-T的on-target活性,作者定量了外周血中的CD19+ B细胞。基线时在94%(119/126) 的患者中检测到CD19+ B细胞,中位CD19+ B细胞计数为29个细胞/μL。88%(111/126) 的患者在 CAR-T 输注后前30天内发生 B 细胞再生障碍性贫血,到D30时CD19+ B细胞计数恢复至基线水平的患者比例为5%(5/105);但患者的CD19+ B细胞计数均未恢复至LLN水平。D60时CD19+ B细胞计数仍显著低于基线水平,D180时中位CD19+ B细胞计数恢复至基线和 LLN 水平(图2F)。到 CAR-T 输注后D60、90、180、360和540,分别有60%(49/82)、43%(29/68)、22%(14/64)、22%(7/32) 和18%(3/17) 的患者发生 B 细胞再生障碍性贫血(图3C),在 CAR-T 输注后>720天的末次随访时,共有8%(1/12) 的患者仍存在B 细胞再生障碍性贫血。
与长期重度淋巴细胞减少相关的因素
作者评价了可能与ALC<0.5×103/μL、CD4+ T细胞计数<0.2×103/μL和 B 细胞再生障碍性贫血的持续时间相关的因素。基于单变量分析,ALC<0.5×103/μL、CD4+ T细胞计数<0.2×103/μL和 B 细胞再生障碍性贫血的持续时间与患者特征无关,包括基线时ALC<0.5×103/μL、CD4+ T细胞计数<0.2×103/μL和 B 细胞再生障碍性贫血、髓外浆细胞瘤、既往治疗、既往CAR-T、既往ASCT、CRS分级、ICANS分级和接受托珠单抗或皮质类固醇使用 (P≥0.05)。然而,ECOG体能状态评分较高的患者CD4+ T细胞计数<0.2×103/μL的持续时间显著较短(风险比 [HR]=0.640;P=0.021)。在多变量分析中,ECOG 体能状态与CD4+ T细胞计数<0.2×103/μL的持续时间独立相关 (HR=0.670;P=0.040),老年患者 B 细胞再生障碍性贫血持续时间延长 (HR=1.625;P=0.018),年龄与 B 细胞再生障碍性贫血的持续时间独立相关 (HR=1.577;P=0.027)。此外还排除了年龄和 ECOG 体能状态对患者 PFS 和 OS 的影响 (P>0.05)。
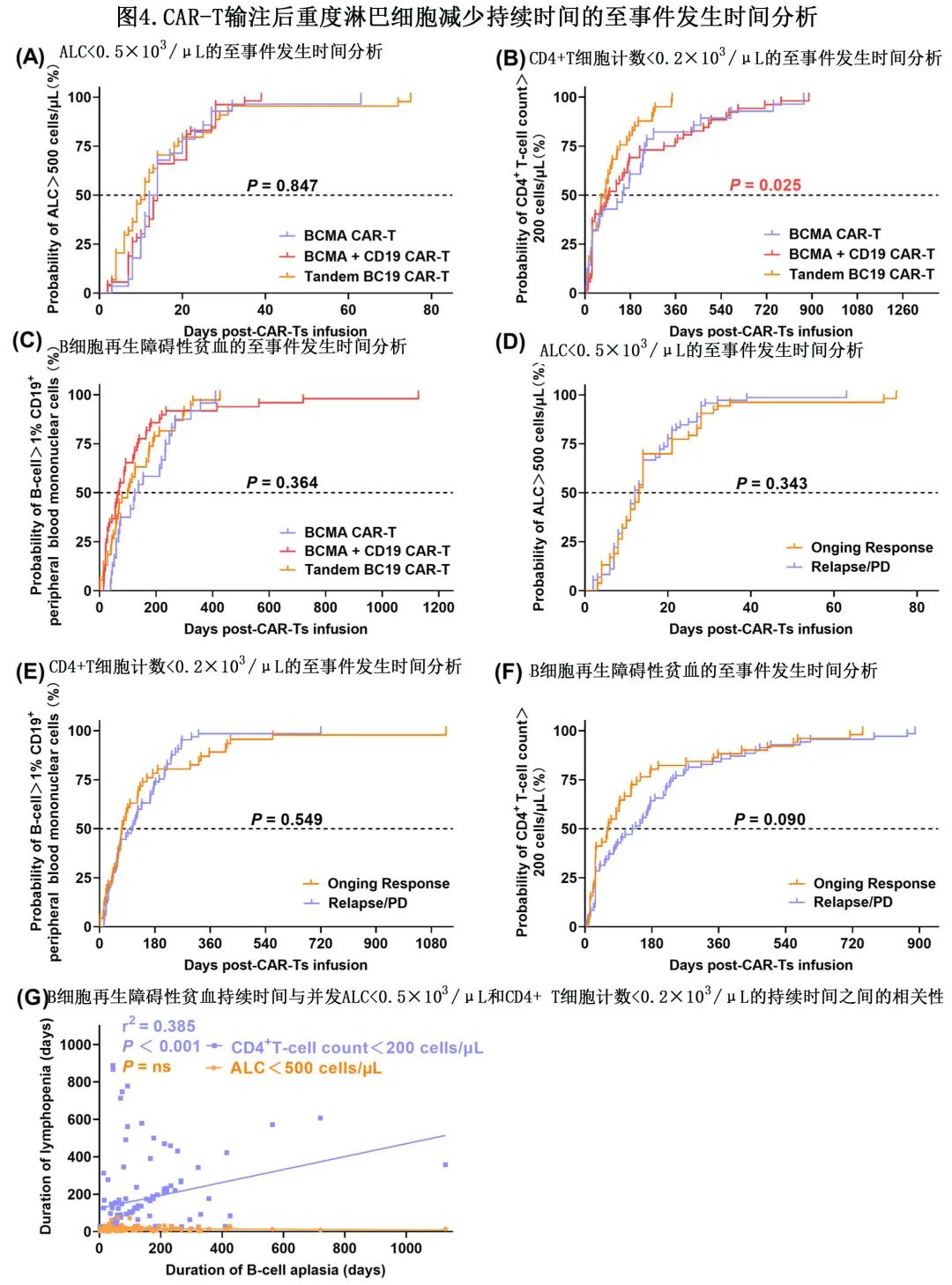
为进一步探讨不同类型 CAR-T 输注对严重淋巴细胞减少恢复的影响,按 CAR-T 类型对患者进行分层。接受串联 BC19 CAR-T输注的患者CD4+ T细胞计数<200/μL的持续时间显著短于BCMA CAR-T和BCMA+CD19 CAR-T (P=0.025),而ALC<500/μL与 B 细胞再生障碍性贫血之间未见明显差异(图4A-C)。然而在随访结束时,接受串联 BC19 CAR-T治疗的患者中41%(18/44)的CD4+ T细胞计数仍<200/μL。接受 BC19 CAR-T 的患者中位 PFS 短于接受其他两种类型 CAR-T的患者但无显著差异 (P=0.095)。此外,还按照 CAR-T 输注后的患者临床应答对患者进行分层。结果显示,与 CAR-T 输注后复发或进展的患者相比,持久缓解患者的ALC<500/μL、CD4+ T细胞计数<200/μL和 B 细胞再生障碍性贫血的持续时间没有差异(图4D–F)。当比较同一患者内所有严重淋巴细胞减少的持续时间时,B细胞再生障碍性贫血的持续时间仅与CD4+ T细胞计数<200/μL的持续时间呈中度正相关 (r2=0.385,P<0.001)(图4G)。
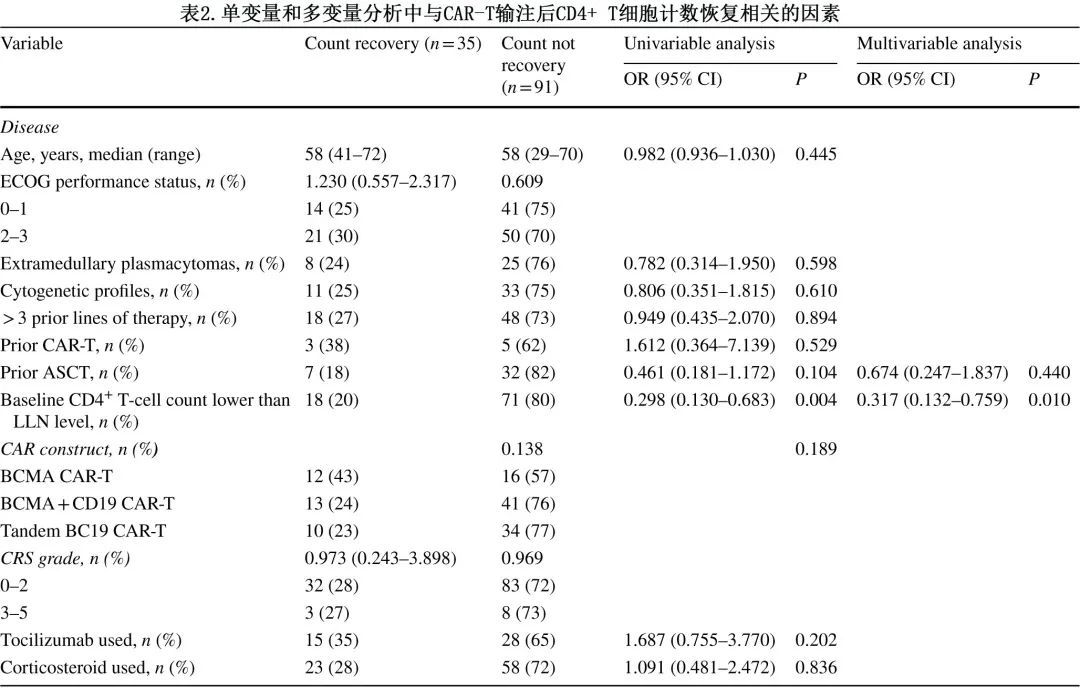
与计数恢复相关的因素
在单变量和多变量logistic回归分析中评价了可能与计数恢复相关的患者和治疗特征。基于单变量分析,ALC恢复与既往无ASCT(OR=0.222;P=0.001) 和 CAR-T输注类型(68%接受 BCMA CAR-T的患者、50%接受BCMA+CD19 CAR-T的患者和30%接受串联 BC19 CAR-T 的患者观察到恢复,P=0.005)统计学显著相关;多变量分析显示,既往 ASCT 与 ALC 恢复独立相关。CAR-T 输注后28%(35/126) 的患者CD4+ T细胞计数恢复,且与基线时CD4+ T细胞计数>LLN 水平显著相关(优势比 [OR]=0.298;P=0.004);多变量分析中,基线时CD4+ T细胞计数<LLN 水平与CD4+ T细胞计数恢复独立相关(表2)。在单变量分析中,与CD19+ B细胞计数恢复显著相关的包括ECOG 体力状态2-3(OR=2.444;P=0.015)、没有髓外浆细胞瘤 (OR=0.287;P=0.004)、没有既往ASCT(OR=0.672;P=0.002)和 CAR-T 输注类型(82%接受 BCMA CAR-T 的患者、54%接受BCMA+CD19 CAR-T的患者和14%接受串联 BC19 CAR-T 的患者恢复,P<0.001);多变量分析中发现髓外浆细胞瘤、既往 ASCT 和 CAR-T 输注类型与CD19+ B细胞计数恢复独立相关。大多数CD8+ T细胞计数和 NK 细胞计数恢复,但无法进行统计分析。
感染并发症
108/126例患者 (85.7%) 在 CAR-T后接受 G-CSF 治疗中性粒细胞减少,43例 (34.1%) 患者因中性粒细胞减少接受抗真菌预防治疗,使用泊沙康唑期间无患者发生真菌感染。共有112例 (88.9%) 患者接受了抗病毒预防;45例 (35.7%) 患者接受了抗肺孢子虫预防治疗,随访期间未发现肺孢子虫感染患者。
在 CAR-T 输注后的前30天内,27例 (21.4%) 患者发生29起感染,大多数为轻度至中度 (21/29;72.4%),最常见的微生物为细菌 (n=21),其次为真菌 (n=3) 和病毒 (n=1);感染部位:肺23例,上呼吸道7例,肠道4例,泌尿道3例,血流1例,皮肤软组织1例。30天后44例 (34.9%) 患者发生56起感染,包括20起重度感染,最常见的微生物为细菌 (n=45),其次为真菌 (n=6) 和病毒 (n=3);感染部位:肺27例,上呼吸道11例,肠道6例,泌尿道5例,血流2例,皮肤软组织5例。1例患者在 CAR-T 输注后3.8个月死于菌血症,是本研究中唯一一例与感染相关的死亡。除1例发生5级感染外,所有感染均通过适当和及时治疗得到控制。
作者评价了第30天免疫重建不良是否与第30天后的感染相关。与保持无感染的患者相比,继续发生感染的患者在第30天的CD4+ T细胞计数显著降低 (P=0.023)。进一步分析证明,与轻度感染患者相比,重度感染患者第30天CD4+ T细胞计数无显著降低 (P=0.112)。此外作者开发并验证了 CAR-T 细胞输注后感染并发症预测的模型,该预测模型中的预测因子是CD4+ T细胞计数。将预测风险评分应用于研究队列后,估计的 AUROC 为0.631,表明风险评分的鉴别能力更好。该模型风险概率的截断值为105.5,敏感性为78.3%,特异性为50.0%。
血细胞恢复与PFS和OS的关系
为研究疾病复发或进展与 ALC 和淋巴细胞亚群绝对值的相关性,作者分析了早期复发或进展(输注3个月内复发或进展)和晚期复发或进展(输注3个月后复发或进展)之间的差异。在 CAR-T 输注后达到缓解的患者中,60%(75/126) 疾病复发或进展,其中13%(10/75) 为早期复发或进展,87%(65/75) 为晚期复发或进展。早期和晚期复发或进展患者的 ALC 和基线时各淋巴细胞亚群的绝对值无显著差异。经过长期随访进一步发现,在 CAR-T输注后3、6和12个月,ALC恢复患者的 PFS 和 OS 以及每个淋巴细胞亚群的绝对值与未恢复患者无显著差异 (P>0.05)。
总结
该研究对126例 CAR-T 输注后达到缓解的患者进行了长期随访的细胞免疫研究。淋巴细胞耗竭 (LD) 化疗后,D0时淋巴细胞绝对值 (ALC) 和淋巴细胞亚群绝对值显著低于基线。99%的患者在前30天内发生≥3级淋巴细胞减少,但大多数在180天内消退。随访时中位CD4+ T细胞计数始终低于基线和正常下限 (LLN) 水平,而中位CD8+ T细胞计数在 D30 恢复至基线和 LLN 水平。在D60,中位 B 细胞计数仍低于基线水平,并在 D180 恢复至基线和 LLN 水平。在前30天,27例 (21.4%) 患者发生29起感染,大多数为轻度至中度 (21/29;72.4%)。第30天后,44例 (34.9%) 患者发生56起感染,包括20起重度感染。1例患者在 CAR-T 输注后3.8个月死于菌血症。
总之,大多数 RRMM 患者会出现 LD 化疗和 CAR-T 输注引起的早期细胞免疫缺陷。除CD4+ T细胞外,CAR-T输注第30天后 ALC 和大多数淋巴细胞亚群可逐渐恢复;部分患者可出现长期CD4+ T细胞免疫抑制但无重度感染(可能与 CAR-T输注有关)。需要长期监测和预防机会性感染,以提高 CAR-T 细胞治疗的长期安全性。由于该研究受其回顾性和样本量的限制,还需要进一步的研究来确定 CAR-T 细胞治疗后细胞免疫缺陷的可改变的风险因素和对预后的影响。
参考文献
Cheng H,Ji S,Wang J,et al. Long‑term analysis of cellular immunity in patients with RRMM treated with CAR‑T cell therapy.Clin Exp Med . 2023 Oct 31. doi: 10.1007/s10238-023-01232-9.


