专家解读 | 靶向PD-L2-RGMb 克服微生物相关的免疫治疗耐药
时间:2023-11-22 11:24:20 热度:37.1℃ 作者:网络
导读
PD-1/PD-L1抗体虽然为部分恶性肿瘤患者带来长生存获益,但在获批适应症中有效率在13%-69%;探索免疫检查点抑制剂(ICIs)的联合疗法是免疫治疗的重点,而益生菌疗法联合ICIs是目前的一个研究热点。虽然有研究报道过双歧杆菌在促进ICIs疗效上的作用,但是部分临床前研究也报道过肠道内双歧杆菌和鼠李糖乳杆菌对于ICIs的抑制作用,提示益生菌影响ICIs的具体机制尚待进一步探索。
肠道菌可以通过多种方式促进抗肿瘤免疫,有报道指出相对于单药PD-1抗体,联合粪菌移植可以30%客观有效率,但仍不清楚是解除免疫抑制的具体机制。作者在此提出两个假设:1、特定的肠道菌可改变适应免疫受到抑制的肿瘤微环境。2、该菌群可能通过靶向共抑制分子家族调节免疫应答。研究发现C. cateniformis等肠道菌群通过特异性下调PD-L2-RGMb信号通路而促进PD1抗体的免疫应答(Nature. 2023 May; 617(7960):377-385. doi: 10.1038/s41586-023-06026-3)。
结果
健康人类或小鼠肠道菌群的存在,能够增强抗PD-L1/PD-1抗体免疫治疗对结直肠癌小鼠(MC38)的抗肿瘤效果,在引流淋巴结中观察到更多免疫细胞浸润。

为了知道肠菌在免疫细胞与肿瘤激战的过程中起到什么作用,研究者们对免疫细胞上免疫检查点的表达状况进行分析。结果发现,肠道菌群可以影响免疫细胞上的PD-L2表达水平。与肠菌被抗生素处理干净的小鼠相比,定植有健康人类肠菌的结直肠癌小鼠肠道和肿瘤引流淋巴结中免疫细胞上的PD-L2水平降低。
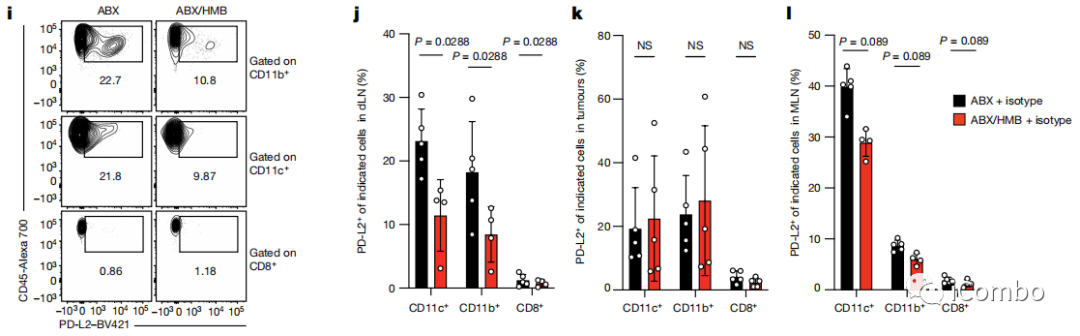
于是作者在此得出结论:1、健康人群的肠道菌有利于PD-1/PD-L1抗体的抗肿瘤作用;2、健康人群的肠道菌对PD-1/PD-L1抗体的协同作用可能与DC细胞的PD-L2下调有关。然而新的问题也随之引出:PD-1/PD-L1抗体无效的患者肠道菌群是否有相反的效应?
通过粪菌移植发现将抗PD-1抗体治疗无效的黑色素瘤患者的粪便被移植给结直肠癌小鼠后,虽然单一的抗PD-L1抗体治疗也有效果,但是联合抗PD-L2抗体显著抑制肿瘤增殖。而定植有完全缓解的患者粪便的小鼠,在某种菌群的影响下,只需要单纯抗PD-L1抗体的治疗就可以获得良好的抑制肿瘤效果,无需抗PD-L2抗体治疗来帮忙。经鉴定,研究者们找到了Coprobacillus cateniformis(C. cateniformis)
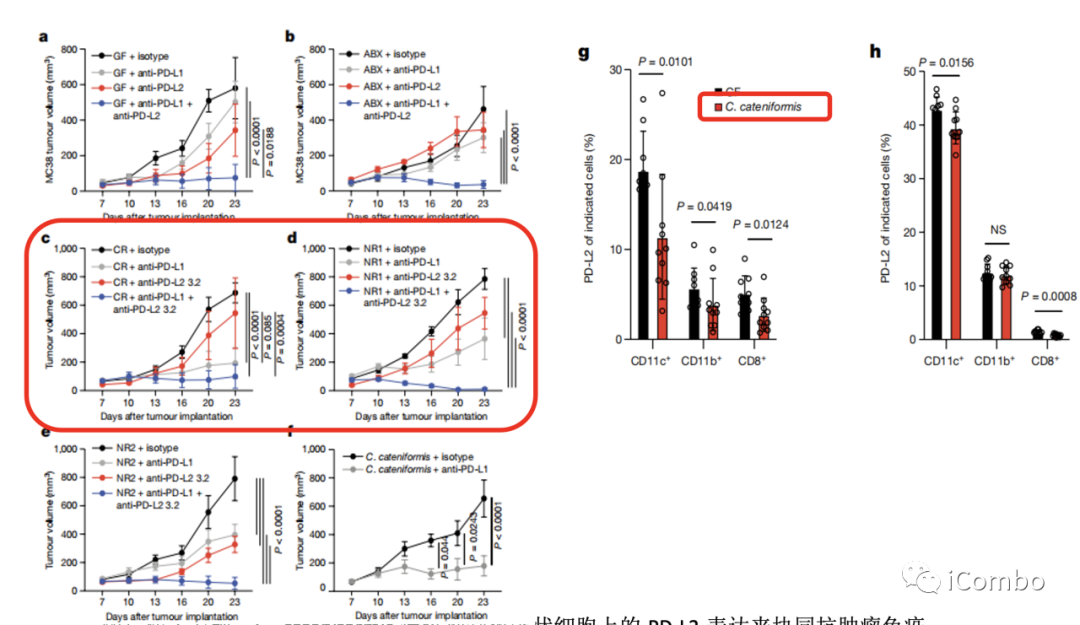
随后作者发现,C. cateniformis通过抑制树突状细胞上的PD-L2表达来协同抗肿瘤免疫治疗。左边的体外实验证实,ca菌处理过的DC,PD-L2表达水平下调,同时共培养体系中的杀伤性T细胞水平增加,而这种效应一旦通过DC过表达PD-L2之后就消失了。给予PD-L2过表达的DC组肿瘤生长得最快,加用C. cateniformis可以延缓肿瘤增殖;同时给予野生型的DC+C. cateniformis肿瘤增殖明显受到抑制。

于是作者得出结论:1、抑制DC上的PD-L2表达可以促进抗肿瘤免疫;2、C. cateniformis依赖于DCs上PD-L2的下调来增强抗肿瘤免疫。这篇论文的主体逻辑到此其实可以告一段落,即在PD-1通路调节T细胞活性的过程中,肠菌可以起到抑制PD-L2的作用,从而协助免疫治疗。但研究者们观察到,同时使用药物阻断PD-1和PD-L2,比单独阻断PD-1具有更好的抗肿瘤反应。这意味着,除了与为人熟知的老搭档PD-1合作,PD-L2还有其它办法来调节肿瘤免疫。
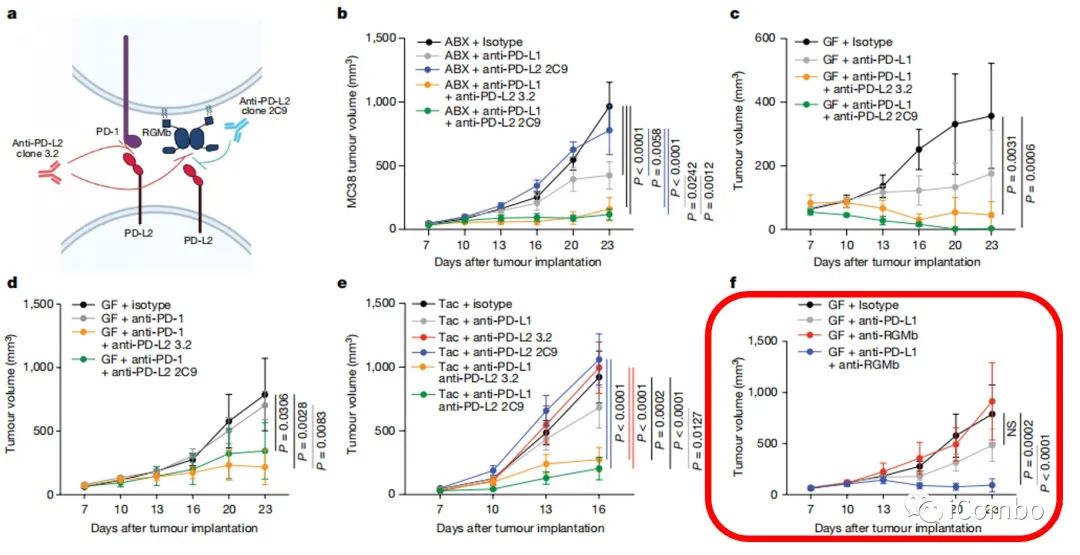
在进一步的探索中,RGMb分子引起了研究者们的注意。RGMb主要以其在神经系统发育中的作用而闻名,它也存在于T细胞的表面。目前还没有确认RGMb是否参与调节T细胞介导的抗肿瘤免疫反应,不过有研究表明,PD-L2和RGMb分子结合可以调节肺部的免疫耐受性。
于是作者进一步设计了一组动物实验,利用ABX、GF、Tac三种小鼠模型,证明任意阻断PD-L2或RGMb均可促进PD-L1/PD-1抗体的抗肿瘤免疫效应。而对于肠菌缺乏的患癌小鼠来说,与单独接受抗PD-L1抗体治疗相比,不管是使用抗PD-L2抗体,还是抗RGMb抗体,与抗PD-L1抗体联合治疗都能够抑制肿瘤生长。而拥有健康人类肠菌的患癌小鼠,联合治疗与单一的抗PD-L1抗体治疗效果差距不大。
小鼠中RGMb的表达。发现C. cateniformis可以减少CD8+T细胞RGMb的转录水平,同时用流式进行佐证。当阻断PD-L2与RGMb结合,可以提高CD4+、CD8+T细胞浸润水平,减少Treg比例。

作者用两种条件敲除的小鼠模型,分别敲除调CD4和巨噬细胞上的RGMb,发现CD4上面的RGMb敲除后也有协同PD-L1的抗肿瘤免疫效应,而巨噬细胞敲除后RGMb后不受影响。同时通过流式验证了CD4+T细胞表达的RGMb同样影响抗肿瘤免疫;单核巨噬细胞上的RGMb表达不影响抗肿瘤免疫;PD-L1联合抗RGMb可减少Treg细胞比例、促进炎症反应。
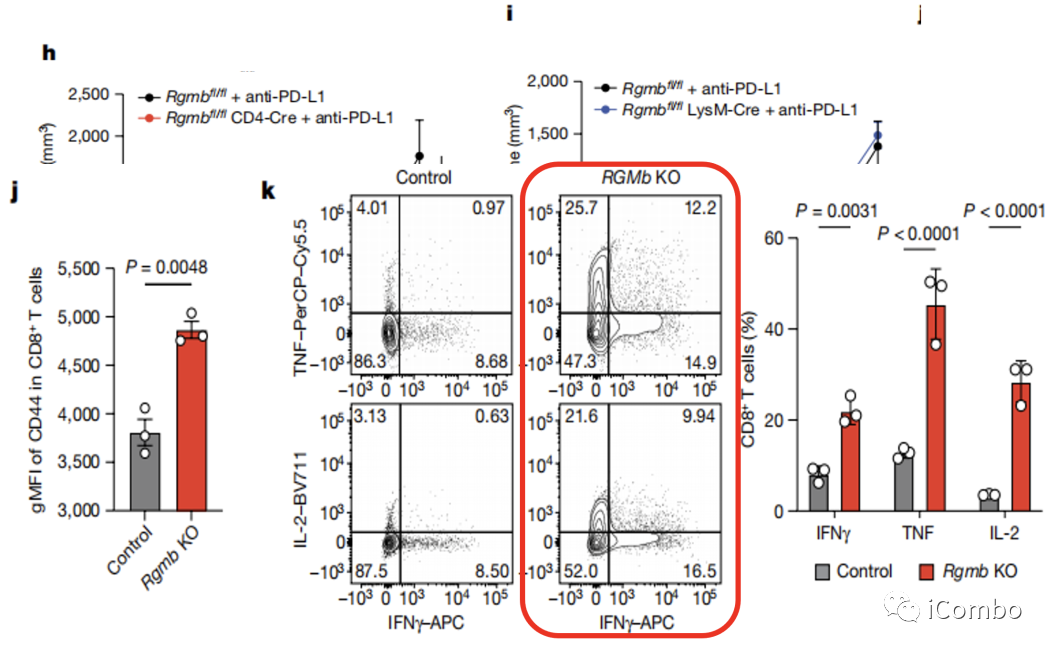
最后,作者得出结论:1、靶向PD-L2/RGMb通路可作为潜在的有效策略来治疗对PD-L1/PD-1免疫疗法无应答的患者;2、定植C. cateniformis等肠道菌群也能够通过下调PD-L2和RGMb的表达,来增强免疫治疗效果。


