专家论坛|陈金军:进展性慢性肝病发生慢加急性肝衰竭的风险预测及分层管理
时间:2023-11-28 21:29:51 热度:37.1℃ 作者:网络
进展性肝纤维化到肝硬化是一个动态连续的演变过程,其准确的诊断依赖肝脏病理,临床上往往难以区分。既往常用的“代偿期肝硬化”(compensated cirrhosis)忽略了进展性肝纤维化中存在门静脉高压的慢性肝病患者。BavenoⅥ共识中最先提出代偿期进展性慢性肝病(cACLD),旨在识别更多存在临床显著门静脉高压的高危慢性肝病患者。Baveno Ⅶ共识进一步明确了cACLD的无创诊断和分层标准:LSM<10 kPa排除cACLD,LSM在10~15 kPa之间提示cACLD,LSM>15 kPa高度提示cACLD。目前,“代偿期肝硬化”和“进展性慢性肝病”都可以使用,但二者不可互相替换。
进展性慢性肝病(ACLD)基于对门静脉高压的无创诊断提出,研究主要集中在代偿阶段门静脉高压风险分层及对未来失代偿的预测。ACLD在各种潜在诱因的作用下发生急性肝损伤或急性失代偿,可使原有的相对稳定的cACLD急性加重,疾病谱至少可分为急性肝损伤、急性失代偿和慢加急性肝衰竭(ACLF),均需要住院治疗。这些患者病情轻重不一,部分患者预后不良,需要对预后进行准确评估、预警,以便于分级、分层诊疗。
ACLF定义了慢性肝病急性加重患者中短期病死率最高的患者群体,尽管不同地区定义的ACLF标准适用范围不同,但均应在三级医院诊治,并根据病情进行肝移植评估或转入ICU治疗。针对入院时未达到ACLF标准的患者,PREDICT研究根据入院后3个月内的转归将患者分为慢加急性肝衰竭前期(pre-ACLF)、不稳定的失代偿肝硬化以及稳定的失代偿肝硬化,该分层体系也在HBV相关肝硬化患者中得到证实。然而,目前ACLF存在不同诊断标准、分层体系和预后评分,而PREDICT研究根据预后提出的对non-ACLF患者的分层体系,在临床实际应用中存在困难。
1ACLD急性加重患者发生ACLF的预测模型
在西方队列中有10.8%的急性失代偿患者28天内发生ACLF,在以慢性乙型肝炎基础上发生的急性肝损伤和代偿期肝硬化为研究人群的队列中,有8.7%~12.7%在住院期间发生ACLF。在一项回顾性乙型肝炎相关队列研究中,急性失代偿患者在入院后28天内发生ACLF者全身炎症反应程度高,短期病死率高,与ACLF患者无明显区别。因此无论是慢性乙型肝炎患者还是其他病因的患者,无论有无肝硬化和既往是否失代偿,都有在28天内进展至ACLF的可能,且一旦进展至ACLF,病死率明显升高。来自欧洲的前瞻性队列PREDICT研究中,将肝硬化急性失代偿后90天内发生ACLF定义为pre-ACLF,这些患者90天病死率高(67%),是急性失代偿患者中需要重点关注的人群。然而,PREDICT研究提出的pre-ACLF基于90天内是否发生ACLF这一结局事件,并未能提供相应的预测和诊断模型,给临床应用带来困难。
早在Canonic study队列中,即以90、180和365天死亡为主要终点建立了CLIF-C AD评分,计算公式为CLIF-C AD=10×[0.03×年龄+0.66×ln(血肌酐)+ 1.71×ln(INR)+0.88×ln(白细胞计数)-0.05×血钠(mmol/L)+8];通常认为,CLIF-C AD评分<45为低危人群,CLIF-C AD评分≥60为高危人群。这一评分在欧洲的队列中应用广泛,但在短期进展到ACLF风险的预测方面缺乏更多的数据,临床应用中用于危险分层的截断值也有待进一步验证。
PREDICT研究也尝试建立了预测90天内新发ACLF的CLIF-C ACLF-D模型,计算公式为CLIF-C ACLF-D=[(0.03×年龄+0.45×腹水+0.26×ln(白细胞计数)]-(0.37×白蛋白)+[0.57×ln(总胆红素)]+[1.72×ln(血肌酐)]+3×10。然而,在验证集中,CLIF-C ACLF-D与CLIF-C AD预测效能无明显差异,该评分也未进一步推广使用。PREDICT研究还采用决策树的方法区分高危人群,其纳入的核心因素包括血肌酐、总胆红素、白蛋白、年龄和白细胞计数。将ACLF发生概率大于0.5的终末节点归为可能发生ACLF的高危患者,占全部non-ACLF患者的14.1%。该模型的ROC曲线下面积(AUC)为0.76(0.72~0.79),特异度高(95%),但敏感度低(38%),复杂的计算及漏诊率高同样限制了其进一步临床应用。
来自中国的COSSH研究团队,发现血清铁蛋白对ACLF有诊断和预测价值。在学习队列中,入院时830例non-ACLF患者中有86例在28天内进展为ACLF(COSSH标准),血清铁蛋白预测新发ACLF的AUC为0.808(95%CI:0.760~0.855)。当取截断值为1 375.2 μg/L时,敏感度为0.709,特异度为0.781。根据截断值将non-ACLF患者分为高血清铁蛋白组(≥1 400 μg/L)和低血清铁蛋白组(<1 400 μg/L)。高血清铁蛋白组进展为ACLF的累积发生率显著高于低血清铁蛋白组(27.3% vs 4.3%,P<0.001)。
COSSH研究团队进而提出预测新发ACLF的COSSH-onset-ACLF评分:0.101×ln(ALT)+0.819×ln(总胆红素)+2.820×ln(INR)+0.016×ln(铁蛋白);与CLIF-C ACLF-D、MELD、MELD-Na、COSSH-ACLF及CLIF-C ACLF评分相比,COSSH-onset-ACLF评分在预测7、14、28天新发ACLF的C-指数均最高(0.928、0.925、0.913)。以6.3作为截断值,COSSH-onset-ACLF评分可将non-ACLF患者分为高危组和低危组,前者7、14、28天发生ACLF的比例为42.6%、49.2%、50.0%,而低危组分别为2.5%、3.2%、3.7%。这一评分也在包含391例non-ACLF的外部队列中得到验证。然而,在28天进展到ACLF的患者中,超过30% COSSH-onset-ACLF评分小于6.3,提示这一界值敏感性欠佳。此外COSSH研究入组病例均为乙型肝炎患者,在其他病因患者中是否同样适用需要进一步验证;研究终点采用COSSH-ACLF标准,与EASL-ACLF适用人群不尽相同,是否同样可以预测向EASL-ACLF的发展及诊断界值,还有待进一步研究。
既往国内一项慢性乙型肝炎患者急性加重新发ACLF的研究提出PATA模型,该研究学习和验证队列分别来自广东地区三家医院,以APASL-ACLF为诊断标准,模型包括凝血酶原时间、年龄、总胆红素和ALT四个因素,计算公式为:0.341+3.111×凝血酶原时间+0.595×年龄+0.626×总胆红素-0.295×ALT。在学习及两个验证队列中预测新发ACLF的AUC分别为0.959、0.932和0.905。模型提出的截断值0.614在三个队列中阳性预测值差异较大,可能与入组患者的选择偏倚有关。
另一项来自中国的大型前瞻性队列“CATCH-LIFE”研究也对乙型肝炎肝硬化住院患者新发ACLF进行了分析,通过对970例肝硬化急性失代偿(non-ACLF)患者分析,发现4个诱因与ACLF的发展独立相关,分别是:HBV再激活合并急性肝损伤,自发性肝炎活动伴有高HBV DNA载量,HAV或HEV重叠感染,细菌感染。进一步得到新发ACLF预测模型:-7.71+1.38×(HBV再激活合并急性肝损伤)+0.74×(自发性肝炎活动伴有高HBV DNA载量)+1.50×(HAV或HEV重叠感染)+0.91×(细菌感染)+0.81×ln(总胆红素)+4.17×ln(INR)+0.63×ln(中性粒细胞与淋巴细胞比值)。该模型在458例乙型肝炎急性失代偿的non-ACLF患者队列中进行验证,无论学习队列还是验证队列,新的模型均优于传统的CLIF-C AD、iMELD、MELD-Na和CTP评分。研究进一步提出0.22作为截断值,评分<0.22者为低危组,5.3%患者进展到ACLF;评分≥0.22的患者为ACLF发展高危人群,进展到ACLF的比例为39.6%。这一模型将病因纳入危险因素分析,提示病因在ACLF发展中的重要作用。但模型本身计算复杂,且正是由于包含HBV激活诱因,限制了其在不同病因下的推广和验证。同时,评分<0.22的患者占比庞大,虽然进展率仅为5.3%,但在全部进展的患者中(n=42),有一半评分被纳入低危组,意味着低危组仍需要密切监视,及时发现疾病进展的患者。
最近一项来自意大利的研究纳入169例肝硬化失代偿患者,在1年的随访时间内55例进展到ACLF,分析建立了包含CLIF-C AD、Child-Pugh分级和CRP的Padua-AD模型(表1),将急性失代偿患者分为高危和低危组,2组1年ACLF的发生率分别为68.3%和12.8%。该研究纳入患者中55%为酒精性肝病,72%既往曾发生失代偿事件。55例进展到ACLF的患者,进展的中位时间为58(26~104)天,这些队列特征与我国乙型肝炎相关失代偿期肝硬化存在较大差异,其模型预测价值有待进一步验证。
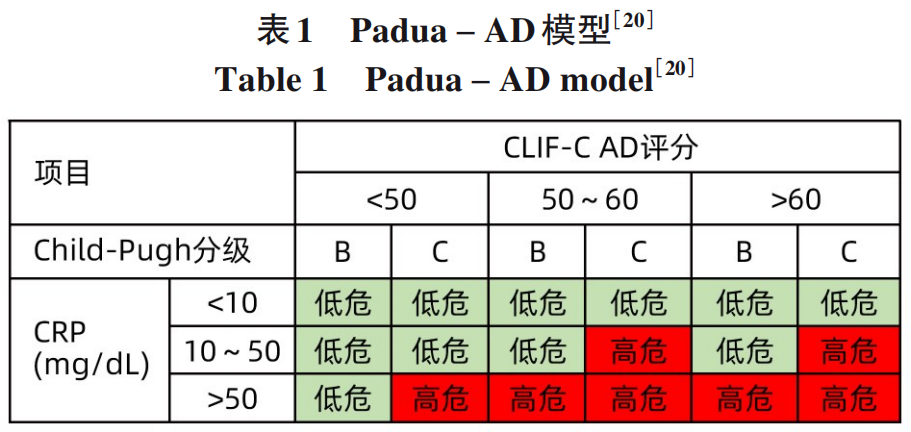
笔者对上述预测ACLF发生的主要模型进行汇总(表2),这些模型基于不同队列、不同病因,疾病严重程度不同,ACLF诊断标准存在差异,尚没有预测ACLF进展的模型得到广泛认可。各预测模型纳入的危险因素多包括肝脏损伤(总胆红素)、凝血功能异常(凝血酶原时间或者INR)、炎症指标(铁蛋白、CRP、白细胞计数、中性粒细胞与淋巴细胞比值),在乙型肝炎为主要病因的队列研究中,往往包括肝炎活动指标(ALT),而在西方以酒精性肝病为主队列中,常需要将肾损伤指标(血肌酐)或其他肝外器官损伤评分纳入模型中,提示不同病因发生ACLF的机制不尽相同。
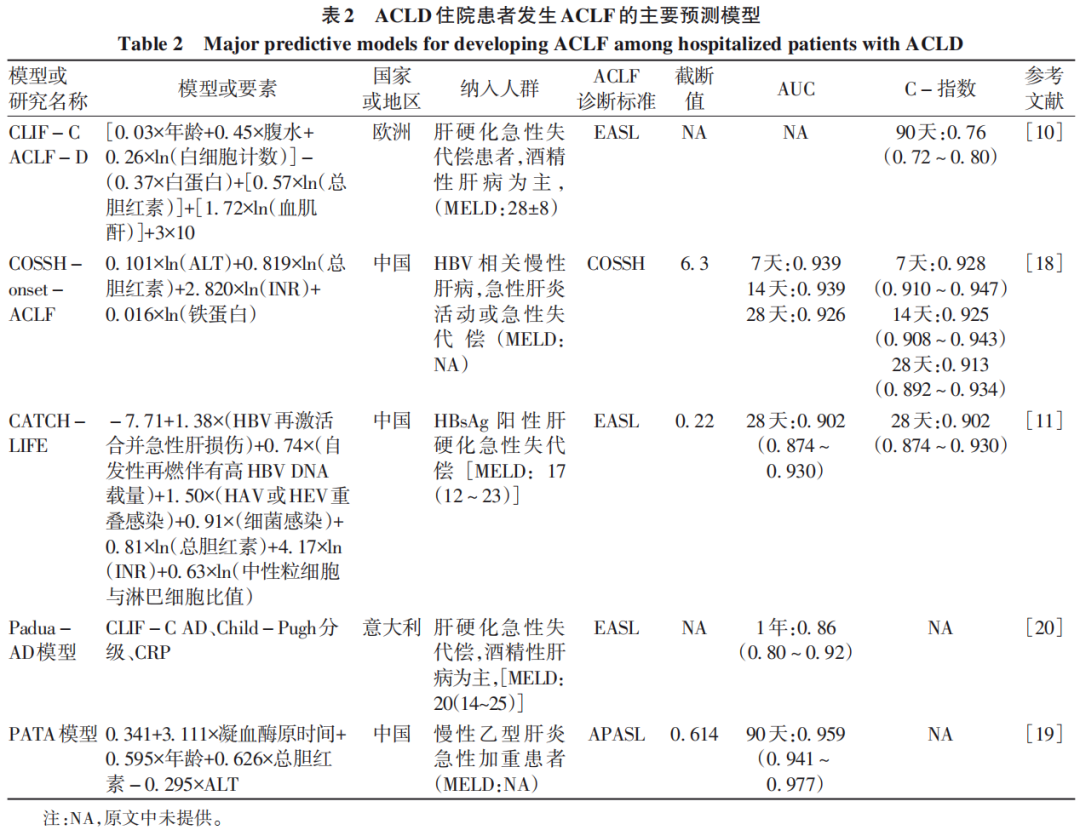
另一方面,各模型提出的截断值虽可大致区分高危和低危患者,但往往低危组基数庞大,尽管进展率相对较低,而实则遗漏进展至ACLF患者,不利于这类患者的临床管理。
在国内一项队列研究中,根据器官损伤个数对住院肝硬化急性失代偿患者进行分层。将肝功能障碍定义为总胆红素≥6 mg/dL,凝血功能障碍定义为INR≥1.5,肾功能障碍定义为血清肌酐1.5~1.9 mg/dL,免疫系统功能障碍定义为存在证据的细菌感染。研究发现≤1个为功能障碍器官数量的截断值。在推导队列(n=673)和验证队列(n=1 388)中,≤1个器官损伤排除患者在28天内发生ACLF的漏诊率均低于5%(分别为4.3%和3.4%)。而另一研究以既往未发生过失代偿的HBV急性加重或失代偿患者为研究对象,推导队列为多中心回顾性队列(n=892),验证队列为多中心前瞻性队列(n=1 656)。在两个队列中,MELD<18分患者在28天内进展至ACLF的比例分别仅为0.6%和0.5%,占各自队列全部进展患者比例的2.9%和3.0%。在上述两种策略下筛选出的低危患者遗漏可能进展至ACLF的患者极少,是真正“安全”的低危组,在临床实践中,基层医院按照指南及规范治疗即可,无需向上转诊。两个模型也均存在着阳性预测值较低的缺陷,对真正高危人群的识别还需要更多研究。
2进展到ACLF的标志物
临床常用指标对新发ACLF预测的局限性及同一模型在不同队列预测效能的差异,提示对ACLF发生发展机制认识尚存在欠缺。机制及转化研究提出诸多新型标志物,未来或有助于新发ACLF的预测和患者分层管理。
系统性炎症在ACLF的发生和发展中发挥重要作用,炎症相关指标也是ACLF预警和预后标志物研究较多的领域。包括IL-6、IL-22、IL-33等在小样本临床研究中均有报道与新发ACLF或预后相关。在国内外研究中巨噬细胞激活标志物可溶性CD163(sCD163)也被证实可作为ACLF的预后标志物。另一主要表达在巨噬细胞和树突细胞的甘露糖受体可溶形式或CD206在non-ACLF患者中与短期死亡相关。促半胱氨酸脱水酶肽(Copeptin)是精氨酸加压素的降解产物,可作为急性和全身血流动力学应激反应的标志物。研究者通过检测Canonic study队列的血浆样本,发现促半胱氨酸脱水酶肽是肝硬化急性失代偿患者28天和90天死亡的独立危险因素,也是non-ACLF患者28天内进展到ACLF的独立危险因素(OR=1.40,95%CI:1.09~1.80)。
ACLD患者存在凝血再平衡,凝血相关指标Ⅷ与蛋白C的比值(FVⅢ/PC)、血管性血液病因子(vWF)及其裂解酶ADAMTS-13与疾病预后相关。在ACLD患者中,FVⅢ/PC随疾病严重程度增加而升高。进一步分析失代偿期ACLD患者,发现FVⅢ/PC是新发ACLF的独立危险因素(aHR=1.10,95%CI:1.02~1.19,P=0.015),其区分高危和低危组的最佳截断值为4.46。ADAMTS-13是一种特异性切割多聚vWF的金属蛋白酶。ADAMTS-13和vWF之间的失衡随肝硬化严重程度增加而加重,与新发ACLF相关。在服用非选择性β受体阻滞剂(NSBB)的ACLD患者中,vWF应答者(较基线下降20%)ACLF发生率更低。但是在急性加重或失代偿的住院ACLD患者中,ADAMTS-13/vWF对疾病短期进展至ACLF的预测价值还需要进一步验证。
肾脏损伤在ACLF的发生发展中存在重要作用,Ariza等研究发现尿中性粒细胞明胶酶相关脂质运载蛋白(NGAL)不仅可作为ACLF的生物标志物,也与新发ACLF独立相关。国内一项研究显示血NAGL对ACLF有预后价值,但是血NAGL与预后的独立相关性在另一项研究中未得到证实,可能与诊断标准、入组人群差异有关。Juanola等揭示了尿液中和脂代谢相关的肝脂肪酸结合蛋白(L-FABP)与ACLF分级、器官衰竭及新发ACLF的相关性。Markwardt等利用Canonic study队列血浆样本,发现胱抑素-C与肾功能不全、肝肾综合征、新发ACLF独立相关。上述肾小管损伤标志物,在不同疾病谱、不同诊断标准下的预测价值需要更多研究。
组学方法也广泛用于ACLF的诊断和预后标志物的研究,与新发ACLF相关的潜在标志物包括:通过外周血单个核细胞转录组学识别到的4个参与先天免疫应答、适应性免疫应答、补体激活、脂肪酸氧化和活性氧代谢的基因(PPARγ、MER tyrosine kinase、thrombospondin 1及semaphorin 6B);通过血浆蛋白质组学鉴别出的HBV-ACLF诊断相关的蛋白,分别为载脂蛋白C3、富含组氨酸糖蛋白、转铁蛋白、激肽释放酶;通过血清样本代谢组学分析发现的代谢标志物4-羟基-3-甲氧基苯基乙二醇硫酸盐,半乳糖醛酸和己基肉碱,以及甲基哌啶和CEHE(gamma-carboxyethyl hydroxychroman)。特别是CATCH-LIFE研究还进一步通过液相色谱-质谱法开发了靶向测定方法并建立预测模型:仅包括两个代谢标志物甲基哌啶和CEHE的模型,与CLIF-C ACLF-D模型及MELD-Na模型预测ACLF发生的AUC相当,当联合临床指标:总胆红素、INR及肝硬化与否后,新模型的AUC在学习和验证队列中分别达到0.94和0.88,显著高于其他模型。
此外,包括Canonic、AARC等多个研究,也开发了ACLF的人工智能预测模型。人工智能技术有望带来预测效能的提高,为准确诊断、预后判断、器官分配等提供决策帮助,但其涉及到伦理、数据安全等问题,距离临床应用还有相当的距离。
3总结
ACLD住院患者,是一群异质性较大的患者群体,从急性肝损伤、急性失代偿到肝衰竭,疾病进展和预后存在很大差异,需要分层管理。ACLF诊断标准存在差异,适用于不同人群,各标准下ACLF患者均具有较高短期病死率,应在三级医院密切监护和治疗。在入院时未达到ACLF的患者中,仍有一定进展到ACLF的比例,且一旦进展到ACLF,短期病死率与ACLF患者相当。目前尚缺乏预测进展至ACLF的高危人群的精准模型,MELD<18分及<2个器官损伤可分别在既往代偿的慢性肝病患者及肝硬化急性失代偿患者中安全地排除进展至ACLF的高危患者,这些患者建议纳入基层医院,按照指南共识给予标准治疗即可,无需向上级医院转诊。现阶段各预测模型及新的标志物均有着各自的适用范围,还需要更多验证,以实现对有一定疾病进展率和病死率的患者更精准地分层,也为未来新药物/疗法的临床试验患者选择提供依据。
全文下载
http://www.lcgdbzz.org/cn/article/doi/10.3969/j.issn.1001-5256.2023.10.005
引证本文
祁婷婷, 陈金军. 进展性慢性肝病发生慢加急性肝衰竭的风险 预测及分层管理[J]. 临床肝胆病杂志, 2023, 39(10): 2294- 2300



