上海交通大学AM:“免疫开关”驱动中性粒细胞对抗糖尿病相关生物膜感染
时间:2023-12-03 12:35:15 热度:37.1℃ 作者:网络
过度氧化应激诱导的强化生物膜结构和功能失调的中性粒细胞是糖尿病相关生物膜感染(DRBI)难以治疗的主要原因。基于负载脱氧核糖核酸酶I(DNase-I)的碳化钒MXene(DNase-I@V2C)作为纳米调节剂,上海交通大学医学院Hao Shen和Jianrong Wu等人提出了一种免疫转换点驱动的中性粒细胞免疫功能转换(NIFC)策略。该策略可通过裂解生物膜和将中性粒细胞功能从NETosis重定向为吞噬作用(phagocytosis)来治疗DRBI。由于其固有的类酶活性,DNase-I@V2C可有效清除高氧化应激微环境中的活性氧(ROS)以维持DNase-I的生物活性。作为免疫转换点调节剂,DNase-I@V2C可通过阻断ROS-NE/MPO-PAD4并激活糖尿病微环境中的ROS-PI3K-AKT-mTOR途径,使中性粒细胞功能从NETosis转向为吞噬作用,从而消除生物膜感染。本研究通过调节免疫转换点逆转中性粒细胞功能,阐释了治疗DRBI的高效策略。相关工作以“Neutrophil Function Conversion Driven by Immune Switchpoint Regulator Against Diabetes-Related Biofilm Infections”为题发表在Advanced Materials。

【文章要点】
在DRBI中,混杂的生物膜通常会抑制中性粒细胞吞噬作用,导致“吞噬作用受挫”,从而诱导中性粒细胞胞外陷阱(NETs)的释放,最终严重抑制中性粒细菌的杀菌活性并促进生物膜的持久性。特别是在具有高ROS的糖尿病微环境中,中性粒细胞易于从吞噬细胞转变成NETosis,以产生丰富的网状NET。NETs由去浓缩染色质纤维(双链DNA)和细胞内抗菌因子(如中性粒细胞弹性蛋白酶(NE)和髓过氧化物酶(MPO))组成,通常会整合到胞外聚合物基质(EPS)中,在生物膜表面和内部形成“NETs屏障”,从而增强生物膜的EPS屏障。因此,解离生物膜并逆转中性粒细胞功能有望提高DRBI的治疗效果。因此,针对DRBI的微环境,作者提出了一种中性粒细胞免疫功能转换(NIFC)策略,通过构建负载DNase-I的V2C-MXene(DNase-I@V2C)来对抗糖尿病中的生物膜感染(图1)。由于V2C具有较强的多种酶样活性(SOD/CAT酶),DNase-I@V2C可通过快速清除ROS有效重塑DRBI中的高氧化应激微环境。
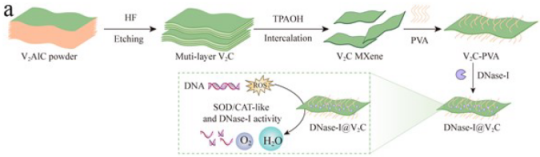
图1 DNase-I@V2C的设计和制备
如图2所示,作为免疫转换点,ROS的清除通过进一步抑制ROS-NE/MPO-PAD4途径减少了中性粒细胞释放的NETs,并通过激活ROS-PI3K-AKT-mTOR途径增强了中性粒细胞的吞噬活性,从而使中性粒细胞从NETs转向吞噬作用。此外随着微环境的重塑,DNase-I@V2C不仅能长期有效地保持负载的DNA酶I的生物活性和稳定性,还能增加其在生物膜中的渗透深度,从而完全降解EPS 中的eDNA和NETs,从而打破生物膜的“EPS和NETs屏障”。而生物膜的裂解进一步促进中性粒细胞的功能转换,并通过吞噬作用加速细菌和生物膜碎片的清除。作者系统地评估了DNase-I@V2C通过巧妙地结合生物膜裂解和免疫功能转换来治疗DRBI的能力,并在体外和体内阐明了其潜在机制。NIFC策略在免疫转换点调节因子的驱动下,有效地重建了糖尿病患者的免疫微环境,加速了生物膜的清除,有望为DRBI的治疗开辟新的前景。
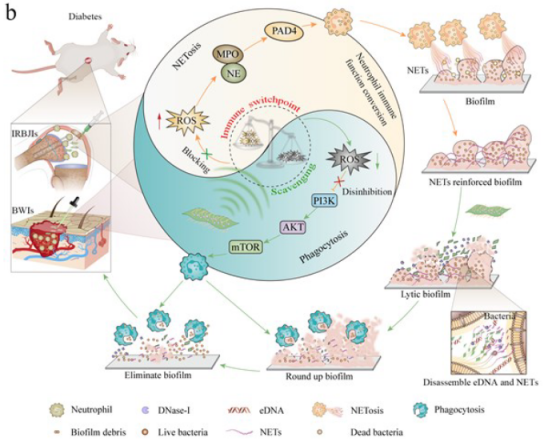
图2 对抗DRBI示意图
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202310320


