港中深唐本忠院士、赵征/深大熊玉ACS Nano:多重响应的仿生AIE纳米凝胶用于肿瘤的精准治疗
时间:2023-12-17 19:00:09 热度:37.1℃ 作者:网络
研究背景
目前,恶性肿瘤已对人类健康构成了严重的威胁。传统治疗方式(如化疗、手术、放疗等)仍面临着脱靶效应、严重副作用等问题。近年来,化疗-光热协同治疗由于其高疗效、低复发风险和较小副作用而成为了一种有前途的治疗方法。然而,当前的化疗-光热协同疗法存在非特异性递送、难以控制释放和缺乏治疗监测等缺点。精准诊疗的出现为解决这些问题提供了新途径,它旨在通过视觉导航实时监测靶向特定位置,随后激活药物释放或触发光疗,从而提高治疗效果和患者舒适度,实现按需个性化疗法。纳米诊疗一体化,可将多种诊断和治疗元素整合到同一平台,在实现精准诊疗的多功能性方面展现出较大的潜力。然而,各元素在整合后是否会相互干扰,并在纳米聚集体中保持其原始特性是不确定的。例如,传统的有机荧光分子在聚集后大多会受到荧光减弱、ROS受损等影响。因此,如何在纳米尺度下,将各功能组件有机整合起来并发挥出原有的性质,甚至展现出协同效应,依然存在着挑战。
研究工作简介
近期,香港中文大学(深圳)唐本忠院士、赵征教授与深圳大学熊玉教授合作,开发了一种基于聚集诱导发光(AIE)特性的纳米凝胶,集成了主动同源靶向、双响应药物释放、近红外光触发的高温疗法,以及体内实时荧光成像和光热成像等多种功能,为精准化疗-光热协同治疗提供了多模态的解决方案。相关工作以“Multi-Stimuli-Responsive and Cell Membrane Camouflaged Aggregation-Induced Emission Nanogels for Precise Chemo-Photothermal Synergistic Therapy of Tumors”为题发表在《ACS Nano》。

在这项研究中,AIE光热剂(TN)和化疗药物(Dox)被封装进温度/pH响应型的纳米凝胶(PNA)中,利用肿瘤细胞膜策略将纳米凝胶进行仿生伪装。伪装后的纳米凝胶通过“特洛伊木马”效应,逃脱免疫识别,展现出“主动寻靶”特性,有利于将药物精确送达至肿瘤部位。纳米凝胶进入到肿瘤微环境后,环境pH的降低刺激了药物的迅速释放,近红外(NIR)光诱导的局部高温效应也可以有效杀伤肿瘤细胞并进一步加速药物释放,从而产生增强的协同化学-光热疗法,彻底根除肿瘤。此外,P-TN-Dox@CM纳米凝胶还能够实现NIR荧光/光热双模态成像,以实时监测药物在体内的动态分布。
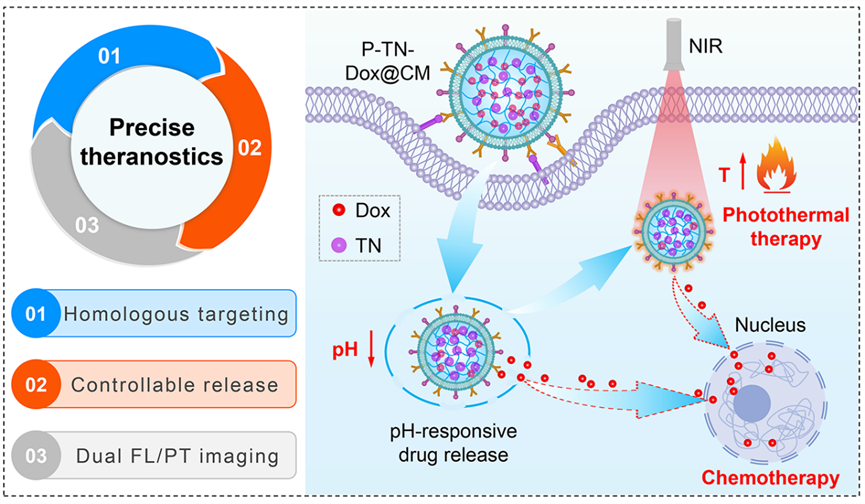
图1. AIE纳米凝胶的化疗-光热协同治疗示意图
通过分子工程技术,使得纳米凝胶的吸收位于近红外区域,并展现出明亮的荧光。其荧光强度随着浓度增大而增强,表现出典型的聚集诱导荧光增强效应。同时,相较于ICG,P-TN-Dox@CM纳米凝胶表现出较好的光稳定性,更有利于长时间的荧光成像。通过合理构建增强的分子内运动和高度扭曲的构象,使得纳米凝胶同时具有光热转换能力(PCE=54.1%)和荧光成像能力(QY=0.47%)。这种巧妙的设计使得纳米凝胶在荧光成像引导光热治疗领域具有重要的潜力。
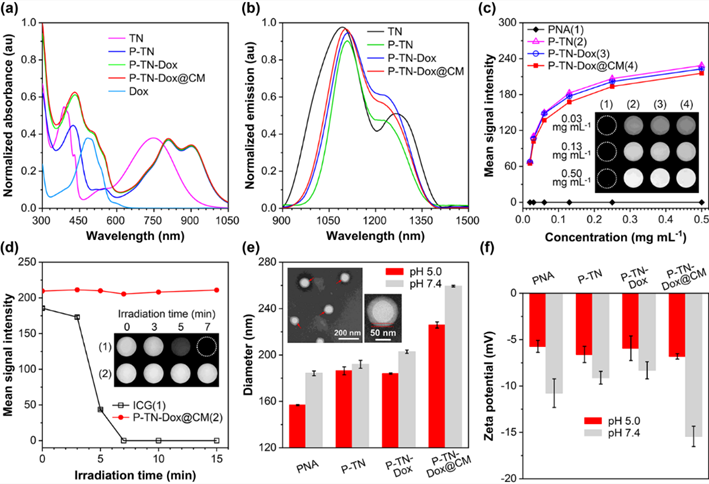
图2. P-TN-Dox@CM纳米凝胶的理化性能
细胞内吞实验证明,细胞膜仿生策略可提高细胞对纳米凝胶的摄取量。同源靶向实验表明,修饰有细胞膜的纳米凝胶在同细胞系(4T1)的摄取量最多,分别比Hela组、3T3组和T24组高2.14倍、1.90倍和4.57倍。因此,同源靶向效应赋予了P-TN-Dox@CM纳米凝胶在同源4T1细胞中积累的能力。MTT毒性试验结果显示,在NIR照射下,装载有TN的纳米凝胶表现出较好的光热杀伤性能,且杀伤效率随着给药浓度增加或激光功率提高而加强。此外,在化疗-光热协同杀伤实验中,P-TN-Dox@CM+L组提供了最强的杀伤效应,展现出协同的抑制效果,IC50值为2.14 μg mL-1,分别比单一化疗组(P-TN-Dox@CM暗处理)和单一光热治疗组(P-TN@CM+L)低2.99倍和2.78倍。
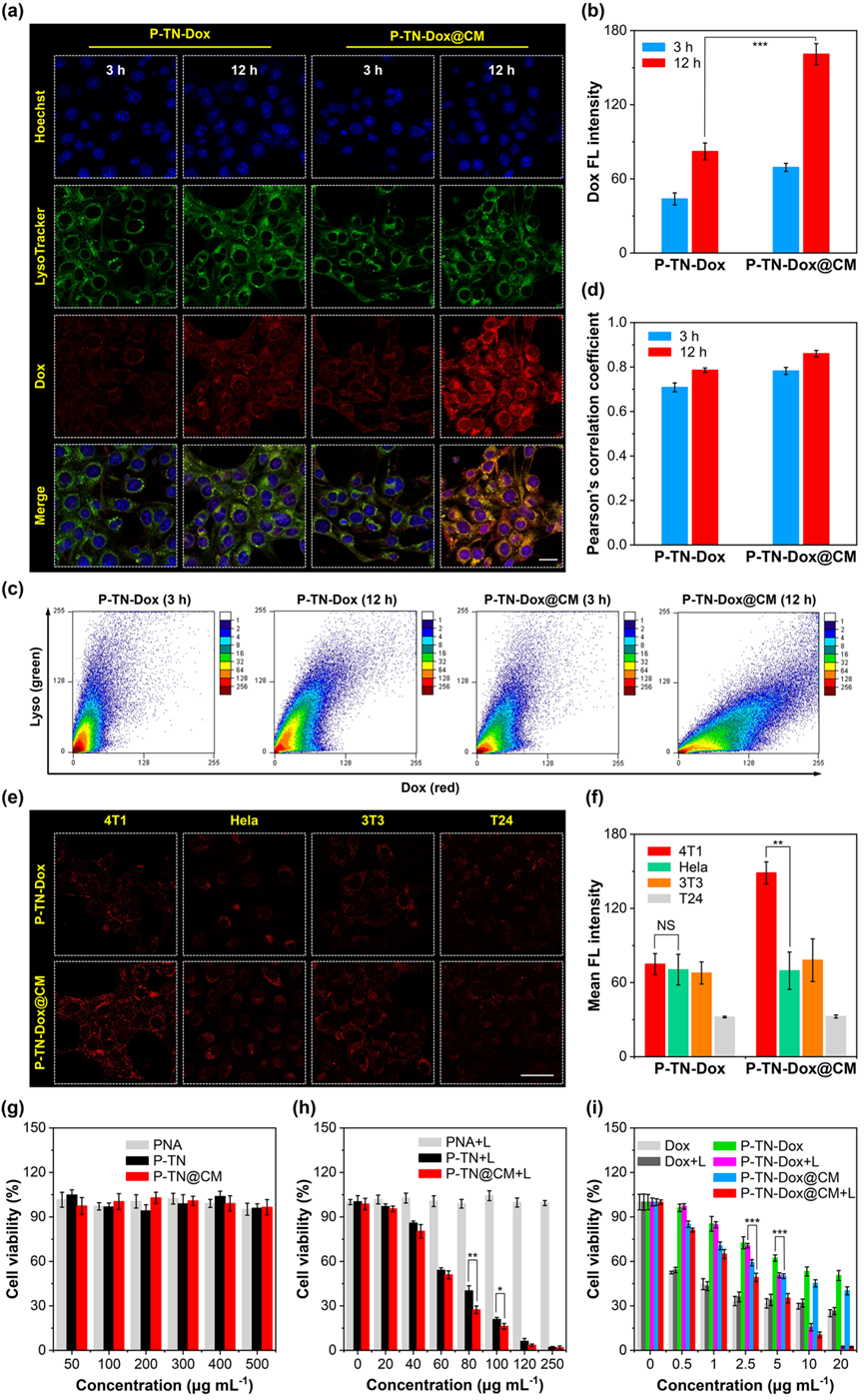
图3. AIE纳米凝胶的细胞内吞、同源靶向及细胞毒性
研究者们进一步评估了纳米凝胶在活体内的抗肿瘤性能和生物安全性。在小鼠模型中,该纳米凝胶表现出较好的肿瘤积聚和保留能力,增强了化疗-光热协同治疗的效果。通过NIR激光照射,P-TN-Dox@CM表现出优秀的肿瘤生长抑制效果,14天后几乎完全消除了肿瘤。此外,纳米凝胶的药物控制释放特性有助于降低传统化疗药物的不良副作用。对主要器官的组织学分析和血液生化指标的检测表明,该纳米凝胶在体内表现出良好的生物相容性和安全性。
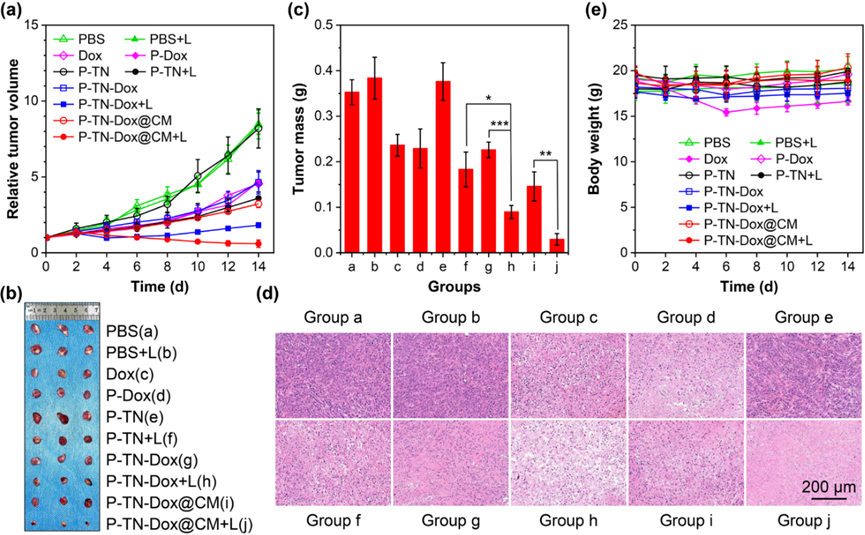
图4. 体内抗肿瘤性能
工作的亮点、新颖性和意义
在该工作中,研究者们成功地设计了一种智能纳米系统(P-TN-Dox@CM)用于同源靶向、双模荧光/光热成像和多刺激触发的精准疗法。该多功能纳米平台不仅在体内外表现出高效的抗肿瘤疗效,还通过高对比度的成像为治疗过程提供了实时监测,在肿瘤精准治疗中展现出极大的潜力,可望成为一种理想的药物传递平台。
原文链接:
https://doi.org/10.1021/acsnano.3c08409


