论文解读|Dong S/ Li J/ Sun Z教授团队发现拮抗前列腺癌细胞外泌体miR-18a-5改善骨转移导致的成骨细胞病变
时间:2024-03-15 19:00:24 热度:37.1℃ 作者:网络

前列腺癌(PCa)是男性中最常见的癌症,其中超过一半的患者会发生骨转移,特征是疼痛和致残的骨质增生性病变。尽管前列腺癌治疗取得了进展,但是治疗前列腺癌骨转移及其相关并发症仍然是一个重大挑战。
陆军军医大学Shiwu Dong/Jianmei Li教授团队联合深圳大学总医院Zhongyi Sun教授团队在本刊发表了题为“Antagonizing exosomal miR-18a-5p derived from prostate cancer cells ameliorates metastasis-induced osteoblastic lesions by targeting Hist1h2bc and activating Wnt/β-catenin pathway”的一项开创性研究,发现了一种改善PCa骨转移导致的骨质增生性病变的新方法,有可能彻底改变前列腺癌骨转移的治疗方式。
1. PCa骨转移成骨细胞性病变中miR-18a-5p表达升高
研究首先发现,与对照组相比,PCa骨转移患者的骨微环境中miR-18a-5p的表达显著增高。这一发现在PCa骨转移细胞系中得到了进一步的证实,特别是在C4-2B和PC-3细胞系中,miR-18a-5p的水平明显高于正常的永生化前列腺细胞系WPMY-1(图1)。这一发现突出了miR-18a-5p在PCa骨转移成骨细胞性病变发展中的潜在作用。
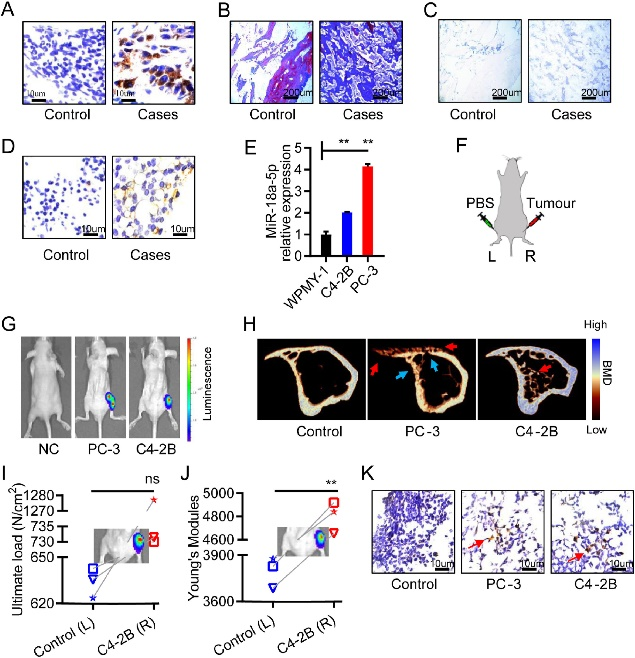
图1 miR-18a-5p在前列腺癌骨转移的成骨细胞性病变中过表达
2. 拮抗miR-18a-5p可抑制成骨细胞分化
研究者随后探究了拮抗miR-18a-5p对PCa细胞的影响。在体外,拮抗miR-18a-5p导致成骨细胞分化和活性的显著减少,这一点通过C4-2B和PC-3细胞实验得到了证实。在体内,抑制裸鼠体内植入的PCa细胞中的miR-18a-5p表达可使骨质增生性病变减少,骨组织体积比(BV/TV)和骨矿物质密度(BMD)降低。这些结果强调了靶向miR-18a-5p在PCa骨转移成骨细胞性病变中的治疗潜力(图2、3)。

图2 在前列腺癌细胞中拮抗miR-18a-5p可抑制成骨分化和成骨细胞性病变
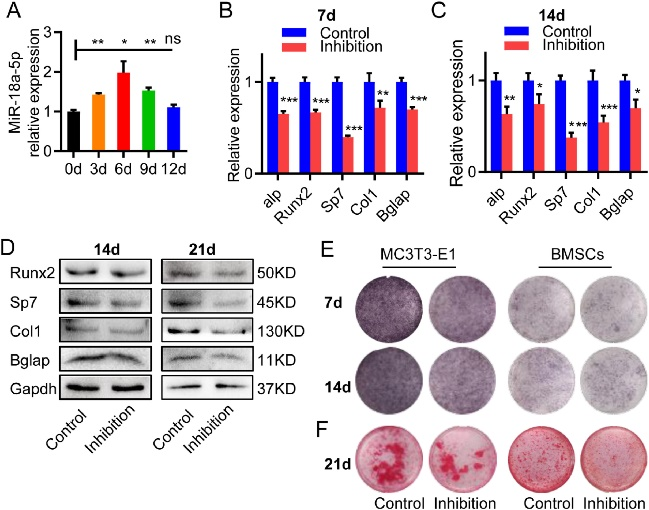
图3 在前成骨细胞中拮抗miR-18a-5p抑制成骨细胞分化
3. miR-18a-5p靶向Hist1h2bc基因并激活Wnt/β-catenin通路
进一步的研究揭示了miR-18a-5p影响成骨细胞分化的分子机制。研究发现miR-18a-5p靶向Hist1h2bc基因,导致Wnt/β-catenin信号通路中的Ctnnb1基因上调,这一通路对成骨细胞的分化至关重要。研究证明miR-18a-5p激活了Wnt/β-catenin信号通路,促进了前成骨细胞的分化(图4)。

图4 miR-18a-5p靶向Hist1h2bc基因促进成骨细胞分化
4.通过外泌体将miR-18a-5p运输到前成骨细胞
研究还阐明了miR-18a-5p的细胞间传输机制。在PCa细胞中过表达的miR-18a-5p通过外泌体转移到前成骨细胞,这表明PCa细胞衍生的外泌体可调节成骨细胞活性,从而促进PCa骨转移中成骨细胞性病变的发展(图5)。
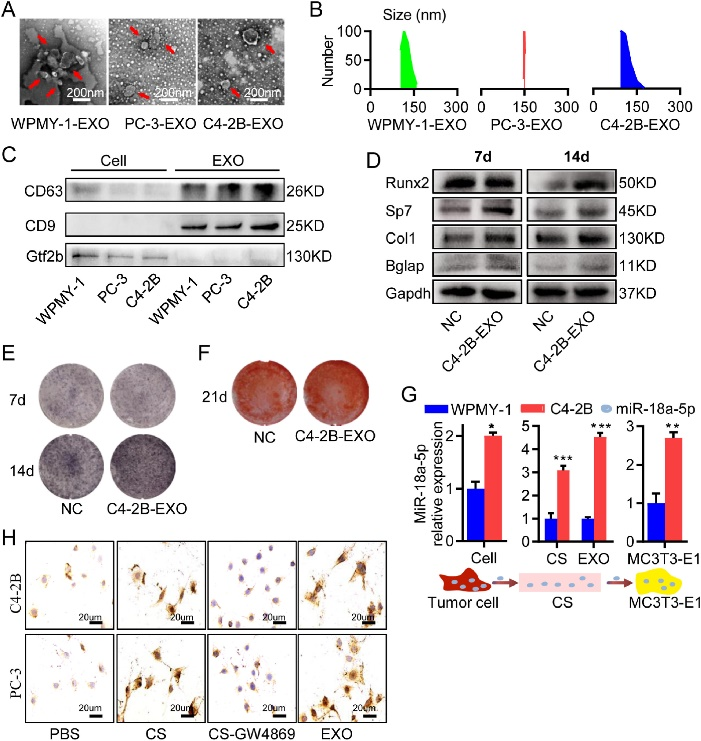
图5 前列腺癌细胞中表达的miR-18a-5p可经外泌体转运
5. Antagomir-18a-5p在PCa骨转移中的治疗效果
最后,研究评估了在PCa骨转移模型中antagomir-18a-5p的治疗效果。应用antagomir-18a-5p组小鼠显示出在生物力学特性、骨矿物质密度和减轻骨质增生性病变方面的显著改善。重要的是,antagomir-18a-5p在动物模型中被证实是安全的,在关键器官未观察到不良反应(图6)。
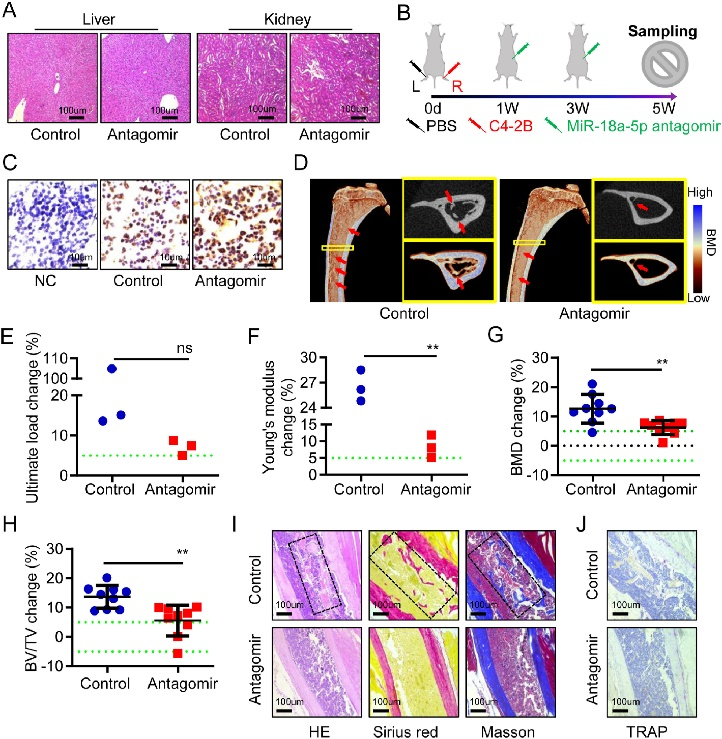
图6 Antagomir-18a-5p可治疗前列腺癌骨转移引起的成骨细胞性病变
总之,这项研究对miR-18a-5p在PCa骨转移中的作用进行了全面分析,并强调了其通过调节关键基因通路和细胞间信号传导机制,作为治疗成骨细胞性病变的潜能(图7)。这些发现为前列腺癌骨转移开辟了新的治疗途径。
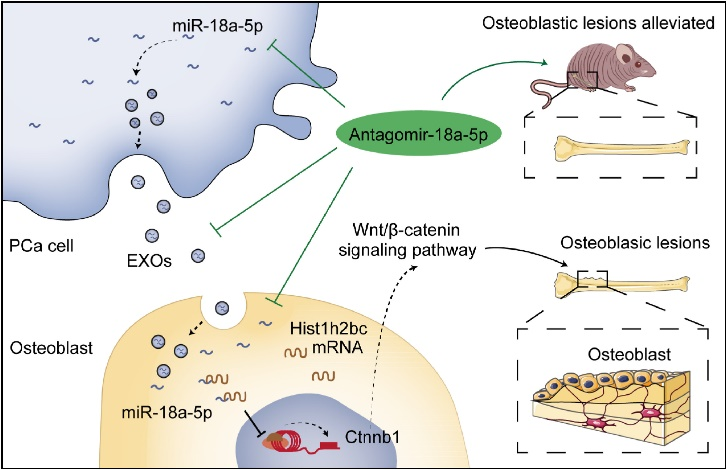
图7 miR-18a-5p介导前列腺癌骨转移成骨细胞性病变的分子机制和治疗策略
文章来源
免费全文下载链接:
https://www.sciencedirect.com/science/article/pii/S2352304222001933
引用这篇文章:
Zeng F, Zhao C, Wang R, et al. Antagonizing exosomal miR-18a-5p derived from prostate cancer cells ameliorates metastasis-induced osteoblastic lesions by targeting Hist1h2bc and activating Wnt/β-catenin pathway. Genes Dis. 2023;10(4):1626-1640.


