FDA批准安进公司小细胞肺癌划时代治疗药物——Imdelltra(tarlatamab)上市
时间:2024-05-22 17:00:21 热度:37.1℃ 作者:网络
美国食品药品监督管理局已批准安进公司的Imdelltra(tarlatamab)(AMG 757,塔拉妥单抗),这是一种首创的小细胞肺癌治疗药物,具有巨大的潜力。

在安进公司首席医学官称该公司正在研究的肺癌免疫治疗试验结果为“划时代的”七个月后,FDA已批准Imdelltra(tarlatamab)用于治疗广泛期小细胞肺癌(ESSCLC)患者。
这种突破性疗法适用于那些在接受基于铂类化疗后疾病恶化的患者。这项加速批准是在机构6月12日的决定日期之前近一个月内发布的,取决于在确认试验中验证临床的益处。
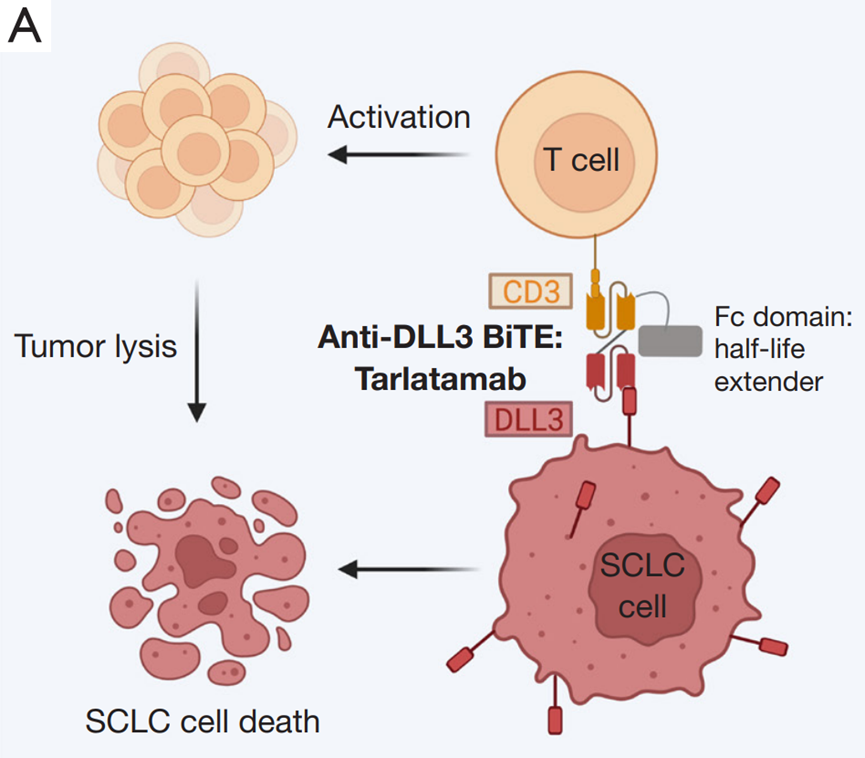
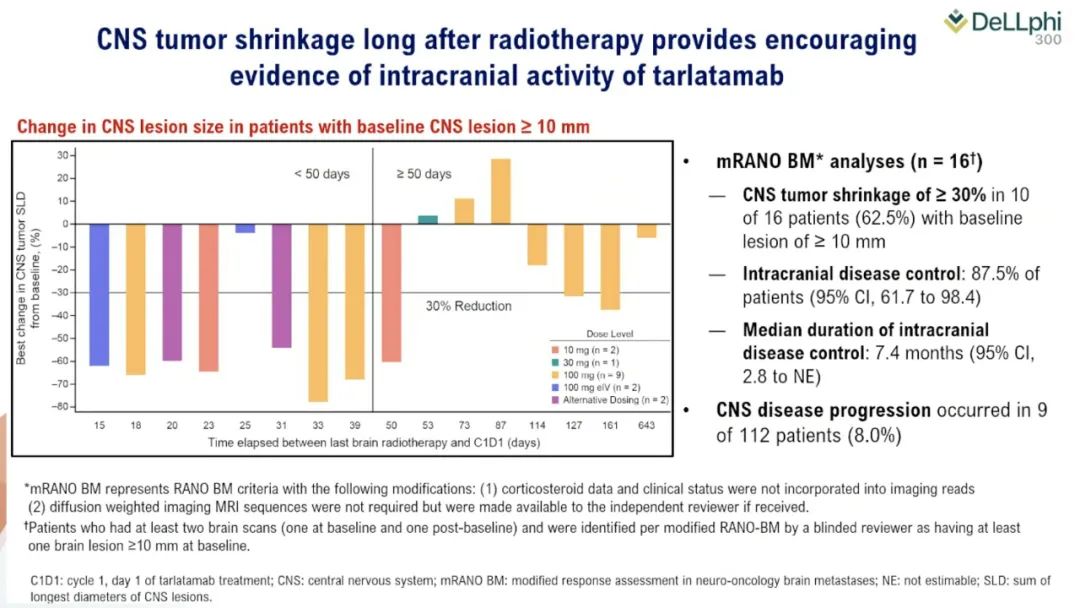
Imdelltra激活患者的T细胞以攻击表达Delta-like配体3(DLL3)的肿瘤。尽管小细胞肺癌(SCLC)仅占肺癌的15%,但它们通常比非小细胞肺癌更具致命性和侵袭性。
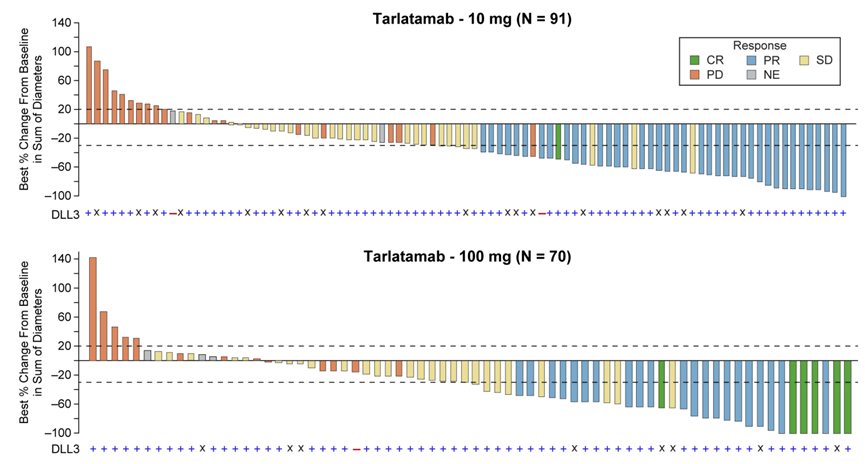
双特异性T细胞结合剂(BiTE)分子在十月份的欧洲医学肿瘤学会(ESMO)大会上引起轰动。在该活动中,安进公司展示了每两周给予10毫克输注的疗法,使40%的小细胞肺癌患者的肿瘤缩小,这些患者此前接受过两种治疗方案但未见效。
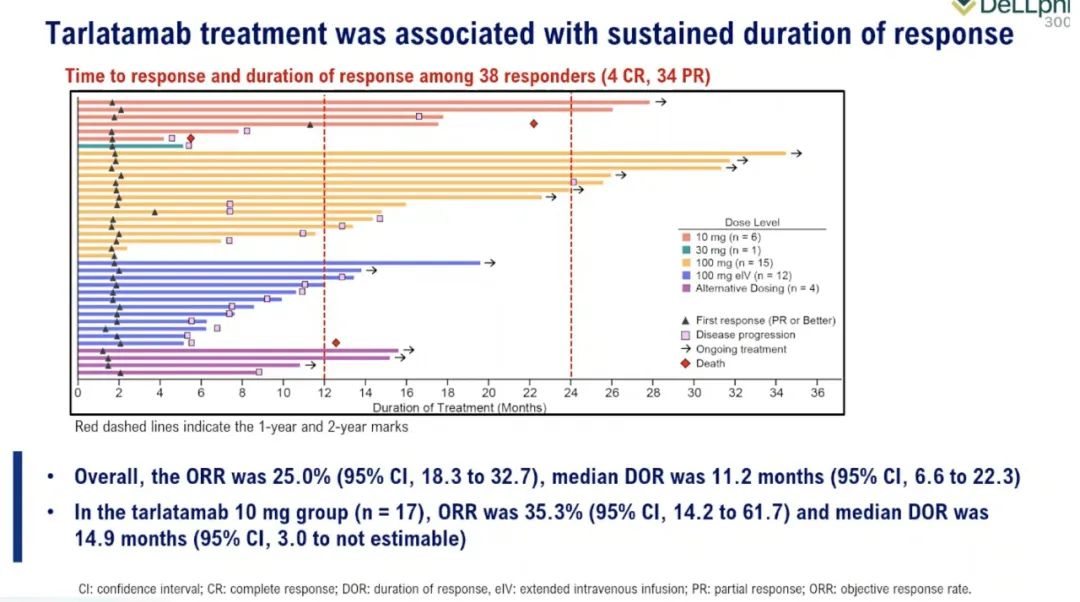
这项2期临床试验的结果发表在《新英格兰医学杂志》上,引发了安进公司首席医学官Paul Burton博士的“划时代的”评论。Paul Burton表示:“这代表了生存期的增长约三倍。”
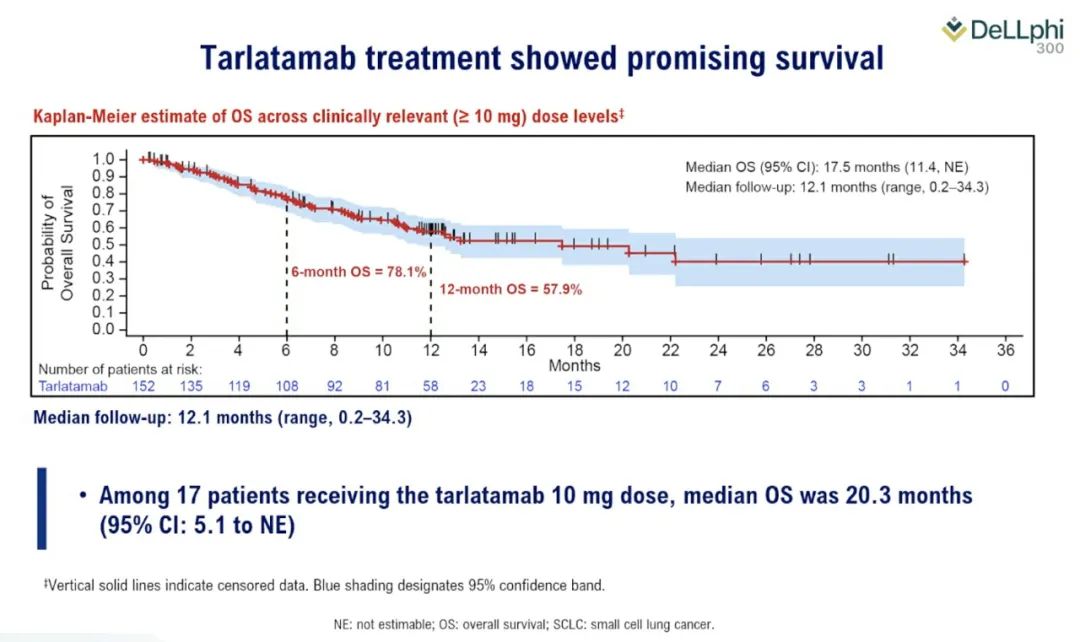
尚未成熟的数据显示,在这种疾病中,总生存期的中位数为 14.3 个月,而该疾病的预期中位生存期约为 5 个月,反应持续时间的中位数为9.7个月。
周四发布的一份声明中,安进公司的研发主管Jay Bradner称其为“对抗ES-SCLC患者的关键时刻”。该公司将在后期与投资者举办网络研讨会时提供更多信息。
Matt Phipps,William Blair的分析师,写信给客户表示:“考虑到ES-SCLC患者的有限选择,这些结果相比目前的选择代表了有意义的改善,在第三线SCLC中没有批准的标准治疗方法,安进公司估计美国有2,000至3,500名患者。” William Blair表示,Imdelltra具有巨大的潜力,并预计到2028年销售额达到8.42亿美元。
安进公司将Imdelltra定价为第一疗程31,500美元,随后疗程为30,000美元。治疗周期为28天,治疗的中位持续时间为5.5个周期,安进公司表示,每位患者的平均费用将达到166,500美元。
Imdelltra成为安进公司上市的第二种BiTE。在过去的十年里,美国食品药品监督管理局已经批准了Blincyto用于五种急性淋巴细胞白血病(ALL)。去年,该治疗的销售额增长了48%,达到8.61亿美元。


