【Lancet Haematol】CAR-T免疫效应细胞相关血液毒性的机制和管理
时间:2024-05-22 19:01:04 热度:37.1℃ 作者:网络
ICAHT
CAR-T细胞已成为多种晚期B细胞恶性肿瘤的有效治疗选择,其典型副作用为细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS),但血液学副作用却是最常见的CAR-T相关不良事件,并在2023年归类为免疫效应细胞相关血液毒性(ICAHT)。ICAHT非常常见,可导致临床相关感染,且无论CAR-T产品、靶抗原和适应症如何,均存在血液学毒性。由于CAR-T治疗后的造血重建不同于化疗相关的骨髓抑制,因此引入了一种新的早期和晚期ICAHT分类系统。此外,CAR-HEMATOTOX风险分层评分可用于识别ICAHT高危患者,从而实现基于风险的干预策略。在治疗上,粒细胞集落刺激因子(G-CSF)的生长因子支持是治疗的主要方法,对于G-CSF难治性患者可以使用造血干细胞(HSC)增强(boosts)。尽管潜在的病理生理学仍然知之甚少,但过去3年的转化研究表明,CAR-T细胞诱导的炎症和基线造血功能是长期血细胞减少的关键因素。
《The Lancet Haematology》近日发表综述,概述了CAR-T治疗后的血液学毒性特征,并对未来的转化和临床发展提出展望。

CAR-T治疗的血液学并发症
CAR-T的血液学副作用可大致分为三个不同阶段:CAR-T细胞输注前、早期ICAHT(0-30天)和晚期ICAHT(30天后;图1)。

治疗前阶段的特点:包括独特的患者病史、既往细胞毒性治疗的线数及CAR-T细胞输注之前通常应用的holding治疗(单采前的治疗)或桥接治疗(单采-输注之间的治疗)。例如,化疗桥接可导致基线血细胞减少,可以反映出造血储备受损。血液毒性的其他主要基线危险因素为全身性炎症程度(如血清C反应蛋白或铁蛋白升高)和存在骨髓浸润。为了在清淋前对血细胞减少及相关感染进行风险分层,首先在大B细胞淋巴瘤患者的多中心队列中建立了CAR-HEMATOTOX评分,然后在套细胞淋巴瘤和多发性骨髓瘤患者中进行了验证。该评分似乎也可用于识别疾病进展高风险和长期住院的患者。
应用清淋化疗(通常为氟达拉滨[25-30mg /m²]和环磷酰胺[250- 500mg/m²])会导致早期血细胞降至最低点,并可延长至CAR-T细胞输注后10天。在该早期阶段,高级别CRS和相关的细胞因子模式(特别是IL-6和IFN-γ浓度升高)可能会加剧血细胞计数恢复的延迟。CAR-T后早期的中性粒细胞恢复有三种典型轨迹。第一个是快速恢复(quick recovery),指由于使用清淋化疗而引起的短暂性和自限性血细胞减少(约占40%)。其次为间歇性恢复(intermittent recovery),指计数恢复的双相模式,随后二次或多次下降(约40%)。第三个为具有临床挑战性的再生障碍性表型(aplastic phenotype)(约20%),其特征为明显的骨髓发育不全,通常难以治疗,并转化为感染和非复发死亡的高风险。
CAR-T细胞输注后30天为血液毒性的最后阶段,表现为长期或迟发性血细胞减少。为了解这些后期血细胞减少的临床意义,必须考虑先前是否存在血细胞计数恢复(例如,间歇性中性粒细胞恢复与再生障碍性中性粒细胞恢复的患者)。CAR-T细胞输注后持续中性粒细胞减少到次月(如再生障碍表型)的患者发生重度甚至致命感染的风险非常高。虽然复发性细胞减少(例如间歇性表型)患者可能因感染事件或输血需要而反复入院,但多表现出良好的生存结局,因此采取观察等待策略是合理的。尽管如此,持续的血细胞低计数可能会影响患者获得潜在有效的复发后治疗,因为血细胞减少是常见的研究排除标准。最后,任何新发或不明原因的细胞减少必须考虑继发性恶性肿瘤,特别是治疗中出现的髓系肿瘤,因此应考虑骨髓检查。
ICAHT的发生率
有多项研究报道了CAR-T细胞治疗的血液学副作用的发生率和特征(表1)。

一般而言,3级或4级血细胞减少的发生率非常高,介于28-65%(重度血小板减少)、16-77%(重度贫血)和59-95%(重度中性粒细胞减少)。但长期血细胞减少的定义(例如,第21天、第30天、第90天)存在显著异质性,也反映出晚期血细胞减少报告的差异。在疾病方面,与多发性骨髓瘤患者相比,再生障碍表型更常见于淋巴瘤患者(如大B细胞淋巴瘤或套细胞淋巴瘤)。此外,大多数研究表明,与4-1BBξ内结构域相比,接受含CD28ξ内结构域的CAR -T细胞产物的患者血液毒性较高;来自DESCAR-T登记组的axicabtagene ciloleucel对比tisagenlecleucel的配对研究也也可证实。但由于疾病(B细胞前体急性淋巴细胞白血病、B细胞非霍奇金淋巴瘤和多发性骨髓瘤)、CAR -T细胞产物(CD28ξ vs 4-1BBξ)和血细胞减少报告(特别是晚期血细胞减少)的较大异质性,直接比较CAR-T细胞产品的血液学毒性发生率比较困难。2022年的一项荟萃分析显示,B细胞前体急性淋巴细胞白血病患者的高级别学细胞减少率较高,可能是由于白血病原始细胞骨髓浸润和既往的广泛治疗线。应用新的EHA EBMT共识分级时(表2),重度或危及生命的早期ICAHT在套细胞淋巴瘤患者中发病率最高,其次为大B细胞淋巴瘤和多发性骨髓瘤(分别为28%、23%和15%)。然而多因素模型表明,基于疾病的差异其实可反映出患者潜在特征(例如疾病负荷和炎症)的可变性。
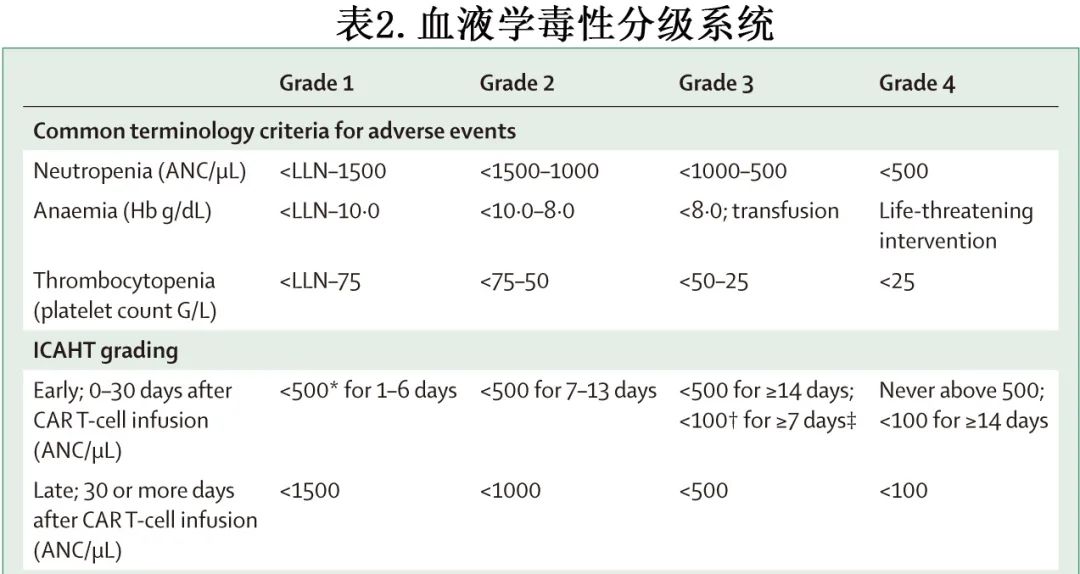
定义ICAHT
CAR-T细胞疗法的初步临床试验主要根据不良事件通用术语标准分级血细胞减少(表2),但这种纯粹的定量分级系统无法捕捉CAR-T后血液毒性的独特特征,也无法反映中性粒细胞减少引起的感染风险;该风险不仅取决于重度中性粒细胞减少的深度,还取决于重度中性粒细胞减少的持续时间(例如,持续时间超过7天)。
为了解决上述限制,EHA和EBMT专家小组开发了一种新的ICAHT分级系统,将早期(0-30天)和晚期(30天后)ICAHT分开考虑。早期ICAHT评估持续性重度(ANC <500/μL)或深度(ANC <100/μL)中性粒细胞减少的持续时间,因此可密切反映美国临床肿瘤学会和美国传染病学会关于癌症相关感染风险的指南。早期ICAHT的严重程度分级遵循轻度、中度、重度和危及生命(类似于广泛实施的CRS和ICANS分级系统)。2024年的一项研究表明,早期ICAHT分级与中性粒细胞恢复的临床相关表型密切相关(pane 1)。同时,重度或危及生命的ICAHT患者经常表现为再生障碍型中性粒细胞恢复表型,与这一小部分患者的深度骨髓再生障碍相一致。尽管ICAHT严重程度与临床有意义的终点具有相关性,如感染、非复发死亡率、输血使用、住院时间和不良治疗结果,但分级系统的效用仍需要进行前瞻性评估。尽管如此,一个标准化的分级系统仍具有特 定优势,例如可实现疾病、CAR-T细胞产品和治疗环境之间的可比性。

CAR-T后血液毒性的病理生理学
一系列临床危险因素有助于CAR-T细胞治疗后血细胞减少的发生,这些因素大致可分为宿主相关因素、疾病相关因素和治疗相关因素。这些因素为理解血液学毒性的潜在病理生理学提供了重要背景。与长期血细胞减少相关的临床变量的异质性表明,血液毒性不太可能仅由任何一个因素介导;相反,与HSC储备、骨髓微环境、全身炎症介质和CAR-T细胞扩增特征相关的各种特征可能协同或独立地共同作用(例如,多因素起源;图2)。

ICAHT的管理
识别重度ICAHT的高危患者
CAR-HEMATOTOX评分可用于对CAR--T细胞治疗后发生重度血液毒性进行早期风险分层。该评分是在清淋开始前计算,包括全血细胞计数(如ANC、血红蛋白和血小板计数)和两种血清炎症标志物(如C反应蛋白和铁蛋白)。与低危(评分0-1)的患者相比,高危(评分≥2)的患者出现重度和长期中性粒细胞减少、重度血小板减少和贫血的比例较高。除了重度ICAHT外,高CAR-HEMATOTOX评分也与重度感染、非复发死亡率增加和治疗结局较差相关,表明该评分具有广泛适用性。此外,该评分在接受BCMA CAR-T细胞治疗的多发性骨髓瘤患者和接受CD19 CAR-T细胞治疗的套细胞淋巴瘤患者中也得到验证。虽然单个评分成分似乎也与成人和儿童 B 细胞急性淋巴细胞白血病患者相关,但许多患者基于评分阈值2归为高危,很可能需要进一步完善该疾病的评分。评分的局限性包括其阳性预测值较低(即,排除优于纳入),此外该评分在较早时间点(即白细胞单采前)是否也具有预测性仍有待观察(而较早时间点预测将使预防性采集自体CD34+干细胞成为血液毒性极高风险患者的潜在挽救策略)。
诊断原则
对于清淋前重度血细胞减少的患者,应强烈考虑潜在的骨髓受累,并通过组织病理学检查予以证实。了解骨髓浸润程度(作为一个高度相关的危险因素)可以帮助解释随后的血细胞减少轨迹并指导治疗策略。到目前为止,用二代测序评估预先存在的CHIP还并非标准方案,但如果患者在CAR-T细胞治疗后发生继发性骨髓衰竭,则冷冻保存抽取的骨髓或外周血单个核细胞进行CHIP检测是明智的,更普遍地说,有助于提高对CHIP在CAR-T治疗患者中的促炎作用的认识。
由于CAR-T细胞输注后的第一周会出现血细胞减少,建议对持续重度中性粒细胞减少超过10天的患者进行更全面的诊断。第一步应包括排除中性粒细胞减少的其他相关原因,如药物诱导的骨髓抑制(如复方新诺明和其他抗生素)、维生素缺乏和偶发感染(如病毒感染或败血症)。对于血清铁蛋白浓度快速升高的患者,应将免疫效应细胞相关噬血细胞性淋巴组织细胞增生症样综合征(IEC-HS)视为重要的鉴别诊断。对于重度或危及生命的早期ICAHT患者和G-CSF难治性患者(例如,G-CSF治疗至少5天但中性粒细胞计数未恢复),应开展更深入检查,包括扩展病毒检查和骨髓评估,以排除持续浸润(例如进展性疾病),并评估CAR-T细胞输注后可能迅速出现的噬血细胞增多或骨髓增生异常的迹象。但典型结果为骨髓细胞减少而没有异常增生的改变。因为担心CAR-T细胞治疗后出现髓系肿瘤,如果出现任何新发或不明原因的学细胞减少,或超过30天未恢复的ICAHT,应考虑进行深入的细胞遗传学检查和二代髓系测序。
治疗策略
CAR-T细胞疗法首次进入临床常规时,普遍不建议使用生长因子来治疗血细胞减少,因为临床前研究表明,使用粒细胞-巨噬细胞集落刺激因子(GM-CSF)可能会促进炎症毒性并诱导神经炎症,因此G-CSF通常推迟到急性CAR-T细胞免疫毒性减弱(通常在第三周)。然而真实世界研究表明,G-CSF可以早在第一周给予,甚至是预防性给药,而不会显著增加≥3级CRS或ICANS的发生率。例如,Lievin等表明,中性粒细胞减少患者早期给予G-CSF(从第2天开始)与降低发热性中性粒细胞减少率相关,且对CAR-T细胞扩增或临床结局没有负面影响。一项纳入197例患者的回顾性研究检查了预防性G-CSF的作用,大多数患者在CAR-T细胞治疗前接受聚乙二醇化G-CSF。尽管2级CRS发生率略有增加(3级未增加),但预防性给予G-CSF与更快的中性粒细胞恢复和更短的静脉抗生素暴露相关;此外,在1级CRS患者中开始使用G-CSF并不会加重CRS。但这些研究并非前瞻性,需要更多的研究来进一步确认早期G-CSF的安全性,并确定每种疾病的最佳治疗方案(例如,早期vs预防性vs ANC触发,或者非聚乙二醇化vs 聚乙二醇化)。诸如CAR-HEMATOTOX等评分可能有助于指导早期G-CSF和抗感染策略,从而有助于将这些干预措施限制于最有可能受益的患者(例如评分≥2的高危患者)。
对于接受CAR-T细胞治疗的患者,大多数中性粒细胞计数最终会自发性恢复或在G-CSF后计数改善,但也有少数患者对G-CSF无反应(<20%),由于这些患者发生危及生命的感染的高风险,临床治疗具有挑战性。如果先前的自体或异体HCT冷冻保存了CD34+干细胞,HSC增强(boost)应作为首选拯救策略(植入率较高)。然而,2023年EHA和EBMT的一项调查显示,即使HSC增强是一种治疗途径,但通常并不可行。多发性骨髓瘤患者可能是个例外,因为正如Mohan等在2024年的一项研究显示,部分年轻患者可能收集额外细胞以进行潜在的第二次巩固性移植。对于有重度血液毒性高风险的CAR-T细胞治疗候选者,预防性收集干细胞已经成功地在患者中进行,但可能与额外的成本和增加的后勤负担相关,且不应延迟CAR-T细胞。G-CSF难治性患者的其他选择包括血小板生成素受体激动剂,如艾曲波帕或romiplostim,但证据有限,尚不清楚其使用是否优于观察等待。血小板生成素受体激动剂和干扰素中和抗体(如emapalumab)都可以靶向上述异常的干扰素信号。对于具有明确炎症应激源(如IEC-HS)且炎症标志物持续升高的3级或4级ICAHT患者,可以尝试参加抗炎药物的试验(如脉冲剂量皮质类固醇),或抗细胞因子治疗(如司妥昔单抗或anakinra)。如果4级ICAHT持续存在(<5%的患者),异基因HCT可作为最后的选择,但会导致CAR-T细胞根除,此时应该仔细权衡几个因素:供者的适用性和可用性、患者的治疗目标、自发性中性粒细胞计数恢复的可能性、致命感染风险及疾病复发的可能性。如果进行观察,建议优化支持策略(例如,预防性抗感染,静脉注射免疫球蛋白治疗,避免接触病人)并进行传染病咨询。
总结和未来展望
在过去的5年中,人们越来越认识到ICAHT是CAR-T细胞治疗的一种独特的临床相关副作用。通过定义血液毒性,EHA和EBMT共识分级系统提供了一个基于严重程度的最佳实践建议框架,类似于CRS和ICANS。此外,该分级为报告ICAHT提供了明确的标准,从而实现了疾病和CAR-T细胞产品之间的标准化对比。然而仍存在尚未解决的临床和转化研究问题 (panel 2)。

本综述主要关注CAR-T细胞,事实上血液学毒性也是双特异性抗体治疗最常见的副作用之一。未来可以研究双特异性抗体治疗中血细胞减少的定性特征,并研究相同的危险因素是否适用。预计需要大型多中心研究来阐明特定既往治疗(如苯达莫司汀)的效果、检查不同清淋方案的影响并确定将CAR-T细胞治疗过渡到早期治疗线是否会减轻重度ICAHT风险。CAR-HEMATOTOX评分也可以通过整合动态危险因素,如炎症标志物(如IL-6和IFN-γ)或进行疾病特异性调整,实现诊断准确性进一步提高。该评分的潜在应用包括高危患者给予抗生素预防或早期G-CSF,但应尽量得到前瞻性研究证实。在临床试验中研究不同的ICAHT缓解策略将有助于确定G-CSF、血小板生成素受体激动剂和HSC增强的最佳时间和顺序。需要考虑的关键临床终点包括中性粒细胞恢复时间、发热性中性粒细胞减少率和感染率,以及其他措施,如抗生素暴露和住院时间。
尽管转化研究已经对ICAHT的潜在机制提供了一些见解,但不太可能有统一的病理生理学,因此,未来的临床前研究必须考虑到宿主相关和疾病相关的一系列特征。机制研究需要结构化的样本采集,在各中心之间进行协调,并应利用新兴技术,如多组学和空间转录组学方法。此外,还需要克服一个问题,那就是缺乏CAR-T细胞治疗对造血影响的临床前和动物模型,从而使系统性评估改善重度ICAHT的新疗法成为可能。最终,解决这些新出现的研究问题需要多边合作、注册研究和精心设计的临床试验共同努力,其中后者应仔细评估具体的管理策略,从而为其他免疫效应细胞疗法(如双特异性抗体)提供蓝图。
参考文献
Rejeski K,et al. Immune effector cell-associated haematotoxicity after CAR T-cell therapy: from mechanism to management.Lancet Haematol . 2024 May 8:S2352-3026(24)00077-2. doi: 10.1016/S2352-3026(24)00077-2.


