BiTE的新形式和新应用
时间:2024-05-22 21:00:41 热度:37.1℃ 作者:网络
1 前言
免疫疗法是治疗癌症的一种革命性方法,包括基于细胞的疗法、疫苗、检查点抑制剂和靶向抗体,以及涉及免疫细胞接合器的最新方法。免疫细胞接合器是一种基于生物工程抗体的分子,旨在将免疫细胞重定向至肿瘤。大多数免疫细胞接合器是具有多个臂的抗体,通过靶向肿瘤抗原和效应细胞表面分子来桥接肿瘤细胞和效应细胞。效应细胞分子必须触发激活免疫效应细胞杀伤机制的信号通路。因此,这些分子的作用模式是在肿瘤细胞和免疫细胞之间形成免疫突触。
第一代双特异性免疫细胞接合器BiTE,通过靶向TAA和CD3的单链抗体将肿瘤细胞和T细胞结合,用于T细胞介导的肿瘤细胞杀伤。靶向CD19和CD3的blinatumomab是临床上典型的BiTE,2014年,blinatumomab成为第一个被FDA批准的免疫细胞接合器,用于治疗ALL患者,在随后的几年里,blinatumomab的治疗范围进一步拓宽,2018年,FDA批准其用于首次或第二次完全缓解后MRD≥0.1%的pre-B ALL患者群体的治疗。目前,超过60例BiTE形式的双抗正在进行I/II期临床试验。
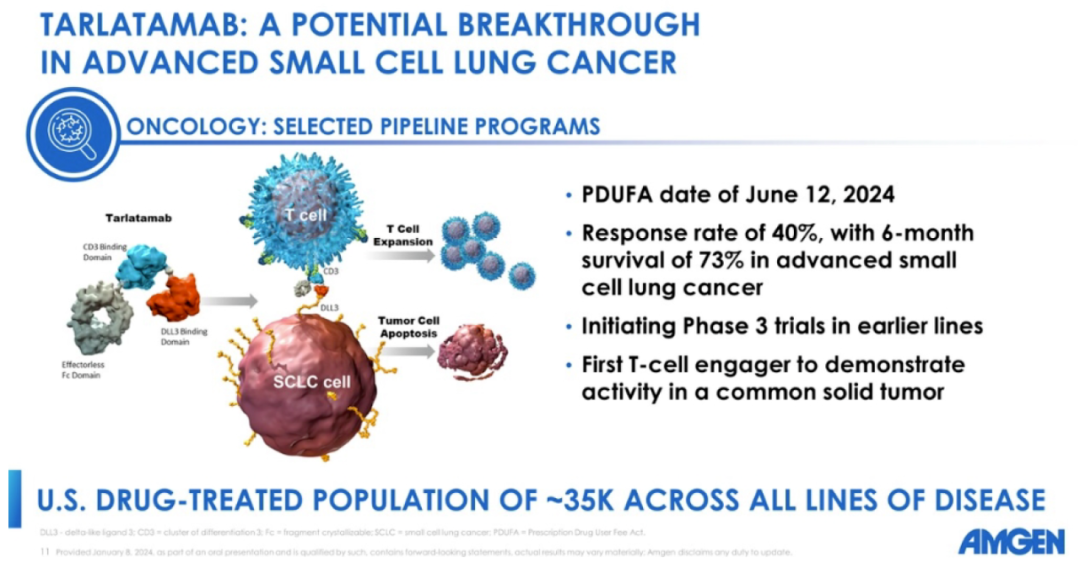
2024年5月16日,FDA加速批准安进DLL3/CD3双抗Tarlatamab上市,用于治疗广泛期小细胞肺癌(ES-SCLC)。临床研究结果显示,99例患者ORR为40%,其中CR为2%,mDoR为9.7个月。此外,《Nature Medicine》报道blinatumomab在6名类风湿性关节炎自身免疫性疾病患者中显示出疗效迹象。BiTE在实体瘤和自身免疫疾病的新领域中展现出良好的应用潜力。
2 BiTE与CAR-T
BiTE和CAR-T细胞疗法之间有明显的相似性。和BiTEs一样,CAR-T细胞能够通过可变的TAA靶向抗原结合域(通常是单链抗体)识别肿瘤细胞。然而,与BiTEs激活不同的是,T细胞不是通过内源性TCR复合物激活的,而是通过来自CD3和共刺激分子(如4-1BB和CD28)的细胞内信号转导域激活的,这些区域被整合到一个合成的细胞表面受体中,细胞外部分含有单链抗体(即CAR)。因此,用CAR结构转导患者的T细胞会导致这些效应细胞针对选定的靶TAA重新定向,从而发挥对肿瘤细胞的杀伤。与BiTE的生产不同,CAR-T细胞制造需要体外基因修饰和细胞扩增,特别是自体T细胞,这是一个相对低效、资源密集、耗时且成本高昂的过程。
T细胞与靶细胞之间免疫突触的形成,细胞的连续杀伤能力,以及细胞溶解蛋白如穿孔素和颗粒酶的定向释放,是CAR-T细胞和BiTEs共同的作用模式特征。此外,BiTEs和CAR-T细胞都是通过CD8+T细胞和CD4+T细胞发挥其效应功能。然而,体外和体内研究表明,来自低分化和未接触抗原的T细胞亚群,如干细胞记忆T细胞(Tscm)或中心记忆T细胞(Tcm)的CAR-T细胞具有优越的抗肿瘤活性、增强的扩增能力和持久的存活期,而BiTE介导靶细胞死亡主要通过抗原经历的T细胞在激活后分化为效应记忆T(Tem)细胞。
3 BiTE的新形式
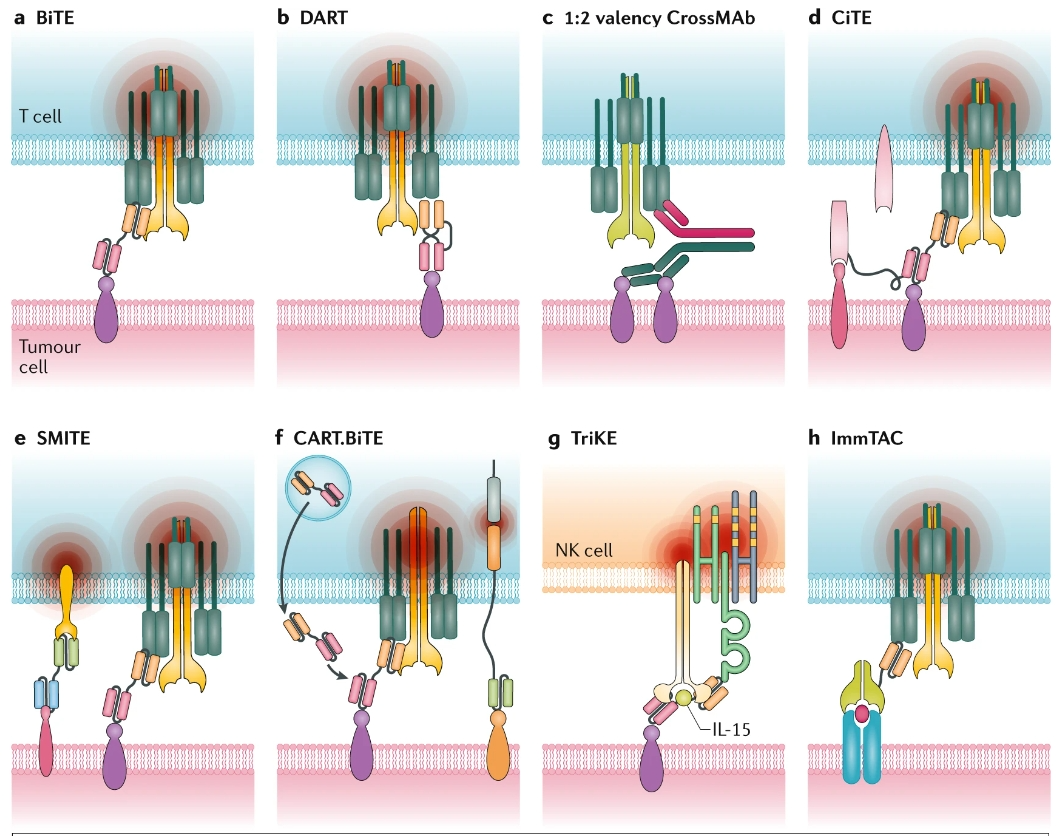
CiTE
双功能检查点抑制性T细胞接合器(CiTEs)将局部限制性免疫检查点抑制功能与BiTEs的T细胞重定向功能结合在一个分子中。CiTEs将PD-1/PD-L1的抑制性功能局限在靶向TAA相互作用的重定向T细胞局部,因此,该分子BiTE部分的功效得到增强,同时避免了与抗PD-1或抗PD-L1 ICI相关的T细胞的全身活化,从而限制了与免疫有关的不良事件的风险。这种新型T细胞接合器的概念证明已在AML的临床前模型中得到验证。
SMITE
同时多重相互作用BiTE(SMITEs)是另一种创新的T细胞参与治疗形式。SMITEs由两个单独的BiTE组成,每一个都针对不同的抗原,其中一个以CD3为靶点,在与靶TAA结合时诱导TCR信号,而另一个靶向CD28以提供T细胞共刺激信号。例如,含有抗PD-L1–CD28 BiTE的SMITEs可通过CD28与T细胞的结合将抑制性PD-L1信号转化为正向的共刺激信号,这些T细胞通过第二个TAA特异性和CD3靶向的BiTE进一步潜在地共同激活。SMITEs可以在任何一种BiTE的最低活性浓度甚至更低的浓度下,依然发挥有效作用。SMITE平台不仅提供了克服由免疫检查点蛋白介导的抵抗机制的机会,而且还可以靶向更广泛的细胞表面TAA,以提高肿瘤的特异性,同时限制免疫逃逸的风险。
TriKE
增强效应细胞细胞毒性的另外一种形式是三特异性杀伤接合器(TriKEs),其主要目的是利用NK细胞对抗癌细胞的活性,并包含与免疫刺激细胞因子相连的双特异性抗体。一种抗CD33-CD16/IL-15的TriKE能将NK细胞定向到髓系母细胞,目前正在AML患者中进行临床研究(NCT03214666)。
DART
改变“典型”BiTE的结构可以提供多种新的治疗方法。例如,新的双亲和力再靶向蛋白(DART)已经被开发出来,它们具有比BiTEs更有利的结构和生物学特性,包括更大的稳定性和将T细胞毒性靶向恶性细胞的最佳重定向。DART分子是由提供双重抗原结合位点的两个Fv链组成的双特异性diabody,通过二硫键和非共价键组装,从而提高稳定性并限制链内域相互作用。在临床前模型中,DARTs比BiTEs表现出更好的细胞毒性。重要的是,DART分子可被设计成包含Fc结构域(例如,duvortuxizumab、gpA33和PRS-343),其半衰期更长,因此有助于使用更方便的间歇给药,而不是连续输注。
CrossMAb
传统的BiTEs是对称设计的,CD3和TAA为1:1,通过1:2设计增加结合能力可能提高对肿瘤细胞的识别,同时避免在TAA缺失的情况下CD3在T细胞上的激活。一种被称为CrossMAb技术的创新设计平台能够以完整的IgG形式生成1:2价的双特异性抗体。Cibisatamab(又称CEA-TCB)是一种CrossMAb 形式的双抗,CD3和CEA的效价为1:2。Cibisatamab于2014年进入I期试验,目前正在表达CEA的实体瘤患者中进行研究(NCT02324257和NCT02650713)。
ImmTACs
抗癌免疫动员单克隆T细胞受体(ImmTACs)是一种新型的双功能抗体药物,结合了基于TCR的靶向系统和抗CD3单链抗体效应器功能。因此,这些分子可以将多克隆效应性T细胞重定向到肽-MHC复合物中呈现的TAAs或肿瘤特异性新抗原,包括来自细胞内蛋白质的抗原。通过利用可溶性高亲和力单克隆TCR结构域促进大量多克隆效应T细胞的招募,这类分子有潜力以现成的形式克服非炎性环境的TME。Tebentafusp是第一个ImmTAC,靶向黑色素瘤相关抗原gp100与HLA-a*02:01复合物呈递的多肽;目前已被FDA批准用于HLA-A*02:01阳性且患有不可切除或转移性葡萄膜黑色素瘤的成年患者。
4 BiTE的新应用
BiTE在血液瘤已经获得了巨大的成功,但是在实体瘤一直到未有实质性的突破。然而,近日Tarlatamab的获批对未来整个行业将会是一个重大的里程碑事件。Tarlatamab获批基于II期DeLLphi-301试验结果,该研究旨在评估两种剂量的Tarlatamab在既往接受过治疗的ES-SCLC患者中的抗肿瘤活性和安全性。
DeLLphi-301试验结果表明,tarlatamab对既往接受过大量治疗的小细胞肺癌患者具有持久抗肿瘤活性。10mg剂量具有更优的抗肿瘤活性,客观缓解率高达40%(远超过15%的历史对照基准),约1/4患者无进展生存期超9个月,中位总生存期高达14.3个月。tarlatamab通过结合DLL3和CD3的方式使T细胞接近小细胞肺癌细胞,而不依赖于I类MHC抗原呈递,最终杀伤肿瘤细胞,可能为小细胞肺癌治疗带来新的突破。
此外,最近的另一项研究显示出BiTE在自身免疫疾病的应用潜力。这项研究招募了6名多重耐药的类风湿性关节炎患者接受低剂量blinatumomab治疗。这些患者接受9μg blinatumomab治疗5天,随后暂停1周,然后再次给药治疗5天。研究结果显示,在类风湿性关节炎患者中,低剂量blinatumomab是安全的,没有临床相关细胞因子释放综合征的迹象。它导致了外周和滑膜组织中的B细胞清除。在12周时,所有患者的类风湿性关节炎临床疾病活动都有所下降,包括软关节数量下降(从9个下降到0.5个),患者整体疾病评估有所改善(从60分提高到10分)。这些影响大多在长达6个月的随访中得以维持。此外,Cullinan Therapeutics计划在今年晚些时候提交一份用于红斑狼疮(SLE)的CD19xCD3双特异性CLN-978试验的研究性新药申请。
5 小结
在过去的30多年里,我们经历了一个巨大的转变,从仅仅开发和改造基本的单克隆抗体,发展到更复杂的抗体衍生物,其形状和尺寸多种多样,尤其是双特异性抗体。双抗技术在临床应用中具有非凡的前景并已发展出包括BiTE等极为丰富的形式,为基于双抗的癌症免疫治疗奠定了坚实的基础。
目前临床试验中的大多数BiTE只在对抗血液恶性肿瘤中取得成效。相比之下,靶向实体肿瘤的进展依然缓慢。但是,目前的一些结果为T细胞接合器在实体瘤和其它疾病领域的应用带来了曙光。这些研究的结果证明了这些分子在新的药物设计和随后的多领域临床应用中具有良好的前景。
参考文献:
1. T cell-engaging therapies - BiTEs and beyond. Nat Rev Clin Oncol. 2020 Jul;17(7):418-434.
2. Bispecific antibody takes a BiTE out of B cells in rheumatoid arthritis. Nat Rev Drug Discov. 2024 May 13
3. Ahn MJ, Cho BC, Felip E, et al. Tarlatamab for Patients with Previously Treated Small-Cell Lung Cancer. N Engl J Med. 2023 Oct 20.


