Circ Res:哈尔滨医科大学潘振伟/杨宝峰发现心肌缺血/再灌注损伤的调控新机制
时间:2023-01-03 15:00:38 热度:37.1℃ 作者:网络
ASPP1 (apoptosis stimulating of p53 protein 1)作为p53的辅助因子,促进其在细胞核内的转录活性,在调节细胞凋亡中起重要作用。然而,细胞质ASPP1是否影响p53核转运及其在心脏疾病中的作用尚不清楚。
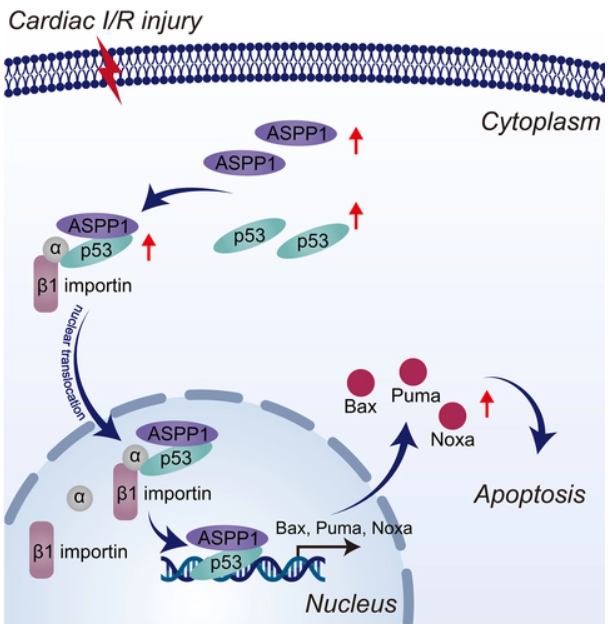
2022年12月30日,哈尔滨医科大学潘振伟及杨宝峰共同通讯在Circulation Research(IF=23)在线发表题为“Interdependent Nuclear Co-Trafficking of ASPP1 and p53 Aggravates Cardiac Ischemia/Reperfusion Injury”的研究论文,该研究表明ASPP1和p53相互依赖的核转运加重心肌缺血/再灌注损伤。免疫荧光染色显示,正常情况下,ASPP1和p53均在新生小鼠心室心肌细胞胞浆中共定位,缺氧/复氧处理后,ASPP1和p53均上调并向细胞核转移。ASPP1和p53的核易位是相互依赖的,敲低ASPP1或p53中的任何一个都会减弱另一个的核易位。在缺氧/复氧刺激下,抑制importin-β1导致新生小鼠心室心肌细胞p53和ASPP1的细胞质隔离。过表达ASPP1增强,而敲低ASPP1抑制Bax (bcl2相关X)、PUMA (p53上调凋亡调节剂)和Noxa的表达,这些都是p53凋亡相关的直接靶点。
I/R心肌ASPP1水平升高。心肌细胞特异性转基因ASPP1过表达加重I/R损伤,表现为梗死面积增加和心功能受损。相反,敲除ASPP1可减轻心脏I/R损伤。在暴露于缺氧/复氧损伤的新生小鼠心室心肌细胞中观察到相同的定性数据。此外,在体外和体内,抑制p53显著削弱了ASPP1的促凋亡活性和有害作用。ASPP1与p53的结合通过importin-β1触发它们的核共易位,最终加剧心脏I/R损伤。这些结果表明,干扰ASPP1的表达或ASPP1与p53之间的相互作用以阻断其核转运是心脏I/R损伤的重要治疗策略。
心肌梗死在世界范围内具有较高的发病率和死亡率,严重威胁着人类的健康。心肌梗死患者冠状动脉灌注恢复过程中常发生心肌缺血/再灌注损伤。虽然预防心脏I/R损伤已经付出了巨大的努力,但仍然缺乏有效的治疗药物和分子干预靶点。进一步阐明心脏I/R损伤的分子机制,确定心脏I/R损伤的有效靶点,以改善治疗状态仍是十分必要的。
心肌细胞凋亡是一种由病理性刺激引起的程序性细胞死亡,严重损害心脏结构和功能。肿瘤抑制因子p53是一种经典的促凋亡蛋白,在I/R心脏中被激活,并促进促凋亡靶基因的转录。ASPP1与ASPP2、iASPP同为ASPP(凋亡刺激蛋白p53)家族成员。ASPP1和ASPP2与p53结合促进细胞凋亡,而iASPP则相反。在之前的一项研究中,作者证实了iASPP在心肌细胞中的抗凋亡作用,通过抑制p53的表达来缓解心肌缺血损伤。ASPP1对于提高p53在细胞核中的转录活性至关重要。
ASPP1的下调可以通过抑制p53的转录激活来阻断肾透明细胞癌的凋亡。同样,ASPP1可以通过增强p53的转录活性来维持造血干细胞库的完整性,预防恶性血液病的发生。目前,ASPP1在心脏I/R损伤中的作用尚不清楚。
机理模式图(图源自Circulation Research )
核易位是p53促凋亡活性的关键。经典的import-cargo通路执行p53核易位,其中p53的核定位信号(NLS) I结构域与importin-α3结合,通过importin-β进入细胞核。一个有趣的问题是,除了ASPP1影响p53的核转录活性外,它是否影响p53的核易位尚不清楚。与p53不同的是,ASPP家族的另外两个成员,ASPP2和iASPP通过一个不依赖于importin的途径转移到细胞核。它们通过锚蛋白重复结构域与RanGDP结合,并通过NTF2(核转运因子2)转运到细胞核。然而,ASPP1如何转运到细胞核仍有待研究。
本研究探讨了ASPP1和p53核易位的分子机制及其对心脏I/R损伤的影响。该研究发现缺血性心肌细胞中ASPP1和p53的核易位相互依赖,显著加重心肌细胞凋亡。该研究强调了细胞质ASPP1-p53相互作用在心脏I/R损伤中的意义。
原文链接:
https://www.ahajournals.org/doi/abs/10.1161/CIRCRESAHA.122.321153