【柳叶刀-血液学】EBMT专家共识:异基因造血干细胞移植后的供者淋巴细胞输注
时间:2024-05-30 14:00:32 热度:37.1℃ 作者:网络
供者淋巴细胞输注
异基因造血细胞移植(HCT)后给予供者淋巴细胞输注(DLI)在诱导或维持移植物抗白血病免疫方面的附加价值无可争议,已成为预防性、抢先(pre-emptive)性或治疗性免疫治疗的常见做法。然而,与异基因HCT一样,各中心均有自己的DLI惯例和实践,且仍存在许多问题(包括最佳应用和毒性、DLI诱导的肿瘤免疫的免疫生物学)。
作为欧洲血液和骨髓移植学会(EBMT)实践协调和指南委员会及细胞治疗和免疫生物学工作组工作的一部分,一个具有移植免疫学和细胞治疗临床和转化知识的专家小组于2023年9月在法国里尔举行了为期两天的研讨会,制定了一组基于共识的建议,用于指导血液恶性肿瘤异基因 HCT 后应用DLI。鉴于大多数报道缺乏前瞻性数据,这些建议主要基于回顾性研究和专家共识。

现状
DLI的成分
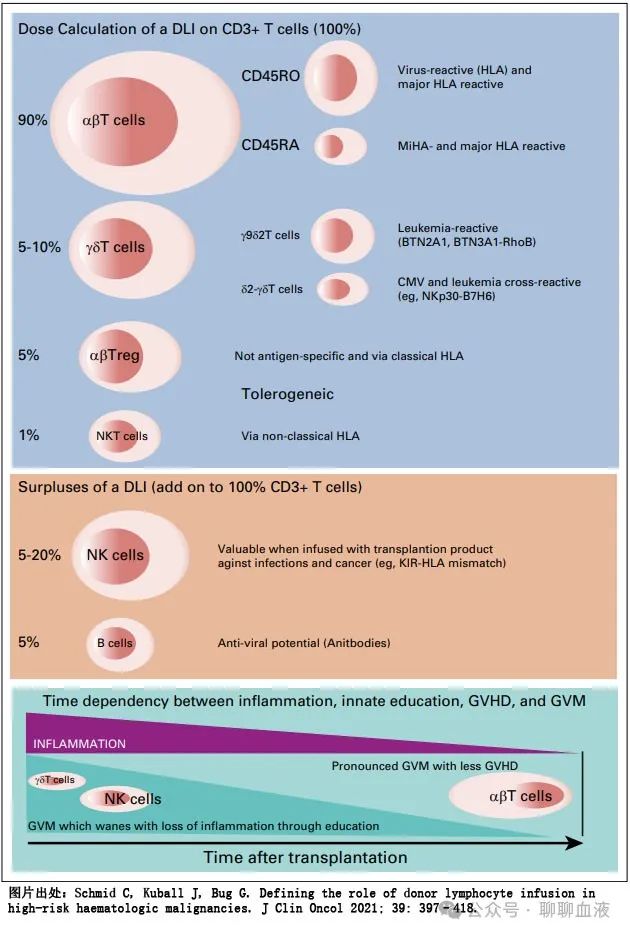
输注来自干细胞供者的淋巴细胞是一种免疫治疗策略,能够加强移植后移植物抗白血病效应。DLI 不太常用的指征包括恢复抗感染控制(通过提供免疫效应器来进行不同类型的免疫反应)。这一HCT 后过继免疫策略的标准方法为输注未处理的供者来源淋巴细胞。DLI 产物通常由 T 细胞(整个产物的80-90%)、B细胞 (~5%) 和NK细胞 (5-20%) 组成。在 T 细胞中,αβT细胞效应亚群最具代表性,占 T 细胞库的90%,其次为γδT细胞 (5-10%)、αβT调节细胞 (5%) 和NKT细胞(<1%)。比例的变化取决于供者的免疫状态、细胞采集前 G-CSF 的使用和 DLI 产物的保护状态。
移植物抗恶性肿瘤免疫
异基因移植物和 DLI 产物中的淋巴细胞亚群均可促进移植物抗白血病免疫或移植物抗淋巴瘤免疫(图1)。
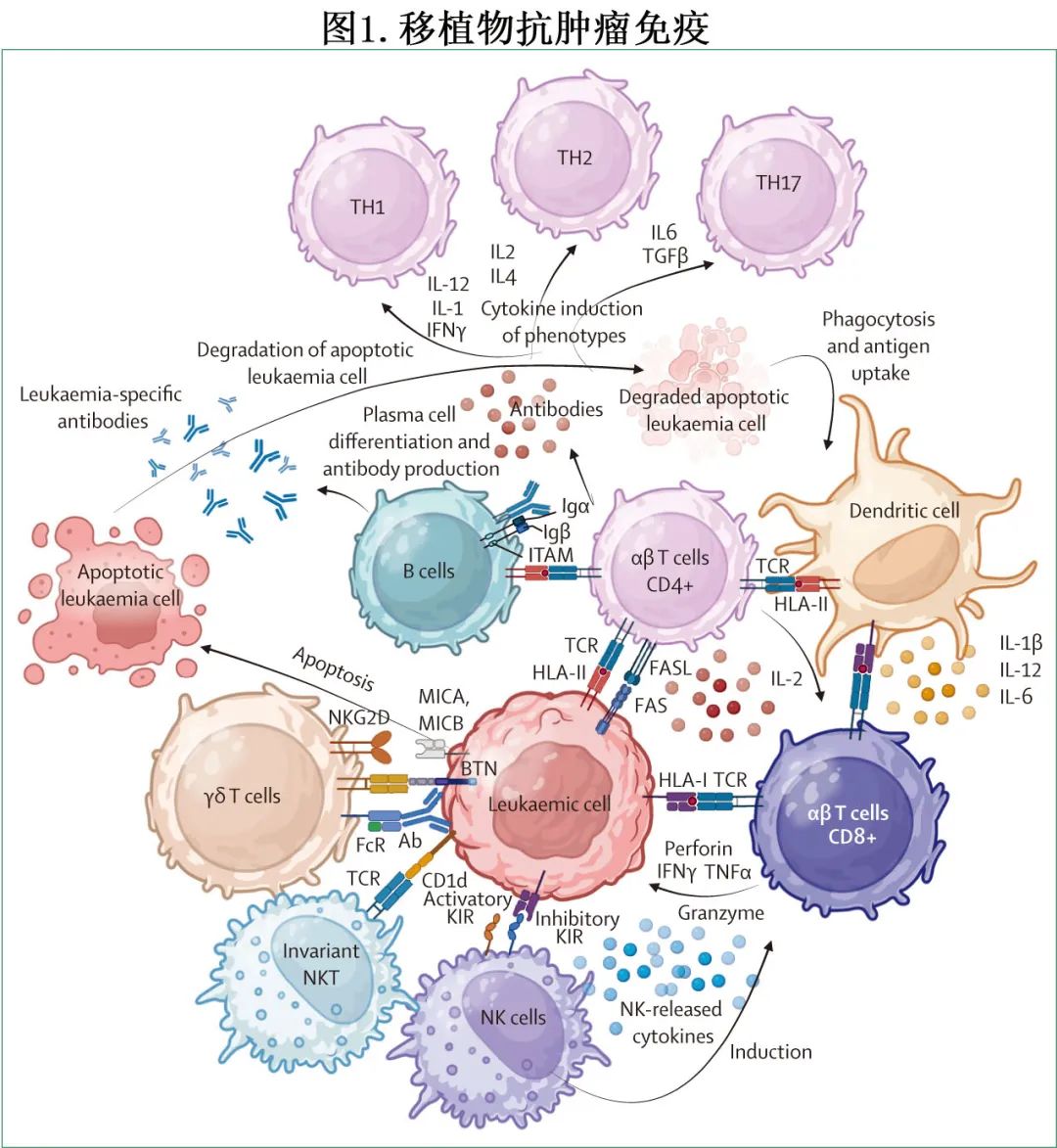
在复发性慢性髓性白血病患者中,DLI诱导的完全缓解可与血清中出现白血病靶向抗体同时发生。在高危急性髓系白血病或复发性骨髓增生异常综合征患者中,可观察到持久体液移植物抗白血病应答(可靶向膜表达的肿瘤特异性抗原)。T 细胞异基因反应性(alloreactive)的主要靶标为次要组织相容性抗原(minor histocompatibility antigens),限于造血干细胞(移植物抗白血病的理论靶标)或广泛表达(可增强移植物抗宿主病):HLA不相合;来源于突变蛋白的新抗原;参与γδT细胞的相互作用的酪蛋白和酪蛋白样蛋白;来源于恶性细胞中大量表达的野生型蛋白的抗原(例如WT1)。T 细胞受体库的特异性和多样性(尤其是在αβ亚群中)是异基因反应性的主要分子特征,驱动移植物抗白血病和GVHD。具体而言,与非应答者相比,对 DLI 应答的患者具有更高的 T 细胞异质性,强调了具有多样化表型在诱导有效抗白血病作用的重要性。与发生 GVHD 的患者相比,无 GVHD 的移植物抗白血病患者的 CD8 T 细胞受体库的分子多样性较低,该发现强调了活性、多样性和特异性 T 细胞库在增强异基因反应性 T 细胞介导的应答的重要性。在其他细胞类型中,CD8+终末分化的效应记忆细胞在 DLI 应答的急性髓系白血病患者中发生克隆扩增和肿瘤特异性活化,从而支持移植物抗白血病效应中存在抗原特异性。
DLI 细胞产物的分析揭示出幼稚T细胞和经历抗原的 T 细胞比例的巨大异质性,可能对疾病控制有影响。用于治疗急性髓系白血病复发的 DLI 细胞产物含有低水平的效应记忆细胞和大量幼稚 T 细胞,与长期缓解相关。
γδT细胞在实体瘤和血液恶性肿瘤中均显示出抗肿瘤活性,它们可与癌细胞表达的应激诱导分子或与不相合的 HLA 分子相互作用。由于γδT细胞发挥作用不受 HLA 单倍型影响,因此认为其可在不引起 GVHD 的情况下驱动移植物抗白血病应答。同样,invariant NKT 细胞表达invariant T 细胞受体(Vα24-Jα18和Vβ11),并通过非多态性 I 类样 HLA 分子(例如CD1d)识别糖脂抗原(如α-半乳糖神经酰胺)。干细胞移植物中高invariant NKT 细胞数量与 GVHD 发生率降低相关,并可改善无 GVHD 和无进展生存期。临床前研究表明,这些效应器可杀死急性髓系白血病原始细胞。NK 细胞通过激活或抑制杀伤细胞免疫球蛋白样受体 (KIR) 识别来源于经典和非经典HLA、粘附分子和其他结构的自身肽。具体来说,NK细胞的这个亚群可识别转化细胞的特定分子构型,如 HLA I 类分子的下调,从而保留健康组织。在单倍型的情况下,NK细胞功能尤为重要,而供者和受者之间的 KIR 配体错配可能触发有益的异基因反应性反应。存在与 HLA 分子相互作用的一些供者抑制性 KIR可预防 HLA相合非亲缘供者 HCT 治疗急性髓性白血病后的白血病复发。该观察结果表明,选择具有某些 KIR 基因(如2DL5A、2DS1和3DS1)的供者可降低白血病复发率,因此在异基因HCT中使用 NK 细胞异基因反应性作为治疗策略具有潜力。
NK 细胞、NKT细胞和γδT细胞可通过颗粒酶和穿孔素释放显示细胞毒活性,刺激后生成细胞因子(如IFN-γ、TNF-α和IL-4)可使这些细胞能够与肿瘤部位的其他免疫效应器(T细胞、B细胞、NK细胞、单核细胞和粒细胞)相互作用。
免疫逃逸机制
作为移植后复发独特生物学的反映,移植物抗白血病和 DLI 的疗效可能受到许多免疫逃逸机制的损害,包括抗原呈递机制的分子功能障碍、肿瘤诱导的 T 细胞耗竭的不同模式、肿瘤特异性抗体减少,从而产生免疫耐药性疾病表型(图2)。
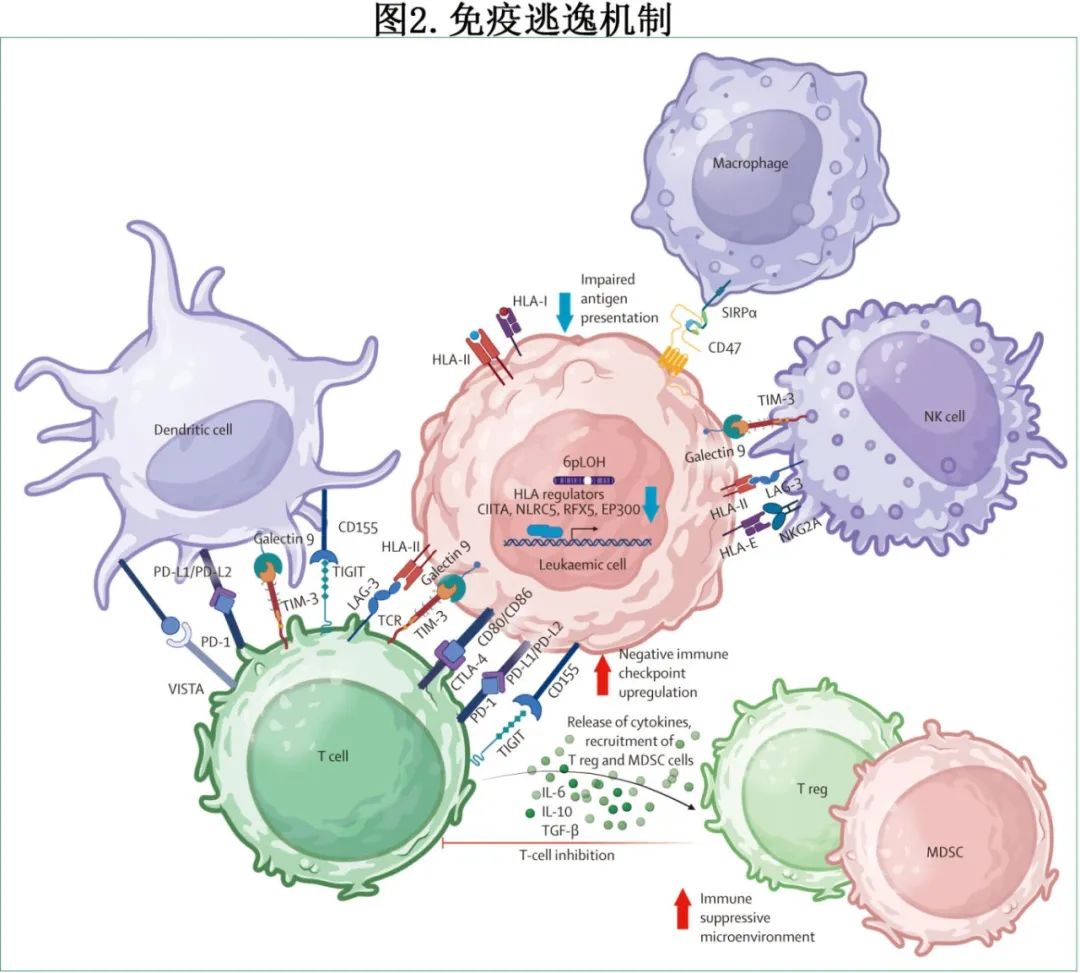
其中HLA分子的表达缺失(无论是通过基因组还是表观遗传机制)是白血病复发中的一种常见畸变。HLA 杂合性缺失、HLA单倍型缺失、特定 I 类和 II 类 HLA 等位基因突变或小缺失均为肿瘤逃逸机制,可发生于相合和不相合移植中。转录下调(可能是由于表观遗传重编程)可降低II 类相关呈递(特别是 DRB1 等位基因)的强度,突出了CD4+介导的免疫压力的重要性。尽管基线 HLA 表达由分子疾病亚型决定(例如,NPM1突变白血病具有低 HLA-DR 表达),但已观察到各疾病亚型移植后急性髓性白血病复发的 HLA 表达变化。在最近的一项研究中,II类 HLA 的表观遗传沉默受到多梳抑制复合物2的调控,其选择性抑制可恢复 HLA II 类表达和异基因反应性 CD4 T 细胞的抗原呈递。在急性髓系白血病移植后复发的情况下,其他非 HLA 免疫相关基因(即IFN-γ应答途径和抗原呈递机制中干预的其他基因)的转录受损。最后,急性髓性白血病细胞可快速产生一系列抑制信号,例如膜表达的抑制配体和检查点抑制剂或可溶性因子(例如芳香烃受体激动剂),导致逃避 NK 或CD8+ T细胞介导的肿瘤控制。
利用DLI选择性地增强移植物抗白血病作用
在引入 DLI 作为治愈复发性白血病的方法后,早期便出现报告,利用 DLI 选择性增强移植物抗白血病免疫而不诱导 GHVD 。例如,产物中CD4+ T细胞的富集可降低 GVHD 风险,复发性慢性髓性白血病可以通过CD8+ T细胞耗竭的 DLI 治愈。近二十年来更多的努力集中于对 DLI 产物中其他细胞亚群的富集或耗竭。例如,已提出从冻存 DLI 中扩增invariant NKT 细胞作为增强抗白血病控制、克服 GVHD 风险的策略。但到目前为止,基于产物中 CD3 T 细胞数量的简单 DLI 给药是跨移植中心广泛确立的唯一策略。
专家推荐
DLI的指征
目前DLI有三种不同指征(panel 1)。

预防性 DLI 用作维持治疗(预防异基因 HCT 后复发),适用于无基础疾病证据、基于以下三个因素之一为疾病复发高风险的患者:高危疾病特征(例如高危遗传学或继发性疾病);难治性或晚期疾病的移植后;使用体外清淋(ex-vivo lymphocyte depletion)作为 GVHD 预防。在非清髓性预处理或不存在可靶向分子靶点的情况下,无论预处理方案如何,均可考虑预防性 DLI。
抢先性 DLI 用于血液学疾病缓解但供体嵌合体不完全或减少的患者,或疾病极低水平可检测的患者(可测量残留病或观察到亚临床复发的首个体征时[例如,分子学或细胞遗传学复发]),或通过流式细胞术检测到疾病复发。
治疗性 DLI 作为明显血液学复发或移植物衰竭管理的一部分给药,最好在通过全身性治疗(即化疗、去甲基化药物或靶向治疗)获得疾病控制后给药。
在欧洲的DLI管理实践中,初步调查显示,117个EBMT中心中有超过114个(97%)将DLI作为其细胞治疗方案的一部分,其中分别有47% (n=53)、84% (n=96)和77% (n=88)采用预防性、抢先性和治疗性方法。
作为一种改善免疫重建和免疫效应反应多样性的手段,DLI还可用于预防免疫恢复延迟患者的复发性感染,以及治疗移植后淋巴细胞增生性疾病。但由于缺乏关于指征、剂量、时间和疗效的数据,无法确定关于DLI的明确建议。在这种情况下,第三方抗病毒淋巴细胞是一种可行的治疗选择。
由于应用技术的差异性,测量嵌合体和监测残留病或早期复发的敏感性也不同,导致已发表的关于预防性和抢先性 DLI 的数据在其疗效方面具有相当大的不确定性。
未处理DLI的实际应用
由于DLI类型的差异性,实用建议只能包括最常用的应用(即输注未处理供者淋巴细胞);但即使在报道该疗法的研究中,也存在一定的异质性。DLI可以在初始移植时获得,彼时细胞已暴露于G-CSF并在采干时冷冻保存;供者淋巴细胞也可以通过第二次单采获得,在不需要任何刺激剂的情况下收集外周血单核细胞,该过程通常在初始移植后不久根据需要进行,且不使用粒细胞G-CSF来动员细胞。通常来说,首次DLI是在单采后立即作为新鲜剂量给药,而大多数收集的细胞以冷冻保存(以相同或递增剂量分为不同部分)。现有数据并未显示两种方法的结果有实质性差异。
对于所有指征,都需要特别注意平衡DLI的疗效与基础疾病和副作用风险(尤其是GVHD)。DLI 后 GVHD 的风险主要受供者类型和 HLA 配型、细胞用量、DLI的时机和频率、既往 GVHD 病史以及 DLI 时是否仍需免疫抑制药物的影响,这些因素是考虑进行 DLI 的前提条件,以及指导细胞剂量、移植和首次 DLI 给药之间时间间隔和后续 DLI 给药之间间隔的指南的前提条件。根据预防性、抢先性或治疗型指征所需的抗白血病疗效强度不同而使用不同的方案(表1)。
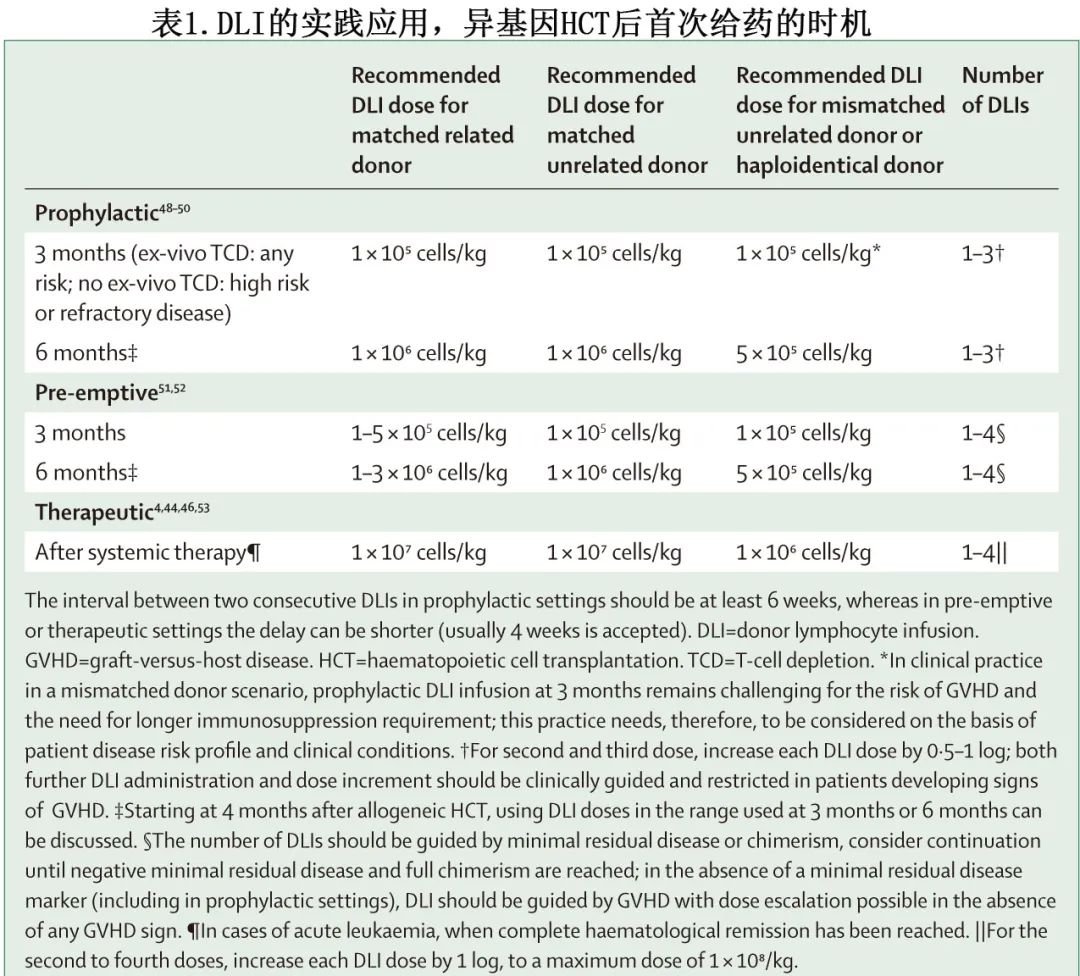
根据最常用的策略,为DLI的前提条件提供的建议见panel 2。在临床实践中,针对患者个人需要考虑这些建议,包括个人风险、供者类型、移植物来源、GVHD预防和预处理方案。

DLI后,考虑到GVHD的所有可能表现和其他副作用,必须在移植门诊进行密切的临床和实验室监测。目前缺乏前瞻性数据,建议每周或每两周监测一次全血细胞计数和生化(取决于患者对毒性体征和症状的认识),包括肝功能检查。在连续DLI的情况下,应仔细重新评估上述先决条件,如果观察到任何变化,应立即推迟或取消DLI给药。此外,对于发生GVHD的患者,即使是无症状的患者,也应进行定期监测(理想的是每3个月或6个月)肺功能检查以排除肺部GVHD。
由于大约30%的急性髓性白血病复发与HLA表达缺失有关,建议对复发的急性髓性白血病进行HLA分子表征,至少应在单倍型和非亲缘异基因HCT时;但该建议缺乏标准化的免疫遗传学程序,许多实验室使用内部开发的生物分析管线。存在这些分子特征时不应使用预防性或治疗性DLI,因为它们对HLA阴性复发无效,并且有潜在的和不必要的GVHD风险。
特定疾病的考虑,以及DLI与药物治疗的可能结合
一般来说,DLI既可以与药物治疗联合使用,也可以与药物治疗序贯使用,以提高其对恶性肿瘤的疗效(表2);但DLI在不同疾病管理中的地位并未统一。必须特别注意基础疾病对异基因移植物抗恶性肿瘤效应的敏感性。2010年由美国国家癌症研究所组织的异基因HCT后复发研讨会全面评估了各种疾病对DLI的敏感性,表明敏感性水平各不相同:慢性髓性白血病、骨髓纤维化、低级别非霍奇金淋巴瘤和多发性骨髓瘤对DLI的敏感性明显较高;慢性淋巴细胞白血病、急性髓细胞白血病、骨髓增生异常综合征和霍奇金淋巴瘤具有中等敏感性;急性淋巴细胞白血病和弥漫性大B细胞淋巴瘤敏感性较低。这种敏感性差异是异基因HCT和DLI成功的基础,可能与肿瘤免疫原性、肿瘤生长(在快速增殖性疾病中负担更高)以及产生免疫逃逸特征的倾向同样相关。认识到敏感性的差异有助于根据每种疾病的具体需要和特点制定治疗策略,避免治疗本身的毒性。
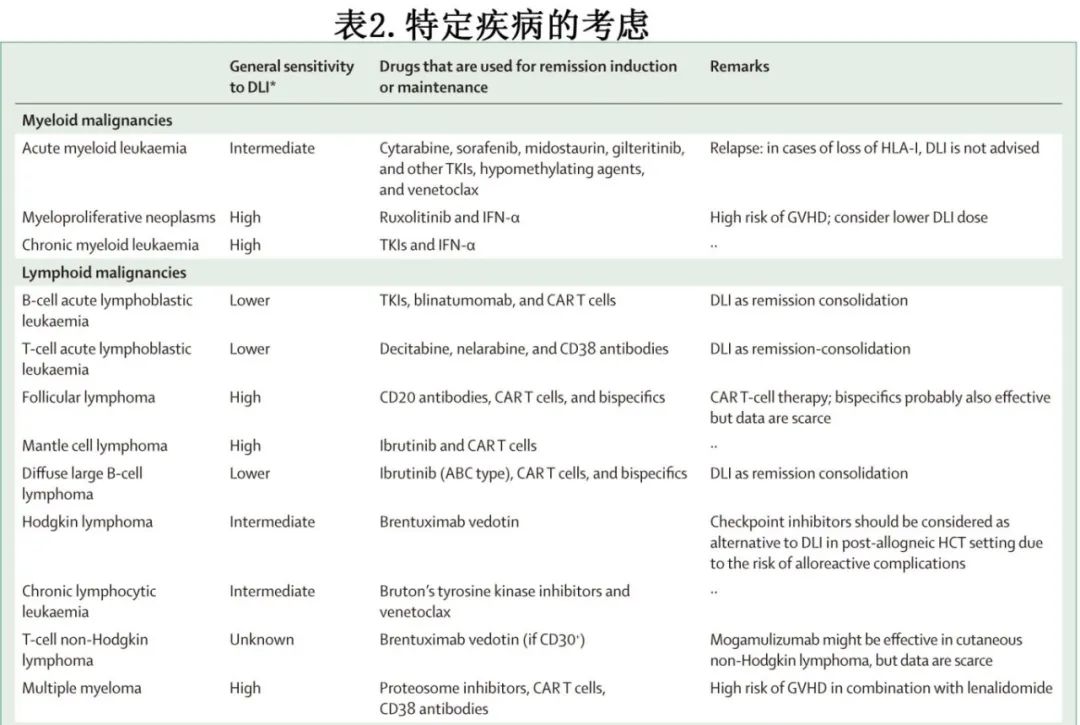
对于明显血液学复发的患者,DLI通常是在通过化疗、疾病特异性药物或免疫治疗(如双特异性抗体治疗、CAR-T)初步控制恶性肿瘤后应用,该顺序在快速进展的疾病中尤其重要,如急性白血病。在接受预防性或治疗性DLI的患者中,已经研究了联合疾病特异性药物(注:尚无药物批准联合DLI)。特别是,免疫调节剂来那度胺和检查点抑制剂(例如纳武利尤单抗、帕博利珠单抗和伊匹单抗)与重度GVHD的发展有关,因此应避免与DLI联合使用。当与其他药物联合使用时,如果预期GVHD风险增加,可能需要调整DLI的指征、剂量和时间。
除了对恶性肿瘤的直接细胞毒作用外,部分疾病特异性药物还具有增加DLI治疗潜力的附加特性。FLT3抑制剂索拉非尼可通过恢复急性髓性白血病细胞中下调的IL-15的产生,显示出与DLI的协同作用;去甲基化药物阿扎胞苷也可上调肿瘤相关抗原。临床上,急性髓性白血病患者对阿扎胞苷的反应与针对白血病相关抗原的特异性CD8+细胞毒T细胞克隆的扩增有关。然而,其他研究也有报道,在去甲基化药物治疗下抑制性免疫检查点上调,与移植和非移植情况下的较差结局有关。因此,药物和细胞治疗之间的相互作用尚未得到很好的理解,药物可能对免疫细胞产生相互矛盾的作用,对DLI的疗效和毒性的影响尚不清楚。
有学者争论,新的药物或免疫疗法是否可以取代DLI,特别是在B细胞恶性肿瘤和骨髓瘤方面,CAR-T细胞和双特异性抗体在移植后诱导缓解方面显示出强有力的结果。这些疗法是否应优先于DLI或应视为DLI的桥接(作为巩固治疗),目前仍有待确定。表2概述了联合DLI或替代DLI的研究性药物,可参考综述(Schmid C, Kuball J, Bug G. Defining the role of donor lymphocyte infusion in high-risk haematologic malignancies. J Clin Oncol 2021; 39: 397–418.)。
DLI后的早期和晚期毒性
诱导GVHD是DLI最相关的毒性。DLI后发生GVHD的风险主要受供者类型、细胞剂量、DLI的时间和频率、既往GVHD病史、DLI发生时是否仍需免疫抑制药物等因素影响。在EBMT急性白血病工作组的一项回顾性登记研究中,在HLA相合移植中,抢先性和预防性DLI 的2-4级急性或慢性GVHD的累积发病率为11.9%和30.7%。6%的患者死于DLI诱导的GVHD,年龄>60岁、移植时为晚期、异基因HCT后间隔时间较短、既往急性≥2级GVHD是DLI诱导的GVHD的危险因素。在另一项研究中,高强度DLI(定义为更高的T细胞剂量或比国际指南推荐更早应用)是急性GVHD的一个重要危险因素。在单倍型相合移植中,EBMT登记组的数据显示,预防性DLI组2-4级急性GVHD和慢性GVHD的累积发病率(CI)分别为17%和53%,抢先性DLI组为20%和21%,治疗性DLI组分别为17%和24%。然而,尽管DLI引起GVHD的风险相当大,但各种研究(主要评估预防性DLI)仍显示出其临床价值,与匹配的对照组相比,显示出可接受的毒性和复发率降低。
DLI相关血液学毒性更有争议,可能很难与其他并发症(例如,病毒感染,药物引起的学细胞减少,疾病复发或克隆演变)相鉴别,特别是在治疗环境中,特别是当DLI与其他全身治疗(例如去甲基化药物或酪氨酸激酶抑制剂)联合使用时。这种类型的毒性在回顾性研究中很少涉及,可能是由于在移植后的情况下很难追踪,因此无法确定事件的发生率和特征。建议在排除所有其他可能的原因后,在DLI后1天至30天内出现的所有类型的血细胞减少都认为与DLI有关。
虽然没有很好地表征,但从免疫生物学的角度来看,可以假设血细胞减少综合征可能是供者来源免疫效应物对造血干细胞或更成熟细胞的直接影响。病理生理可由T细胞介导的对造血干细胞和祖细胞的反应引起,有时与T细胞少克隆或大颗粒淋巴细胞的发生有关,可能模拟骨髓衰竭。或者,这种血细胞减少综合征可能与供者来源的B细胞再循环和抗体产生有关。最后一种情况,在更严重的情况下,可能与溶血性贫血、免疫介导的血小板减少症和自身免疫性中性粒细胞减少症有关,可为孤立性或多种组合。应始终进行定向和详尽的诊断评估(包括寻找病原体、维生素缺乏、外周抗体和骨髓衰竭原因),以正确管理基础疾病。如果DLI后发生3-4级血液学毒性,不建议延长DLI给药时间,根据具体情况,可能需要启动或加强生长因子、类固醇或免疫抑制治疗,同时进行抗感染预防。
尚无结果的问题及未来研究
尽管DLI已在所有移植中心常规使用了数十年,并发表了超过4400篇相关报道,但许多问题仍未得到解答——部分原因是由于DLI未归类为药物,以及在移植平台和移植中心方案高度多样化的领域缺乏对前瞻性研究的财政支持;还需要更好地记录当前的DLI实践。此外,移植中心实践的变化可能为如何确定不同指征(包括预防性、抢先性和治疗性使用)的DLI用法,以及评估DLI在预防或治疗感染和移植后淋巴细胞增殖性疾病方面的附加价值提供有价值的见解。需要考虑的另一个关键方面在于可测量残留病和嵌合在指导预防性DLI治疗中的作用,应考虑到用于测量这些生物学参数的分子方法的高可变性、低标准化和不同敏感性。还迫切需要建立一个需要干预的混合嵌合阈值的标准化定义,包括指定评估的间隔。最后,HLA丢失和HLA突变驱动决策在复发患者中的附加价值也需要进行前瞻性检测。全面的数据收集可能会给移植中心带来巨大的负担,第一步或可优先收集有限的DLI数据集,然后再扩展到更全面的记录。根据国际公认的指导方针执行DLI将有助于实现统一性,并将为解决遗留问题的未来研究奠定基础。
参考文献
Pagliuca S,et al.Donor lymphocyte infusion after allogeneic haematopoietic cell transplantation for haematological malignancies: basic considerations and best practice recommendations from the EBMT.Lancet Haematol . 2024 Jun;11(6):e448-e458. doi: 10.1016/S2352-3026(24)00098-X.


