Theranostics:叶足/诗音/曾琦揭示PRL1和PRL3通过脂质磷酸化调控肿瘤细胞巨胞饮的新功能
时间:2024-05-30 14:00:34 热度:37.1℃ 作者:网络
巨胞饮是一种保守的细胞内吞途径,依赖于肌动蛋白形成巨胞饮小体(macropinosome)摄取细胞外可溶性成分至溶酶体降解。肿瘤细胞的巨胞饮途径也参与肿瘤转移、抗药性产生、免疫逃逸等多种过程的调控,如何靶向抑制巨胞饮也在肿瘤治疗领域引起越来越多的关注。已有的巨胞饮抑制手段主要通过对溶酶体功能的阻滞而实现(如EIPA或高浓度的CQ处理)。然而,溶酶体除了在巨胞饮中的降解功能之外,还参与包括自噬、氨基酸转运等在内的多个重要细胞内膜泡运输途径,故巨胞饮抑制剂常导致广泛的非特异副作用,使其在临床使用受限。探索新的巨胞饮抑制手段,对肿瘤治疗,特别是具有高巨胞饮水平的KRAS突变肿瘤治疗具重大意义。
促肝细胞再生磷酸酶PRL1/PRL3(phosphatases of regenerating liver-1/3)被认为是一种促癌磷酸酶,在胃癌、结肠癌、乳腺癌等多种癌症组织中呈高表达,且与患者不良预后密切相关。目前,已有PRL-3人源化单抗和小分子抑制剂被开发用于癌症治疗研究,进入临床实验阶段。PRL1/PRL3的已知作用底物包括多种与肿瘤细胞发展密切相关的信号通路调控蛋白,比如mTOR、FAK、PI3K等,因而可参与多种促细胞生存和生长的信号通路的激活。而PRL1/PRL3是否与同属于双特异性磷酸酶(dual-specificity phosphatases,DUSP)的PTEN类似,同时也可作为脂质磷酸酶产生下游细胞效应,目前尚无明确报道。

2024年5月27日,浙江省肿瘤医院叶足研究员,浙江大学基础医学院诗音副教授及新加坡分子与细胞生物学研究所的曾琦教授,经过多年探索,联合在Theranostics期刊在线发表了题为PRL1 and PRL3 promote macropinocytosis via its lipid phosphatase activity的研究论文。该研究揭示了PRL1和PRL3通过其脂质磷酸酶活性促进巨胞饮作用,突出了靶向PRL1/3介导的巨胞饮在肿瘤治疗中的潜在治疗意义。
首先,研究者从细胞、生化和结构分析等多层次证明,PRL1和PRL3作为脂质磷酸酶,与磷酸肌醇(PIP)脂质相互作用,在细胞膜上将PI(3,4)P2和PI(3,5)P2去磷酸化而产生PI(3)P,并促进了膜褶的形成、膜起泡和随后的巨胞饮,促进了肿瘤细胞对营养物质的提取、细胞的迁移和侵袭,从而促进了肿瘤的发展。PRL1和PRL3介导的巨胞饮及其下游效应均依赖于其磷酸酶活性。
由于脑组织中含有异常丰富的脂质成分(约为全身脂质的50%),研究者进一步探究了依赖PRL脂质磷酸酶活性的巨胞饮在脑部肿瘤中的作用。通过公共数据库样本分析发现,与正常组织相比,脑胶质瘤PRL1和PRL3的表达增加,且PRL1和PRL3表达较高的患者总生存概率(OS)显著降低。为了揭示PRL1/3介导的巨胞饮在胶质瘤发展过程中的功能,通过进行与癌症患者生存相关的表达分析发现,当PRL1或PRL3表达较低时,巨胞饮相关基因表达水平较高的患者生存时间更长。这些发现均提示PRL1/PRL3和巨胞饮作用可能与胶质瘤患者预后具相关性。在细胞层面,研究者同时验证了PRL1/PRL3所诱导的巨胞饮可显著改善脑胶质瘤细胞在谷氨酰胺缺乏环境中的生长受限。
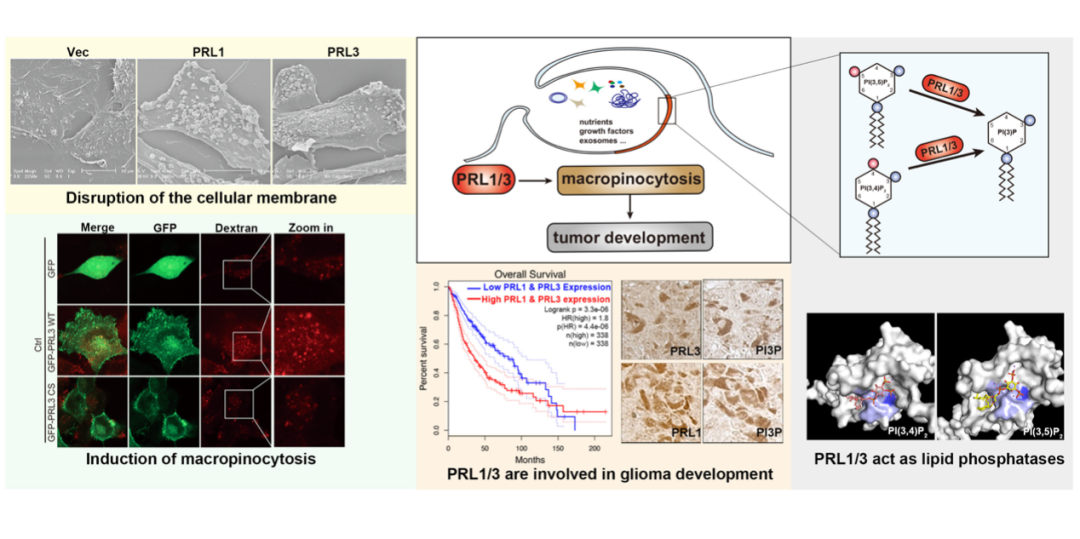
图1. 脂质磷酸酶PRL1/PRL3调控肿瘤细胞巨胞饮的机制和功能
综上,该研究总结了PRL1/3通过其脂质磷酸酶活性调节巨胞饮作用,以及在协调营养感知、吸收和再循环中的生理作用。这一机制可以被面临营养匮乏的微环境的肿瘤细胞利用,突出了靶向PRL1/3介导的巨胞饮在癌症治疗中的潜在治疗意义。
本文第一作者兼共同通讯作者叶足博士为浙江省肿瘤医院研究员,致力于肿瘤发生发展机制及其治疗研究。共同通讯作者诗音博士为浙江大学医学院副教授,长期从事肿瘤代谢及相关治疗策略研究。本研究中,通讯作者曾琦教授最早提出PRL1/PRL3的脂质磷酸酶活性,后续实验由诗音博士和叶足博士共同主导完成。
原文链接:
https://www.thno.org/v14p3423.htm


