Adv Sci:上海交通大学冯海忠/李彦欣等团队合作发现驱动胶质瘤进展的新机制
时间:2024-06-06 18:00:41 热度:37.1℃ 作者:网络
胶质瘤是成人最常见的原发性颅内恶性肿瘤,预后差,治疗效果不佳。遗传学、表观遗传学和蛋白质组学景观以及单细胞RNA谱的集体分析已经确定了多个具有假定预后或预测意义的分子亚群。然而,胶质瘤进展的地方性问题加剧了预后不良。
2024年6月3日,上海交通大学冯海忠、李彦欣及美国西北大学Shi-Yuan Cheng共同通讯在Advanced Science 在线发表题为“TRIM24 Cooperates with Ras Mutation to Drive Glioma Progression through snoRNA Recruitment of PHAX and DNA-PKcs”的研究论文,该研究发现表观遗传调节剂TRIM24被确定为胶质瘤进展的驱动因素,其中TRIM24过表达促进HRasV12间变性星形细胞瘤(AA)进展为上皮样GBM (p-GBM)样肿瘤。TRIM24与HRasV12共转染还可诱导肿瘤蛋白p53基因(TP53)敲低的人神经干细胞(hNSCs)发生Ep-GBM样转化。此外,TRIM24在临床Ep-GBM标本中高表达。通过单细胞RNA测序(scRNA-Seq),发现TRIM24过表达影响肿瘤内异质性和肿瘤微环境。
从机制上讲,HRasV12激活磷酸化的RNA输出适配器(PHAX),上调U3小核核RNA (U3 snoRNAs)以募集Ku依赖性DNA依赖性蛋白激酶催化亚基(DNA-PKcs)。过表达的TRIM24也被PHAX招募到U3 snoRNAs上,从而促进了TRIM24在S767/768残基的DNA-PKcs磷酸化。磷酸化的TRIM24诱导表观基因组和转录因子网络重编程,促进Ep-GBM样转化。用小分子抑制剂NU7441靶向DNA-PKcs,与替莫唑胺协同降低Ep-GBM的致瘤性,延长动物生存期。这些发现为研究Ep-GBM样转化的表观遗传调控提供了新的见解,并为Ep-GBM患者提供了潜在的治疗策略。

胶质瘤的进展受遗传和非遗传因素的相互作用控制。在遗传因素中,MAPK/PI3K信号的失调、EGFR的扩增、TGF-β/NF-κB的激活都被证明与胶质瘤的进展和肿瘤异质性有关。Harvey Rat Sarcoma Viral Oncogene Homolog (HRas)是RAS蛋白家族的一员,在胶质母细胞瘤(GBM)中高度活化。HRasV12突变联合肿瘤蛋白p53基因(TP53)突变或其他基因改变可引起高度异质性脑肿瘤;然而,潜在的机制尚不清楚。
在表观遗传调节因子中,组蛋白读取器是具有“读取”组蛋白修饰并选择性结合特定组蛋白翻译后修饰(PTMs)的结构域的蛋白质。TRIM24是tripartite motif (TRIM)家族的成员,通过组合Plant Homeo-domain (PHD)和Bromo-domain (BRD)结合到组蛋白PTMs (H3K4me0/H3K23ac)的特异性特征。TRIM24是66种癌症类型中鉴定的568种癌症驱动基因之一,已被证明在乳腺癌、前列腺癌和胃癌等几种人类癌症中异常表达和激活。
TRIM24不仅通过激活Sox2表达促进胶质瘤干细胞(GSCs)的自我更新能力和侵袭性生长,而且在EGFR驱动的GBM肿瘤发生中作为STAT3的转录共激活因子发挥作用,因此也被确定为GBM进展的重要因素。此外,TRIM24作为E3泛素连接酶靶向p53降解,是巨噬细胞极化所必需的。TRIM24在小鼠乳腺上皮中的条件性过表达可诱导化脓性乳腺癌的自发发展。然而,TRIM24在胶质瘤进展和异质性中的作用有待进一步研究。
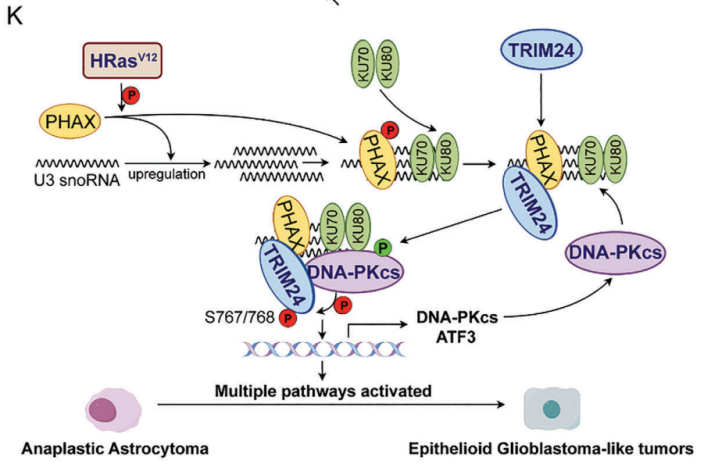
TRIM24驱动胶质瘤异质性的工作模型(图源自Advanced Science )
DNA依赖性蛋白激酶催化亚基(DNA-PKcs)是一种多效丝氨酸-苏氨酸蛋白激酶,在发育和癌症中起关键作用。DNA- pkcs被广泛研究的作用是作为DNA双链断裂(DSB)通过非同源末端连接(NHEJ)修复的关键调节剂。在NHEJ中,Ku70/Ku80异源二聚体结合到DSB末端并招募DNA-PKcs形成DNA-PK全酶。除DNA外,Ku异二聚体还在核糖体生物发生过程中驱动DNA-PKcs在RNA上的组装。DNA-PKcs的异常表达或激活已被确定与多种血液学和实体肿瘤(包括胶质瘤)的不良预后密切相关。NU7441对DNA-PKcs的药理抑制降低了颅内GBM异种移植物肿瘤的生长,并使GBM异种移植物对放疗敏感。因此,DNA-PKcs在胶质瘤中是一种潜在的靶向性致瘤蛋白激酶。
综上所述,该研究提出了表观遗传因子TRIM24在胶质瘤进展和Ep-GBM样转化中的新作用。还揭示了TRIM24通过HRasV12激活的PHAX和Ku依赖性DNA-PKcs与snoRNAs结合的新功能。该研究的细胞和小鼠模型将有助于进一步研究Ep-GBM的病理生理和治疗作用。这项研究的结果可能为更好地理解GBM的异质性和Ep-GBM的进展提供了一步,从而推进临床治疗策略。
原文链接:
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202400023


