Adv Sci:华中科技大学顾劲扬团队开发一种仿生化集成纳米治疗平台,为胆管癌治疗提供了一种安全高效的全新治疗策略
时间:2024-06-08 06:00:29 热度:37.1℃ 作者:网络
光动力疗法(PDT)是一种微创且可控的胆管癌(CCA)局部治疗方法。然而,PDT的疗效受到瘤内免疫抑制性微环境和抗氧化微环境的限制。与此同时,肿瘤发生发展过程中会发生代谢重编程,对维持其自身生长以及塑造免疫抑制性微环境发挥着重要作用。因此,PDT与代谢重编程治疗相结合可能是治疗胆管癌的有效策略。将光敏剂以及代谢重编程药物靶向递送到肿瘤组织并实现药物的精准释放,降低脱靶效应引起的疗效不佳及副反应,是目前亟需攻克的难题。
2024年5月,华中科技大学同济医学院附属协和医院肝脏移植中心顾劲扬教授团队在高水平综合期刊Advanced Science发表了题为“Necroptosis-Mediated Synergistic Photodynamic and Glutamine-Metabolic Therapy Enabled by a Biomimetic Targeting Nanosystem for Cholangiocarcinoma”的研究论文,该研究开发了一种仿生化集成纳米治疗平台—R-CM@MSN@BC,为胆管癌治疗提供了一种安全高效的全新治疗策略。
R-CM@MSN@BC能够有效改善CCA抗氧化微环境, 促使氧化损伤水平升高,随后诱导CCA细胞坏死性凋亡。同时,R-CM@MSN@BC可以通过谷氨酰胺代谢重编程重塑CCA免疫抑制性微环境,降低M2型巨噬细胞、CX3CR1+巨噬细胞等免疫抑制性细胞的浸润水平并促进细胞毒性T淋巴细胞(CTL)的表现转化,提高机体免疫应答水平。
另外,2024年5月14日,华中科技大学同济医学院附属协和医院肝脏移植中心顾劲扬教授团队在Journal Of Clinical Investigation(IF:15.9)在线发表题为“ZBP1-mediated apoptosis and inflammation exacerbate steatotic liver ischemia-reperfusion injury”的研究,该研究采用多种基因敲除小鼠模型,揭示了Z-DNA结合蛋白1(ZBP1)表达及活化是脂肪变性供肝IRI中细胞凋亡及炎症反应过度激活的关键机制。该研究发现敲除caspase-8仅抑制脂肪变性供肝IRI中的凋亡但不影响炎症,而阻断RIPK1激酶可通过同时缓解凋亡和炎症显著减轻IRI。此外,在脂肪变性供肝IRI中,RIPK1激活是由ZBP1而非经典的TNFα通路诱导的。在机制上,过量棕榈酸激活的JNK通路在脂肪变性供肝中诱导ZBP1表达水平升高。在IRI中,过量活性氧(ROS)通过Z型核酸(Z-NA)非依赖性机制促进ZBP1聚集,进而ZBP1寡聚体通过RHIM结构域招募并激活RIPK1,最终通过凋亡及炎症加重肝损伤。因此,该研究建立了全新的ZBP1-RIPK1互作理论模型,并揭示了其在脂肪变性供肝IRI中的关键作用,为提升脂肪变性供肝移植疗效奠定了重要基础。

光动力疗法(PDT)是一种有效的肿瘤治疗方式,在恶性肿瘤(如CCA)的治疗中已有明确的治疗效果。除直接对肿瘤细胞产生细胞毒性外,PDT还表现出免疫调节特性,其诱导免疫原性细胞死亡(ICD),促进肿瘤抗原的释放和细胞毒性T淋巴细胞(CTL)的募集,从而增强抗肿瘤免疫微环境。然而,光动力疗法的应用仍然存在一些问题。首先,肿瘤组织缺氧和细胞内固有的抗氧化系统往限制活性氧(ROS)的生成或增强ROS的清除效果,其杀伤效率仍无法满足需求。
CCA是消化系统中恶性程度最高,预后最差的肿瘤之一,CCA的“荒漠型”免疫微环境是制约其术后免疫治疗的关键因素。由于代谢稳态的改变,CCA细胞对谷氨酰胺的需求远高于正常细胞,被称作“谷氨酰胺成瘾性”。谷氨酰胺是人体中含量最丰富的非必需氨基酸,它参与细胞生长和增殖、其他非必需氨基酸的合成、染色质的修饰,作为氮源维持核苷酸的合成以及作为碳源维持三羧酸(TCA)循环的正常运转。其次,谷氨酰胺代谢通过提供还原型辅酶II (NADPH)和谷胱甘肽(GSH)维持氧化还原平衡,对肿瘤细胞的抗氧化防御具有重要作用。因此,谷氨酰胺代谢阻断可以协同增强依赖氧化损伤的PDT疗法。为了解决胆管癌的治疗困境,顾劲扬教授团队开发了一种仿生化多功能可控释药纳米系统——R-CM@MSN@BC。该纳米系统将谷氨酰胺酶抑制剂BPTES以及光敏剂Ce6负载在具有活性氧响应性的双硒键桥接介孔硅中,并在其表面包裹了一层修饰有RGD肽的红细胞膜,在提高纳米系统生物相容性的同时增强其靶向CCA细胞的性能。
实验结果证实,R-CM@MSN@BC 在治疗干预过程中产生了大量 ROS,诱发CCA细胞坏死性凋亡,增强了 CCA 的免疫原性。CyTOF实验数据表明,R-CM@MSN@BC 介导的谷氨酰胺代谢抑制减少了免疫抑制性巨噬细胞(尤其是 M2 型和 CX3CR1+ 巨噬细胞)以及耗竭型T细胞浸润,并提高了 M1 型巨噬细胞和CTL的浸润水平,逆转了CCA免疫抑制性微环境。当与免疫检查点阻断疗法联合使用时,R-CM@MSN@BC 能显著抑制原发性和远隔肿瘤的生长。
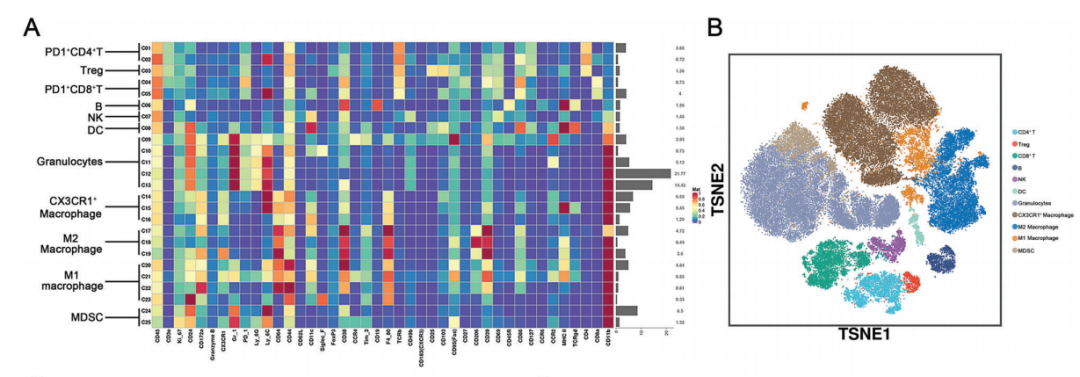
图1.Cytof实验解析R-CM@MSN@BC治疗对胆管癌免疫微环境的重塑作用
R-CM@MSN@BC可实现以下功能:(1)特异性靶向CCA细胞,在光照后释放出谷氨酰胺代谢抑制剂BPTES以及光敏剂Ce6,在其协同作用下诱导CCA细胞坏死性凋亡;(2)通过BPTES使CCA细胞谷氨酰胺代谢重编程,抑制M2型巨噬细胞以及CX3CR1+巨噬细胞的浸润,进而重塑CCA免疫微环境;(3)与PD-L1单抗联用增强免疫治疗对CCA的疗效。
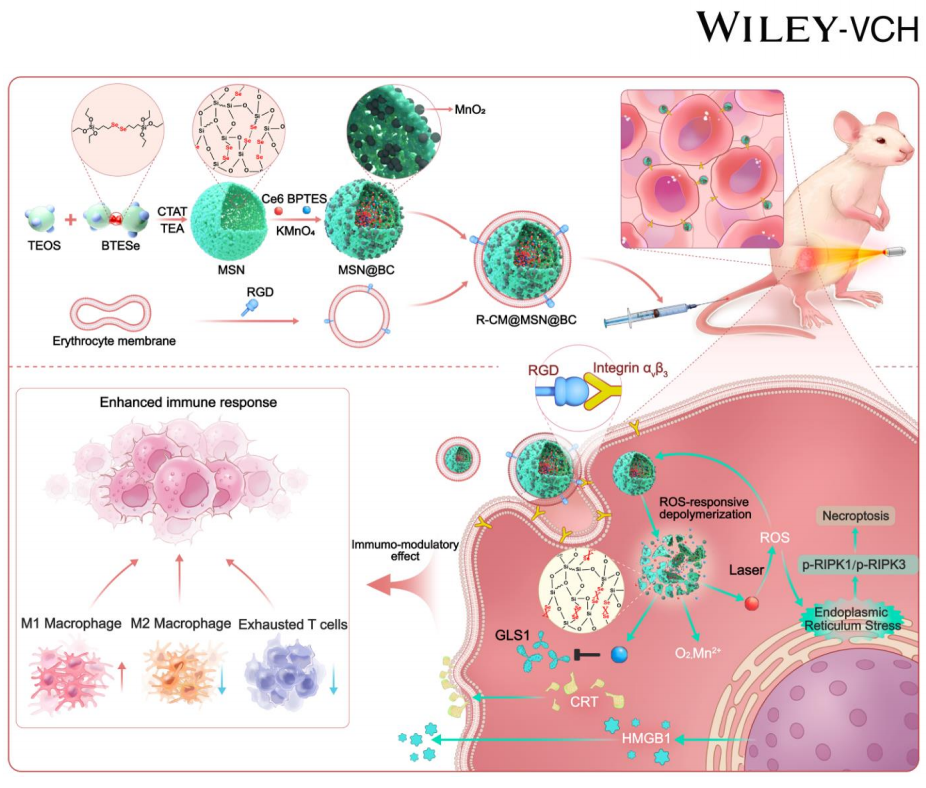
图2.本研究机制图
顾劲扬教授课题组长期致力于代谢功能障碍相关脂肪性肝病以及肝脏缺血再灌注损伤的机制及其转化研究,近年来获得包括国家自然科学基金重点项目、国家自然科学基金面上/青年项目、省自然科学基金创新群体重点项目在内的20余项课题资助,并在J Clin Invest、Nat Commun (2篇)、Gastroenterology 、Hepatology (4篇) 、Cell Rep、J Hematol Oncol 、Cell Mol Immunol 、Adv Sci、Genome Med 等国际Top期刊发表SCI论文60余篇,其中IF>10分论著14篇。课题组学生主持多项校级基金,并获得三好学生、校级优秀毕业生等多项荣誉。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202309203


