Adv Sci:北京大学黄卓等团队合作抑制癫痫易感性的潜在新策略
时间:2024-06-21 16:01:16 热度:37.1℃ 作者:网络
内在可塑性是神经元改变其内在特性的一个基本过程,在形成神经元的输入输出功能中起着至关重要的作用,并与各种神经和精神疾病有关。尽管其重要性,内在可塑性的潜在分子机制仍然知之甚少。
2024年6月14日,北京大学黄卓及重庆医科大学田鑫共同通讯在Advanced Science 在线发表题为“A Novel Ubiquitin Ligase Adaptor PTPRN Suppresses Seizure Susceptibility through Endocytosis of NaV1.2 Sodium Channels”的研究论文,该研究将一种新的泛素连接酶适配器,蛋白酪氨酸磷酸酶受体N (PTPRN),被确定为颞叶癫痫背景下的内在神经元兴奋性的调节剂。PTPRN将NEDD4 Like E3泛素蛋白连接酶(NEDD4L)募集到NaV1.2钠通道,促进NEDD4L介导的泛素化和NaV1.2的内吞作用。
敲除海马颗粒细胞中的PTPRN导致NaV1.2介导的钠电流增强和更高的内在兴奋性,导致转基因小鼠癫痫易感性增加。相反,腺相关病毒介导的PTPRN在齿状回区域的传递降低了固有的兴奋性,降低了癫痫的易感性。此外,本研究结果表明,PTPRN对电压门控钠通道具有选择性调制作用。综上所述,PTPRN在调节内在兴奋性和癫痫易感性方面发挥着重要作用,提示了精确调节NaV1.2通道功能的潜在策略。

癫痫是一种以大脑神经元活动异常和过度为特征的神经系统疾病,具有内在的可塑性机制在癫痫活动的产生和传播以及癫痫发生的抑制中起着至关重要的作用。离子通道表达和分布的改变有助于癫痫的发生和维持,而代偿机制有助于限制癫痫发作的扩散和防止癫痫的进展。这些内在可塑性和癫痫之间复杂的相互作用强调了更好地理解癫痫发生机制的必要性。尽管在理解离子通道的转录调节方面已经取得了相当大的进展,这使得神经元能够长期修饰,但在内在可塑性和癫痫发生的背景下,离子通道运输的机制仍然知之甚少,这突出了进一步研究的必要性。
由SCN2A编码的电压门控钠通道异构体1.2 (NaV1.2)是中枢神经系统神经元中表达的一种主要钠通道。NaV1.2在神经元动作电位的启动和传播中起着至关重要的作用,从而决定了神经元的兴奋性。SCN2A突变导致的NaV1.2通道活性功能障碍与一系列神经系统疾病有关,包括婴儿癫痫性脑病、良性(家族性)婴儿癫痫发作和自闭症谱系障碍/智力残疾。具体来说,SCN2A的功能获得性(GOF)突变与癫痫的发生密切相关,因为它们导致NaV1.2通道活性增强,导致神经元处于过度兴奋状态,增加癫痫发作的频率。因此,研究NaV1.2通道功能的调节是一个具有潜在治疗癫痫意义的关键研究领域。
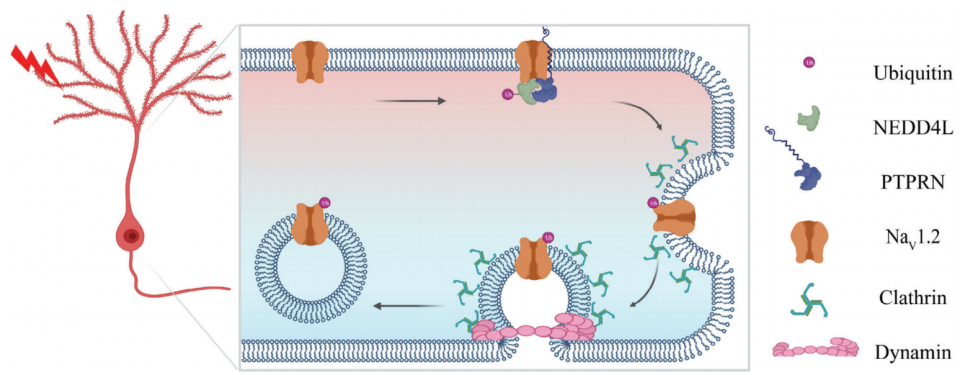
PTPRN调控NaV1.2通道与神经元内在可塑性的机制(图源自Advanced Science )
该研究采用加权基因共表达网络分析(WGCNA),确定蛋白酪氨酸磷酸酶受体N型(PTPRN)在颞叶癫痫(TLE)患者和TLE啮齿动物模型中作为内在神经元兴奋性的调节因子。神经元活性的增强导致PTPRN的表达增加,通过将NEDD4样E3泛素蛋白连接酶(NEDD4L)募集到这些泛素化和内吞通道,从而选择性地下调NaV1.2功能,从而补偿异常的神经元兴奋性和癫痫易感性。该研究结果揭示了NaV1.2的独特调控机制,并在神经元活动和离子通道运输之间建立了分子联系。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202400560


