ALK重排NSCLC携带KRAS G12C共突变,或与ALK TKI原发耐药和迅速进展有关
时间:2024-06-18 19:03:38 热度:37.1℃ 作者:网络
在过去的几年里,由于分子诊断技术的进步和靶向治疗的引入,非小细胞肺癌(NSCLC)治疗发生了革命性变化,靶向治疗成为携带可干预变异患者的标准治疗方法。大多数情况下,基因突变是互斥的,但存在一些同时发生多个可干预变异的病例,尤其是在下一代测序(NGS)引入和应用之后。关于这些特殊病例的治疗数据很少。KRAS G12C共突变似乎是ALK重排NSCLC患者的不良预后因素。本文报告了两例晚期肺腺癌女性患者,携带ALK重排和KRAS G12C突变。在这两个案例,PD-L1状态都很高(>50%)。虽然两人都接受了阿来替尼作为ALK抑制剂,但病变迅速进展。患者仅通过化疗获益,而抗PD-1/PD-L1抑制剂似乎无效。精确的诊断技术可以检测同时发生的驱动基因改变;因此,肿瘤学家应考虑NSCLC患者中这些罕见的双重突变。仍有必要进行进一步的前瞻性研究,以调查同时发生的驱动基因改变的作用和相关的治疗范式。
背 景
在过去的几年中,精准医疗极大地改变了癌症治疗模式,尤其是非小细胞肺癌(NSCLC)的治疗模式。大量证据表明,NSCLC不是一种单一疾病,而是根据致癌突变包括多种不同的疾病。这场治疗革命之所以成为可能,要归功于诊断分子技术相关知识的不断增加,以及针对分子变异的新药开发。目前,大多数可干预的变异都采用特定的酪氨酸激酶抑制剂(TKI)治疗,并具有非凡的反应和生存结果。
为了帮助临床医生选择,NSCLC变异已根据临床证据水平和对患者管理的影响进行了分类(例如ESCAT、OncoKB)。因此,必须对与已获批准的靶向疗法相匹配的NSCLC致癌驱动因素进行检测。其中,ALK重排占NSCLC人群的 3–5%。在多项临床试验中,ALK抑制剂可改善ALK重排NSCLC患者的生存结果。第二代ALK TKI阿来替尼在III期试验中显示,与克唑替尼相比,其总体缓解率(ORR)为 83%、颅内缓解率为 81%,5 年总生存率(OS)为 62.5%。其它ALK TKI在ALK重排NSCLC人群一线治疗中表现出相似(布格替尼)甚至更优的疗效(洛拉替尼)。
通过下一代测序(NGS)进行基因检测已成为晚期NSCLC腺癌的标准治疗方法。使用NGS大panel可以在诊断时识别出更多共突变和双驱动突变,而这些突变既往被认为是互斥的。此外,ctDNA液体活检也正在成为诊断基因变异的替代和补充工具。
据研究人员所知,目前尚无关于这些共突变病例最佳治疗的数据。本文报告了两例携带ALK重排、KRAS G12C突变和PD-L1高水平的NSCLC患者。本报告旨在强调一个完整基因检测panel的重要性,并建议未来在类似的临床病例中采用相似的策略。本病例报告遵循CARE指南。
病例1
患者女,68 岁,有吸烟史,无合并症。因持续咳嗽和发烧于 2020 年 12 月就诊。抗生素治疗后,患者继续出现先前提到的症状,随后的CT扫描显示右上叶实性肿块、纵隔和肺门淋巴结肿大。组织活检肺门淋巴结显示肺腺癌。免疫组织化学显示PD-L1肿瘤比例评分(TPS)>50%,无ALK和ROS1重排。RT-PCR未检测到EGFR和BRAF突变,但显示KRAS G12C突变。多学科肿瘤委员会认为可能是临床分期IIIA期可切除的局部晚期NSCLC。
2021 年 2 月,患者开始接受顺铂-培美曲塞新辅助化疗,3 个周期后获得部分缓解。2021 年 5 月,患者接受了右肺切除术。组织学诊断显示腺癌,分化不良,有淋巴管侵犯和内脏胸膜浸润(根据AJCC 第 8 版TNM分期:ypT4ypN2)。2021 年 8 月,CT扫描显示单个肝病灶疾病进展(PD),随后经MR证实(7 mm)。根据PD-L1高表达状态,患者接受了帕博利珠单抗一线治疗。
2021 年 10 月,患者体能状态迅速恶化,体重下降,腹痛。CT扫描显示肺部(新发双侧结节)和肝脏疾病进展(40mm vs 7mm),建议使用多西他赛进行二线治疗。同时进行了肝活检以寻找其它可干预变异。有趣的是,IHC显示存在ALK重排,并得到了FISH的证实。除了之前检测到的KRAS G12C突变外,NGS没有发现其它可干预变异。2021 年 12 月,CT扫描显示影像学部分缓解(PR)。因此,化疗继续进行,体能状态(PS)也有所改善。然而,2022 年 3 月,病情出现进展。事实上,TC扫描显示肝病进展(62mm vs 38mm),脑MRI显示右皮质下额叶区域出现新的转移。
2022 年 4 月,根据新的活检结果显示ALK重排,提出使用阿来替尼进行三线抗ALK治疗。不料,2022 年 7 月,患者出现神经症状,被送入急诊室。经过充分的类固醇和利尿剂治疗后,患者出院。CT扫描显示肝转移和额叶病变,伴有病灶周围水肿和脑中线偏移。几周后开始姑息性脑立体定向放疗。鉴于患者全身状况迅速恶化,启动了最佳支持治疗(BSC),并开始使用抗KRAS G12C抑制剂索托雷塞进行四线治疗。患者体力状态最初有所改善,但最终于 2022 年 10 月死亡(图1)。
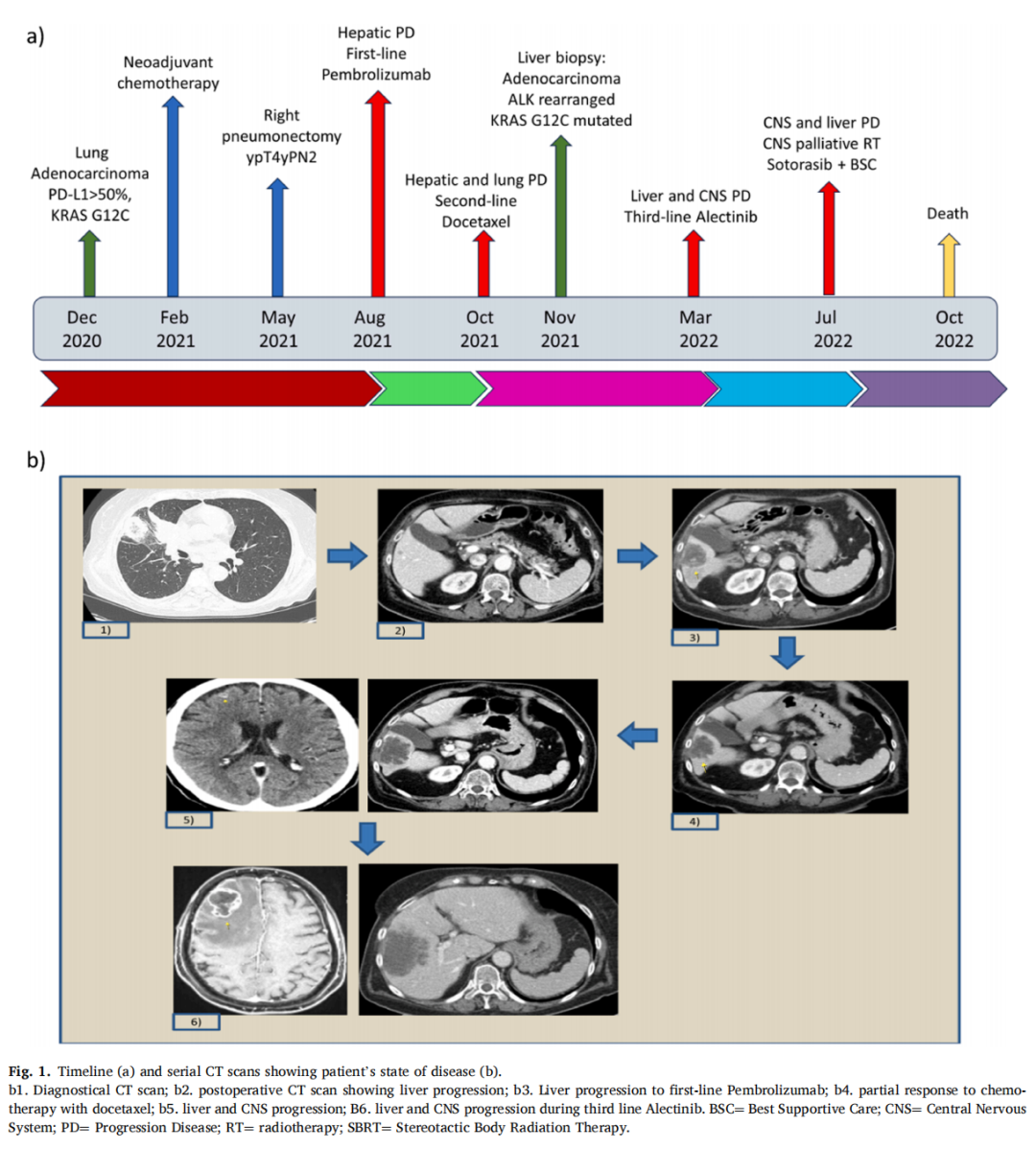
▲图1 病例1的治疗时间线和CT影像
病例2
患者女,45 岁,既往有吸烟史(20 包年),无合并症,因咳嗽和咯血于 2022 年 10 月就诊。胸部CT扫描显示右上叶尖段有一个 60 mm的肿块,伴有静脉血栓形成、淋巴管炎扩散以及肺门和纵隔淋巴结增大。PET扫描证实了前面提到的病变,脑部MRI在左侧皮质下顶叶颞区(6 mm)和右侧中央后回发现了两个脑转移瘤,伴有病变周围水肿。隆突前淋巴结活检显示肺腺癌。IHC显示肿瘤细胞PD-L1高表达(TPS 70%),ALK和ROS1没有重排。RT-PCR显示KRAS G12C突变。RNA NGS检测到ALK重排。
2022 年 12 月,患者接受了两处脑部病变的立体定向放疗(SBRT)。随后,患者开始使用阿来替尼进行一线治疗。不幸的是,在接受三个月的ALK抑制剂治疗后,患者的呼吸道和神经系统症状出现恶化。患者住院治疗,CT扫描显示肺部和脑部疾病进展,并伴有肺栓塞。2023 年 3 月,研究人员决定开始使用卡铂-培美曲塞进行二线治疗,因为需要迅速起效。经过 4 个周期的治疗后,患者报告呼吸困难有所改善,CT扫描证实肺和脑转移灶部分缓解。因此患者继续使用 3 个周期的培美曲塞。2023 年 8 月,患者出现呼吸困难、乏力,临床怀疑有纵隔综合征(套膜水肿、浅表静脉网和颈静脉肿胀)。因此,在急诊科进行CT扫描,确诊为PD。患者接受了类固醇和姑息性放疗,症状迅速缓解。2023 年 9 月,患者接受了帕博利珠单抗单药治疗,2023 年 12 月脑部出现进展。考虑到寡进展,进行了脑部SBRT,然后继续使用帕博利珠单抗。如今,患者仍然活着,如果出现系统性进展,将进行新的活检(图2)。
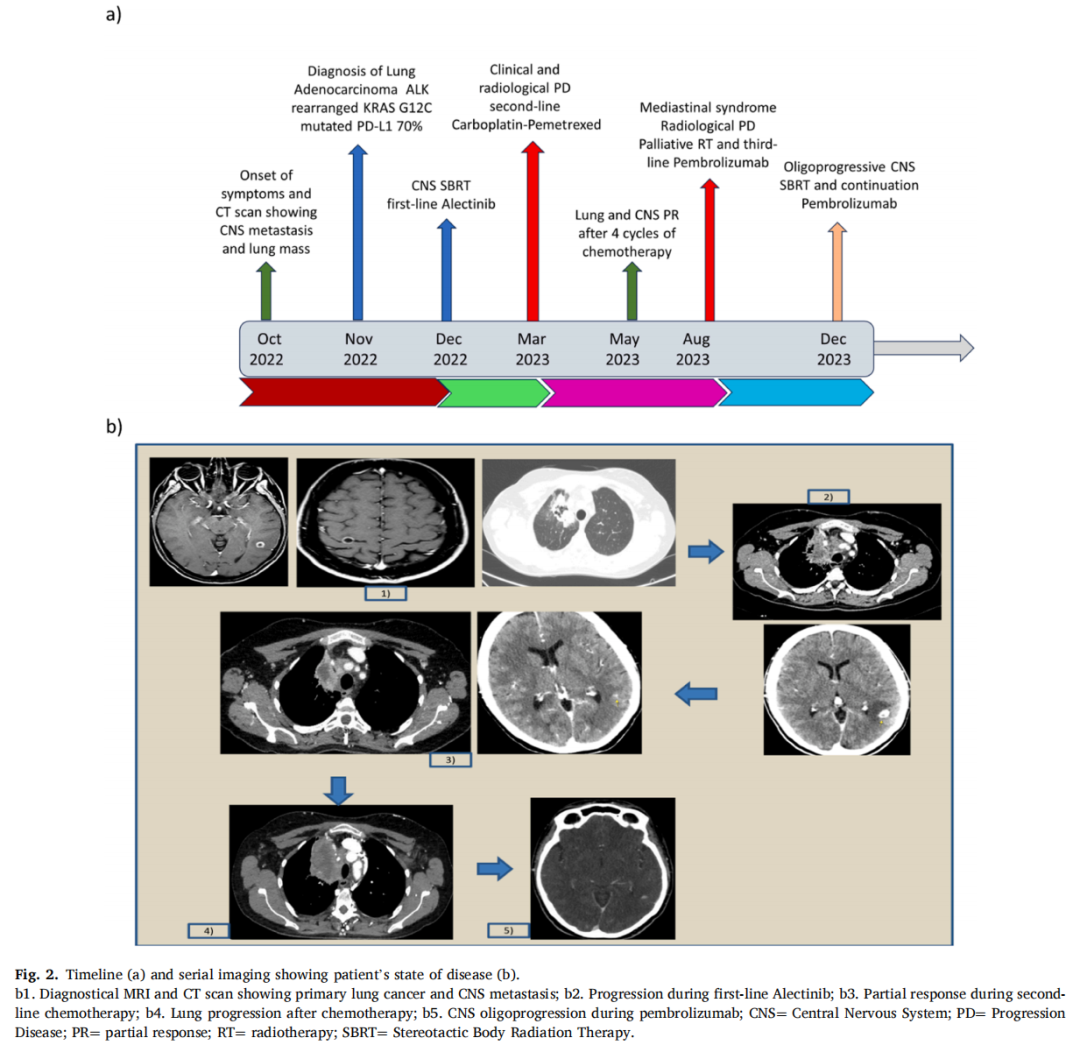
▲图2 病例2的治疗时间线和CT影像
讨 论
超过 80% 的ALK重排NSCLC对阿来替尼一线治疗有反应,中位无进展生存期(PFS)为 34 个月。然而,关于原发性耐药的数据很少,而且对ALK重排NSCLC中同时存在的可干预变异(例如KRAS G12C)的研究很少。本文报告了两例ALK重排的NSCLC患者,其中一例在再次活检时通过IHC检测发现,另一例在诊断时通过RNA NGS检测发现,其特点是病情进展迅速且对阿来替尼原发耐药。两例患者在诊断时均通过RT-PCR检测到KRAS G12C突变。先前的病例系列报道,同时发生ALK重排和KRAS G12C突变的NSCLC与预后较差相关。
KRAS是西方NSCLC人群中最常见的致癌突变基因(约 30%)。其中约 40% 的患者发生KRAS G12C突变(G>T碱基颠换突变,导致甘氨酸被半胱氨酸取代),目前有两种KRAS G12C抑制剂(索托雷塞和阿达格拉西布),该突变可作为预后和预测生物标志物。两名患者均为女性,且有吸烟史。ALK重排(年轻人、从不吸烟)和KRAS突变(大量吸烟)人群在诊断时的临床特征通常往往不同。
在这两个病例中,优先选用ALK TKI作为一线治疗,因为与KRAS G12C TKI相比,ALK TKI证据水平更高。这两名患者对阿来替尼抗ALK治疗均无反应,并且在进展时未应用其它抗ALK治疗,因为预计反应不佳。洛拉替尼是第三代ALK TKI,在接受其它ALK TKI且出现中枢神经系统(CNS)进展的患者和一线治疗中产生了良好的反应。因此,即使在ALK重排人群中,也需要临床(中枢神经系统转移、BMI、营养状况、合并症)和分子预测生物标志物(共突变、ALK融合变异)来指导医生进行治疗选择。两名患者PD-L1表达均较高(病例1的TPS评分:90%;病例2的TPS评分:70%)。根据监管机构的限制,唯一可用的免疫疗法是抗PD-1抑制剂,用于一线和二线单药治疗。
关于NSCLC人群中ALK重排和PD-L1表达之间的关系存在争议。许多研究表明, ALK重排NSCLC人群中PD-L1水平可能更高,因为可能是由EML4–ALK酪氨酸激酶诱导的。一项回顾性研究纳入了 193 名接受第二代ALK TKI治疗的ALK重排患者,结果表明PD-L1高表达与较差的预后相关(mPFS:PD-L1 0% 为 27.43 个月,PD-L1 1–49% 为 30.6 个月,PD-L1≥ 50% 为 9.5 个月,p = 0.001)。另一项病例系列研究纳入了 128 名接受克唑替尼治疗的患者,也获得了类似的结果。与PD-L1低表达相比,基线PD-L1高表达(TPS ≥50%)与较短的mPFS(6 vs 11 个月,p=0.011)和OS(17 vs 53 个月,p = 0.023)相关。
一项临床前研究显示,ALK抑制剂耐药细胞中PD-L1表达高于ALK抑制剂初治细胞,表明免疫相关基因的表达与ALK抑制剂耐药有关。与之相反的是,一项包括 54 名符合条件患者的回顾性研究表明,PD-L1表达并不影响接受阿来替尼一线治疗的患者的OS。
很少有前瞻性试验研究抗PD-1抑制剂在ALK重排NSCLC中的作用。与化疗相比,卡铂-紫杉醇-贝伐珠单抗-阿替利珠单抗联合疗法是唯一在III期试验中证明在EGFR和ALK突变患者中ORR有所改善且PFS更长的治疗方法。本文采用了帕博利珠单抗作为单药疗法,但在这种特定情况下,应该选择化疗-免疫疗法联合治疗以限制原发性进展的风险。事实上,在IMMUNOTARGET研究中,在ALK重排人群中,ICI单药疗法并未出现反应(ORR 0%)且PFS较短(3.1 个月)。
化疗是本文两名患者的唯一有效治疗方法。第一例患者接受卡铂-培美曲塞新辅助治疗后出现反应,接受二线多西他赛治疗后无进展生存期为 6 个月。第二例患者接受铂类双药化疗后出现反应,且临床状态良好。
结 论
研究人员的经验表明,同时发生ALK和KRAS G12C变异的患者疾病负荷可能较重,需要迅速采取行动来控制症状。研究人员建议对靶向治疗无反应的患者应重新检测,以寻找任何可靶或最终脱靶突变。因此,在本文两个病例中,阿来替尼治疗进展后再次活检将有助于确认ALK重排,并应用第三代ALK TKI。不幸的是,疾病进展不允许研究人员进行这一操作。在临床实践中,在诊断疾病进展患者时引入ctDNA,对NSCLC进行液体活检可作为一种补充方法,可以检测已知或未知的分子通路,以微创方式防止对基因检测结果的误解。
总之,本文旨在证明应克服驱动NSCLC致癌基因的“互斥”概念。应始终进行包括至少所有推荐的预测性生物标记物在内的NGS检测。即使在本文案例中仅检测到其中一种变异,NGS测序也可以识别其它可能与预后相关的驱动因素。仍需要进一步的前瞻性研究来探究驱动基因共突变和相关治疗的作用。
临床实践要点
本文报告了两例携带ALK重排和KRAS G12C突变的晚期肺腺癌的女性病例。两例患者的PD-L1表达评分都很高。尽管两人均接受了ALK TKI阿来替尼作为一线治疗,但疾病进展迅速。患者仅从化疗中获益,而抗PD-1/PD-L1抑制剂似乎无效。大多数情况下,基因突变是相互排斥的,但存在同时发生多个可干预变异的病例,尤其是在下一代测序(NGS)引入和应用之后。精准诊疗技术可以增加对驱动变异的检测,关于这些特定病例的预后和治疗的数据很少。
参考文献:
M Siringo, F Larocca, A Spagnuolo, G Gentile, M Anile, D Diso, D Santini, A Gelibter.Co-Occurrence of ALK rearrangement and KRAS G12C mutation in NSCLC: Report of two cases.https://doi.org/10.1016/j.cpccr.2024.100291



