SMARCA4(BRG1)缺失性未分化胃癌有什么分子特征?
时间:2024-07-08 15:00:36 热度:37.1℃ 作者:网络
未分化胃癌的特征是间变性细胞缺乏明显的细胞学或结构分化,为诊断和治疗方面带来了挑战性。最近的研究表明,这种癌症与SWI/SNF复合物的缺失有关,特别是SMARCA4等亚基的突变。本文报告了 6 例SMARCA4缺失性未分化胃癌病例,并附有分子学发现,突出了这种恶性肿瘤的罕见性和诊断缺陷。这些病例主要发生在 50 岁以上的男性中,症状不典型,通常在晚期才得到确诊。从组织学上看,肿瘤呈片状生长模式,上皮标志物减少或缺失,BRG-1表达缺失,分子检测证实了SMARCA4基因突变。这些患者对常规化疗的反应不佳,强调了完全手术切除和开发替代治疗方式的重要性。
背 景
未分化胃癌是一种罕见的上皮恶性肿瘤,其特征是间变性细胞缺乏明显的细胞学或结构分化。上皮标记物的缺失经常为诊断带来挑战,可能导致与其它恶性肿瘤混淆。近期研究描述了未分化的胃癌呈横纹肌样形态,以其侵袭性的临床病程而闻名。此外,研究还强调了这个亚群中的SWI/SNF复合物的缺失。SWI/SNF复合物在染色质重塑和DNA修复中起着至关重要的作用,其亚基的突变常见于各种人类癌症,包括胃肠道(GI)未分化癌。其中特别有趣的是SMARCA4,负责编码BRG-1——这是SWI/SNF复合物中必需的ATP酶亚基,它的变异与不同器官系统中分化不良的恶性肿瘤有关。本文报告了 6 例SMARCA4缺失性未分化胃癌,阐明了这 6 例患者以及既往文献报道患者的临床病理特征。
病 例
本文回顾性收集了 6 例 2022 年 4 月至 2024 年 1 月在韩国峨山医疗中心诊断为SMARCA4缺失性未分化胃癌病例。SMARCA4缺失性未分化胃癌的诊断是通过IHC染色中没有BRG-1表达,或通过靶向下一代测序(NGS)检测出SMARCA4突变确认的。表1总结了这 6 例患者的主要临床病理特征。
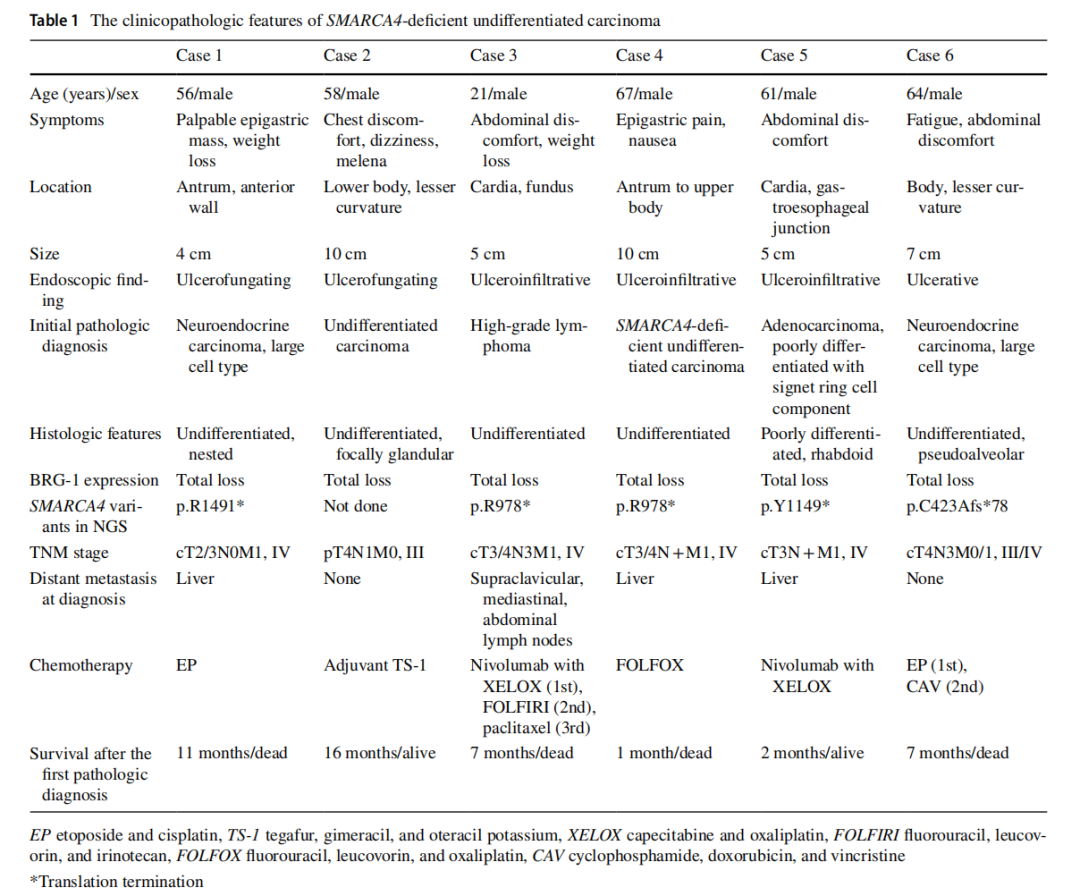
▲表1 SMARCA4缺失性未分化癌的临床病理特征
所有患者均为男性,中位年龄为 55 岁(范围:21-67岁)。除了病例5和病例6分别有肝细胞癌和肺癌病史,其他患者无任何个人或家族的恶性肿瘤病史。血清肿瘤标志物,包括CA19-9、CA72-4、CA125、CEA、AFP,均在正常范围内。内镜检查发现所有病例均有一个较大的溃疡性肿块(平均大小为 6.8 cm)(图1a)。最初的CT和PET-CT检查发现多个肝肿块(病例1、4和5)和淋巴结肿大(图1b)。胃内窥镜活检显示肿瘤通常呈片状生长,伴有坏死,部分病例还呈嵌套状和假肺泡状排列(图2)。肿瘤细胞具有大的泡状核,并有明显的大核仁。在所有病例中均未观察到分化型腺癌或癌前胃发育不良成分。IHC检测了细胞角蛋白AE1/AE3、上皮膜抗原(EMA)、突触素、嗜铬粒蛋白、嗜铬粒蛋白、胰岛素相关蛋白1、胰岛素相关蛋白1、CD56、RB1、AFP、p63、p40、白细胞共同抗原(LCA)、CD3、CD20、CD30、S100、SOX- 10、HMB45、NUT、CD117、ERG、pan-TRK、INI-1、BRG-1。所有病例均显示BRG-1表达缺失,细胞角蛋白AE1/AE3或EMA呈阴性或局灶性弱阳性(图3a、c、d)。病例1、2、5、6中突触素呈局灶性弱阳性(图3b),其它标记物均为阴性。ErbB2(HER2)均为阴性,所有病例中MMR蛋白均为正常。PD-L1(克隆号28-8)在病例4和病例5中呈阳性,综合阳性评分(CPS)分别为 5% 和 40%。NGS在 5 个病例中发现了SMARCA4的截断突变(表2)。最初,根据首次病理结果,只有病例4被诊断为SMARCA4缺失性未分化胃癌。而病例1和病例6则因突触素局灶性弱阳性而被诊断为神经内分泌癌,随后通过NGS确认了SMARCA4突变。在病例2中,通过对活检标本进行IHC染色,发现BRG-1表达缺失。病例3最初在当地一家医院因LCA阳性而被诊断为高级别淋巴瘤;然而,随后IHC检测显示淋巴标志物为阴性,并最终发现BRG-1表达缺失。
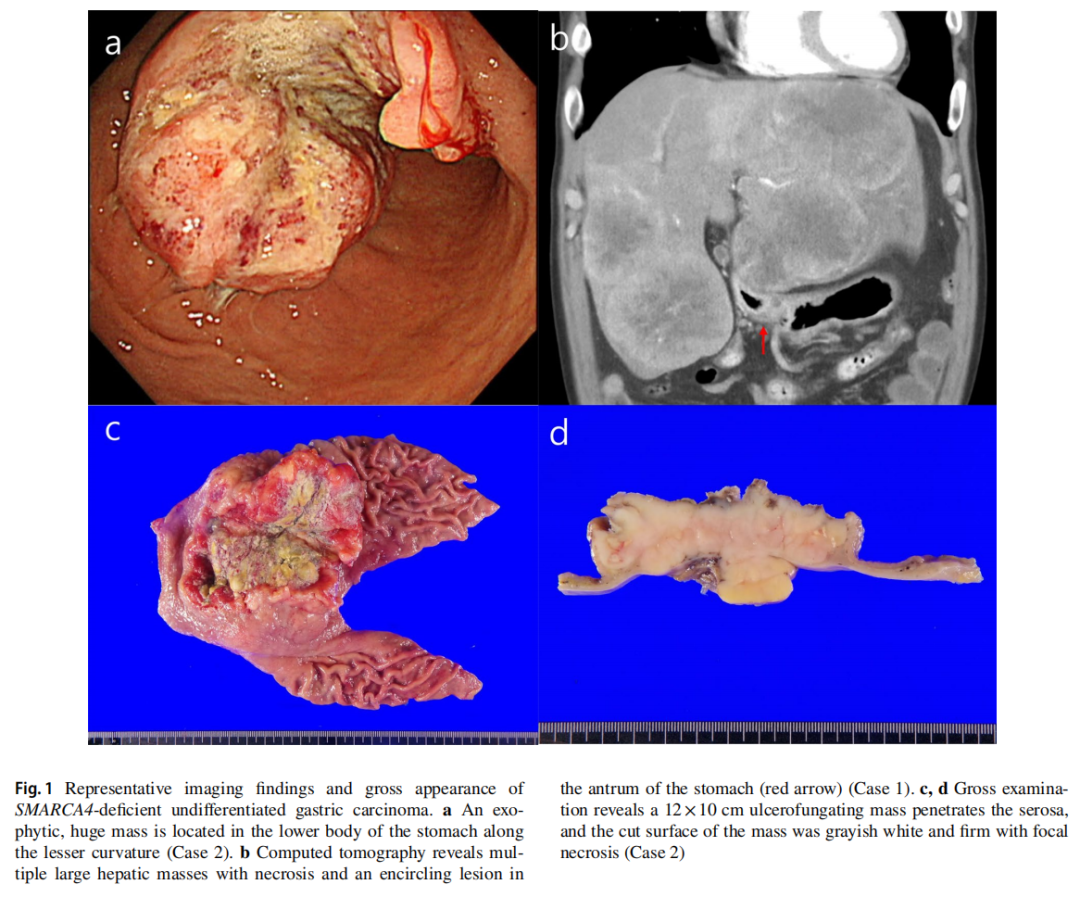
▲图1 SMARCA4缺失性未分化胃癌的组织学和大体外观
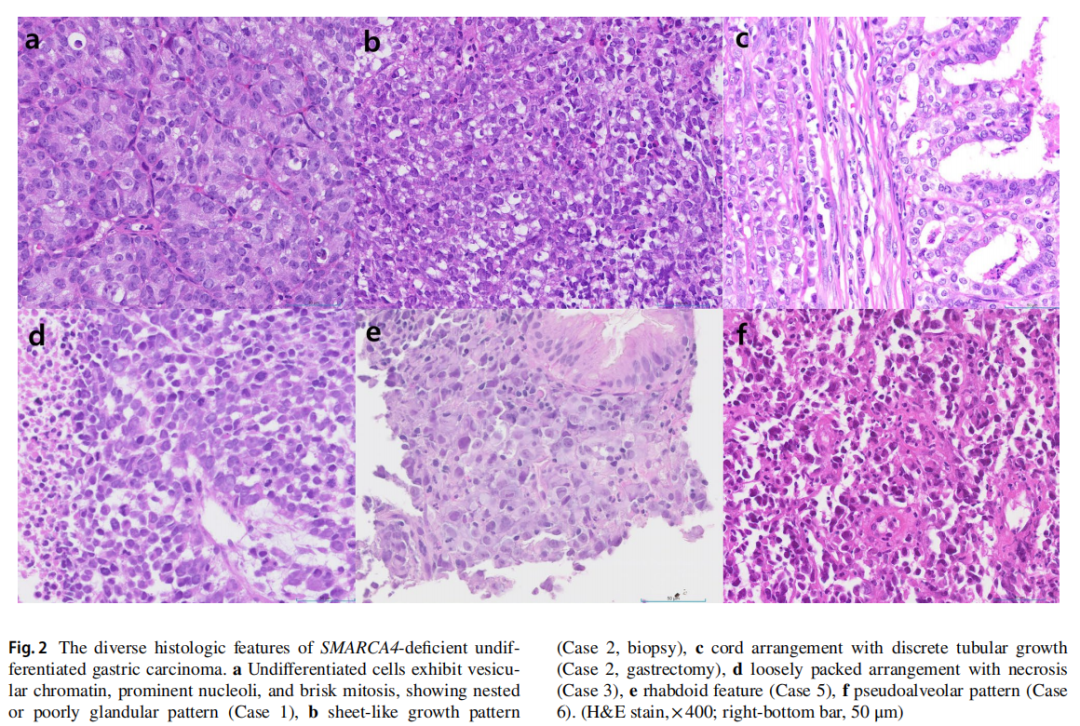
▲图2 SMARCA4缺失性未分化胃癌的病理学特征
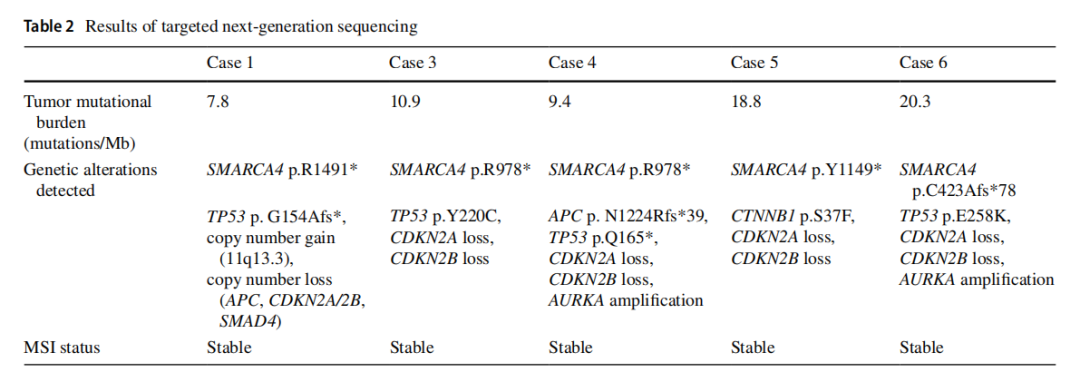
▲表2 NGS测序结果
只有1例患者处于可切除的临床分期,并接受了远端胃切除术,实现完全切除(图1c,d)。值得注意的是,研究人员在手术样本发现了一种中度分化的腺癌成分,只占整体的 5% 不到(图2c),呈BRG-1阴性和细胞角蛋白阳性(图3e,f)。未发现淋巴血管侵犯及淋巴结转移。无法切除的临床III或IV期患者接受了化疗。2 例诊断为神经内分泌癌的患者接受了EP(依托泊苷和顺铂)方案。其余 3 例患者最初接受氟尿嘧啶、亚叶酸、奥沙利铂(FOLFOX)或卡培他滨和奥沙利铂(CAPOX)联合纳武利尤单抗治疗。然而,尽管进行了连续的系统性治疗,但患者仍出现疾病进展,并在 1 年内死亡。切除后接受辅助化疗的患者仍然存活,无复发迹象。
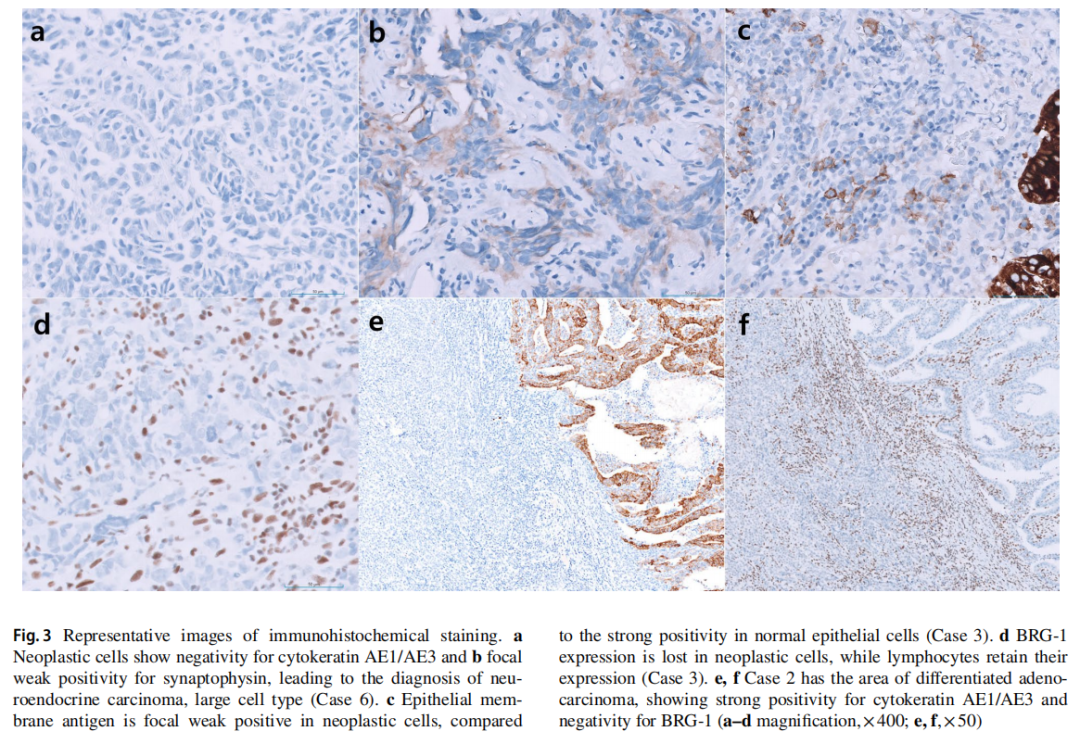
▲图3 免疫组化染色的代表性图像
讨 论
本文对 6 例SMARCA4型未分化型胃癌进行了回顾,并与文献中的主要报道进行了比较。由于病例数有限,未分化胃癌中更常缺失的SWI/SNF复合物的亚基仍不清楚,此外它们之间存在的临床病理学差异也不清楚。SWI/SNF缺失性未分化胃癌主要发生在 50 岁以上的男性。患者通常表现为非特异性症状,而且大多数患者没有恶性肿瘤的个人或家族病史。这些癌通常表现为大的溃疡性肿块,可出现在胃的任何部位,没有特殊的倾向部位。血清肿瘤标志物通常在正常范围内,在诊断时,超过一半的病例处于III或IV期。组织学上最常见的模式是片状生长,其次是巢状,黏性差,呈假腺状和索状排列。肿瘤主要由上皮样细胞或横纹肌样细胞组成,有些病例具有小细胞、巨细胞或透明细胞质的特征。大约三分之一的病例表现为腺体成分或胃发育不良。上皮标记物通常为阴性或弱阳性,而一小部分患者突触素呈可变弱阳性。所有病例均为HER2阴性,大多数患者的MMR蛋白表达正常。只有不到一半的病例的PD-L1检测呈阳性。由于分子分析报告的病例数量有限,关于基因突变的信息很少。
SWI/SNF复合物异常已在人类癌症中广泛报道,占所有癌症病例的 20%。其中,特异性肿瘤如卵巢小细胞癌、SMARCA4突变的高钙型、胸椎SMARCA4未分化型等特异性肿瘤,均以组织学未分化和侵袭性预后为特征。同样,一些报道认为未分化的胃癌与SWI/SNF复合物的缺陷有关。然而,这种突变与去分化或未分化的诱导之间的直接关系仍不确定。在一项涉及胃食管癌的前瞻性研究中,在 3.6% 的病例中发现了SMARCA4的致病性错义或截断突变,其中只有 2 例携带截断突变的病例具有未分化的组织学特征。另一项研究在 2% 的胃癌中发现了SMARCA4突变,并表现出不同的组织学模式。在本文研究中,病例2不仅在未分化区域呈BRG-1阴性,在分化区域也呈阴性。这些结果表明,虽然编码SWI/SNF复合物亚基的基因突变可能参与了未分化或去分化,但其缺失并不一定会导致未分化。相应的是,肿瘤未分化并不总是意味着SWI/SNF复合体的缺失。
BRG-1表达缺失是预测卵巢高钙型小细胞癌中SMARCA4突变的有价值标志物;然而,它在胃癌中的应用尚不明确。尽管如此,对于出现上皮标记物减少或缺失的胃癌病例,临床医生应考虑SMARCA4突变的可能性,而BRG-1 IHC可以帮助诊断,这可以通过分子分析来确定。
SWI/SNF异常对胃癌预后的影响仍存在争议。Chang等报道,SMARCA4变异胃肠道未分化癌与较差的总生存期(OS)和无病生存期相关;然而,Huang等仅报道了SMARCA4变异和SMARCA4正常的胃癌之间存在边缘性OS差异。Zhang等人根据多变量Cox分析表明,SMARCA4并不是OS的一个重要变量。许多SMARCA4缺失性未分化胃癌患者生存期不到1年,这可能归因于诊断时已处于晚期和未分化的组织学特征,正如在本文病例中观察到的。
SWI/SNF缺失性未分化癌对常规化疗的反应较差。因此,在可行时,建议行手术完全切除,并辅以新辅助或辅助化疗。免疫检查点抑制剂可能在高肿瘤负荷和PD-L1表达的肿瘤中有效。此外,多种治疗靶点,包括zeste同源物2(EZH2)增强子抑制剂、组蛋白去乙酰化酶抑制剂和细胞周期蛋白抑制剂,正在临床前和临床中进行研究。
总之,SMARCA4缺失性未分化胃癌是一种罕见的恶性肿瘤,其特征是诊断晚期和未分化,常表现为片状生长模式和上皮标记物减少或缺失。SMARCA4突变可能有助于未分化的过程,并导致不良的治疗结果。
参考文献:
An HR, Kim HD, Ryu MH, Park YS. SMARCA4-deficient undifferentiated gastric carcinoma: a case series and literature review. Gastric Cancer. 2024 May 22. doi: 10.1007/s10120-024-01510-9. Epub ahead of print. PMID: 38772975.



