【ASCO教育文册】双抗治疗淋巴瘤和骨髓瘤相关毒性的管理
时间:2024-07-09 14:01:33 热度:37.1℃ 作者:网络
目前FDA批准的用于复发或难治性多发性骨髓瘤(RRMM)患者的双特异性抗体(BsAb)包括elranatamab、teclistamab(特立妥单抗)和talquetamab,Epcoritamab、glofitamab(格菲妥单抗)和mosunetuzumab已获批用于复发或难治性B细胞非霍奇金淋巴瘤(RR-NHL)患者的三线治疗。此外还有其他靶点的双抗。
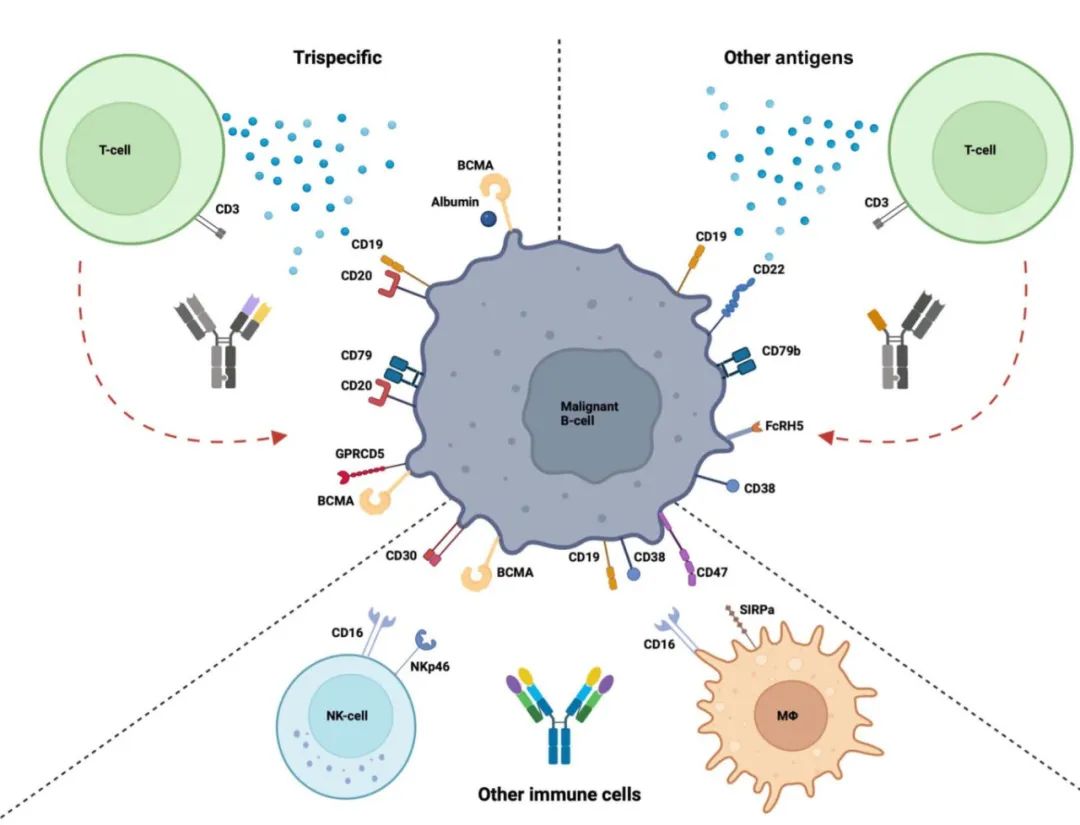
各种类型BsAb有相似的副作用,但由于表面靶抗原和设计不同,每种BsAb也有额外和不同的副作用。《American Society of Clinical Oncology educational book》近日发表文章,对淋巴瘤和多发性骨髓瘤中双特异性抗体的常见毒性和管理策略进行了阐述。
BsAb的T细胞重定向相关毒性
所有级别的细胞因子释放综合征(CRS),RRMM患者中发生率约为55%-80%,B-NHL中约为45%-65%。该综合征包括因释放促炎细胞因子(如IL-6)而引起的全身性炎症反应,并伴有发热为强制性症状(定义为体温≥38℃),以及低血压、缺氧、心动过速、恶心、寒颤、头痛、不适和肌肉疼痛为附加症状。CRS根据美国移植和细胞治疗协会(ASTCT)的共识分级指南进行分级,该指南最初是为CAR-T细胞治疗而开发的。
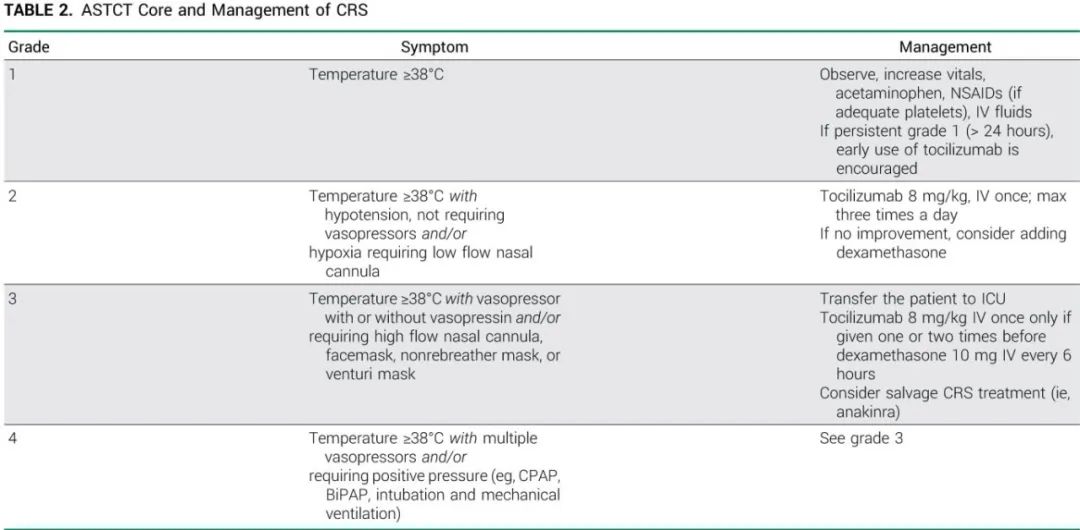
CRS多为1级和2级,因此在普通病房内可控制,无需在ICU中进行广泛监测。≥3级CRS发生率为0%-4%。皮下给药后CRS的发生时间多为次日。为了减轻CRS的风险和严重程度,在给予全剂量之前可进行一至两次剂量递增。此外,给予前驱用药可降低CRS的严重程度。前驱用药与单抗使用的药物相同,由糖皮质激素组成,例如 10-20mg 地塞米松或 100mg 泼尼松、抗组胺药和退热药。但有一个例外情况,那就是在格菲妥单抗首次递增剂量前1周额外使用奥妥珠单抗作为预处理,以耗尽外周和组织的 B 细胞。CRS 可在每次递增剂量或全剂量给药后发生,甚至可在单例患者中多次发生。
在大多数情况下,RRMM患者可在第1周期第一次全剂量后停止地塞米松前驱用药。对于CD20双抗,建议在1-3个周期后停止前驱用药。CRS的发生与双抗的临床疗效无相关性。由于CRS的风险,大多数患者需要在开始治疗时或第一次全剂量时住院。
CRS的管理取决于其分级。1级可使用对乙酰氨基酚、非甾体抗炎药和静脉输液治疗,并通过更密集的重要参数测量进行监测。抗IL-6受体阻滞剂托珠单抗在缓解CRS方面非常有效,发生长期1级CRS(例如>24小时)或症状加重至2级CRS时应考虑使用。2级CRS的临床症状多为发烧和平均动脉血压下降30%或收缩压<90 mmHg,部分患者可能出现缺氧,需要鼻腔插管<6L/min输氧。托珠单抗静脉注射(IV)的剂量为一次8mg /kg(最大剂量为800mg),并且可以重复,在24小时内最多给药三次;一例患者不应超过四次。托珠单抗的副作用为免疫抑制和中性粒细胞减少,但通常耐受性很好。托珠单抗应在开始BsAb治疗前可用。建议进行额外的检测以排除感染,但一般来说,没有必要开始经验性广谱抗生素治疗。3级CRS需要高流量补充氧或血管加压药;如果以前没有给予托珠单抗或只使用过一两次,则可以重复给药。对于所有其他患者,一次IV给予10mg 地塞米松对治疗CRS非常有效,并且可以每天最多重复4次(每6小时一次),而不会影响双抗的疗效。
皮下双抗治疗的注射部位的皮肤反应较为常见的(约20%-45%),最常发生于治疗的前8周;通常容易控制,并在注射后几天内恢复。
肿瘤燃瘤(flare)是暴露于免疫调节剂的NHL患者的常见免疫反应,在3%-7%的CD20双抗患者中也观察到肿瘤燃瘤。在第一次给药后不久,T细胞涌入肿瘤部位会导致肿瘤疼痛和皮疹。通过临床或放射学评估,已知淋巴结或结外病变的大小可增加(假性进展),以及出现胸腔积液或腹水新发或恶化。疼痛可通过镇痛来控制,皮质类固醇可用于重度表现或淋巴瘤位于关键部位的患者。理论上,多发性骨髓瘤患者也可能出现以骨痛加重或髓外病变肿胀为表现的肿瘤燃瘤,但尚未在临床试验中报道。
血细胞减少
所有双抗都可能发生短暂性血细胞减少,但RRMM患者多于RR-NHL患者。由于双抗为靶向特异性,一般假设认为是由于骨髓微环境中细胞因子的释放,导致造血细胞成熟的普遍抑制。此外,许多RRMM患者在双抗开始前骨髓储备已经较差。在前瞻性试验中,RRMM的中性粒细胞减少率为30%-75%,贫血率为35% - 60%,血小板减少率为25%-40%。RR-NHL中中性粒细胞减少率为20%-40%,贫血率为15%-45%,血小板减少率为10%-25%。除NHL患者的贫血外,血细胞减少大多数为≥3级。血液学毒性是双抗中报道最多的≥3级毒性。对于特立妥单抗,至发生≥3级中性粒细胞减少的中位时间为2.3个月,且在开始特立妥单抗后2-4个月内发生率最高。任何级别中性粒细胞减少的中位持续时间为1.2个月。Elranatamab与特立妥单抗具有相似的血液学毒性特征,而对于talquetamab,第2个周期后血细胞减少大多会消失。抗CD20双抗类似的结果。在接受mosunetuzumab治疗的患者中,至中性粒细胞减少的中位时间为70天,中位持续时间为8天;对于epcoritamab,大多数血细胞减少发生于前12周。
血细胞减少可通过支持性护理策略(如输血)进行治疗。粒细胞集落刺激因子可用于≥3级中性粒细胞减少患者,但不能在剂量递增或活动性CRS期间使用。促红细胞生成素刺激剂可考虑用于持续性输血依赖性贫血,但其安全性在淋巴增生性恶性肿瘤中仍有争议。延长给药间隔对减少血细胞减少也有积极作用,当达到预期的抗肿瘤效果时应考虑到这一点。
感染
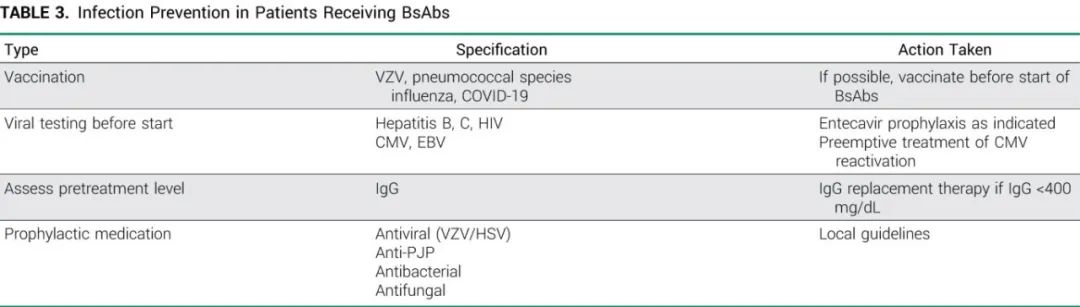
随着感染的增加,双抗具有免疫抑制作用,但不同双抗间的感染率和感染类型可能不同。特别是在BCMA双抗特立妥单抗和elranatamab治疗的患者中,与其他双抗相比感染率似乎更高(70%-80%),talquetamab的感染率为34%-47%,而CD20双抗治疗的感染率为20%-45%。BCMA双抗的感染类型主要为呼吸道感染(40%-60%,非COVID-19/非肺囊虫肺炎[PJP]),约29%为COVID-19感染;但这些研究在COVID-19疫苗可用之前就开始招募患者。大约12%的患者出现病毒感染或再激活,<10%的患者出现机会性感染,如PJP、真菌感染和进行性多灶性白质脑病/PML。3/4级感染发生率为40%~55%,病死率为6.5% ~12.7%。对于特立妥单抗,至任何级别和3-5级感染首次发病的中位时间分别为1.7和4.2个月。多个因素可以解释抗BCMA双抗的高感染率,如中性粒细胞减少、T细胞衰竭、B细胞发育不全、BCMA信号受损,包括低丙球蛋白血症的高发生率。许多患者开始治疗时免疫球蛋白G (IgG)水平较低,在两项BCMA双抗研究中约有74%的患者IgG水平<400mg/dL。
预防感染极为最重要。强烈建议所有患者,特别是RRMM患者,在开始双抗治疗之前接种水痘带状疱疹(VZV)疫苗和肺炎球菌疫苗,并每年接种流感和COVID-19疫苗。在开始前也要检测艾滋病毒和乙型肝炎和丙型肝炎,可增加巨细胞病毒和EBV检测。此外,建议预防PJP和单纯疱疹病毒/VZV, RRMM患者应考虑抗菌预防,特别是存在3/4级中性粒细胞减少时。随着时间的推移,1年后随着特立妥单抗给药频率降低,≥3级感染似乎也降低,表明替代剂量可能降低感染风险。回顾性分析表明,早期开始IgG替代治疗可将感染发生率降低至5.3%,IgG水平较低(IgG< 400mg/L)的患者都应考虑。
神经毒性
对于免疫效应细胞相关神经毒性综合征(ICANS),双抗少于CAR-T细胞疗法。据报道,在所有试验中ICANS 的发生率为3%-8%,且主要是1级或2级。ICANS包括弥漫性脑病症状,如意识减退、易入睡、定向障碍、失用症、日常生活活动受限和言语障碍。在大多数情况下,ICANS与CRS一起发生或在CRS发生后发生,并使用免疫效应细胞相关脑病(ICE)评分进行分级,该评分与ASTCT共识评分相结合对ICANS进行评分。发生1级ICANS时须进行更频繁的生命体征测量、格拉斯哥昏迷量表评分和ICE评分。应考虑早期给予地塞米松10mg IV一次,特别是肿瘤负荷高的患者或老年患者。如未见早期反应(<24小时),应将地塞米松剂量增加至每日4次,并建议开始使用非镇静性抗癫痫药物。≥2级ICANS最好咨询神经科医生。
部分患者在接受BCMA CAR-T细胞治疗后出现迟发性帕金森综合征,但BCMA 双抗未见报道。
GPRC5D特异性毒性
GPRC5D是一种在浆细胞上高度稳定表达的抗原,在B系其他细胞上不表达,但在角蛋白结构上表达,如毛干的皮质细胞、甲的角质形成带以及舌和唾液腺丝状乳头的中央区,从而解释了talquetamab的on-target off-tumor副作用。此外,在中枢神经系统脑干下橄榄核运动神经元中检测到低水平的GPRC5D mRNA,但未检测到相关蛋白。服用talquetamab后,患者会出现早发性味觉变化(味觉障碍),特别是严重的味觉丧失、口干、皮疹、皮肤干燥和指甲变化,可影响生活质量。口腔毒性导致30%的患者体重减轻,67%的患者出现发音困难,67%的患者出现任何皮肤事件,57%的患者出现指甲变化。在治疗早期咨询营养师非常重要,以及在皮疹的情况下使用皮肤润肤剂和局部类固醇。有时在口腔炎症的情况下,需要口服糖皮质激素漱口水(正如用于口腔移植物抗宿主病时)。头发变化较少,但可能包括睫毛或眉毛的脱落。应告知患者相关副作用,以及数月后这些副作用似乎会减轻。此外,减少剂量和减少给药频率至每月一次是减轻这些副作用的重要策略。
参考文献
Braun A, et al. Bispecific Antibody Use in Patients With Lymphoma and Multiple Myeloma.Am Soc Clin Oncol Educ Book . 2024 Jun;44(3):e433516. doi: 10.1200/EDBK_433516


