南方医科大团队:葛根素成肠道微生物"神奇钥匙",抗动脉粥样硬化新纪元来临!
时间:2024-07-15 06:00:08 热度:37.1℃ 作者:网络
动脉粥样硬化(AS)是一种严重的慢性心血管疾病,对全球公共卫生领域构成了显著的挑战。鉴于其深远的影响,近年来,药食同源植物因其天然且安全的属性,在预防和管理包括AS在内的慢性病方面受到了广泛瞩目,被视为一种潜在的解决方案。
葛根素(PU),作为一种在葛根中天然存在的化合物,自20世纪50年代末起即被视为具有显著活性的化合物之一,尤其在心血管健康方面展现出显著益处。其抗AS的特性已通过科学验证,具体表现为减少炎症反应和改善脂质水平。然而,PU在水和脂质中的溶解度存在限制,这一特性导致了其生物利用率的低下,从而在一定程度上阻碍了对PU作用机制的深入理解和研究。
AS的高发病率持续存在,其背后缘由涉及遗传和环境等多重因素,其中高脂肪饮食(HFD)作为环境影响因素之一尤为显著。在解析HFD对AS影响的复杂机制中,肠道微生物群的作用逐渐凸显为关键要素。近日,一篇标题为“Puerarin alleviates atherosclerosis via the inhibition of Prevotella copri and its trimethylamine production”的学术论文,深入探讨了PU在调控肠道微生物群落以及减轻AS病情方面的潜在作用机制。

图1 论文首页
PU可降低HFD喂养的ApoE−/−小鼠的AS和血浆TMAO水平
该研究首先对PU在ApoE-/-小鼠中针对HFD相关AS的潜在保护效果进行了评估(图2A)。对比标准饲料喂养的小鼠,接受HFD喂养的小鼠在体重增加及脂肪积累方面呈现出显著的变化,而PU的介入有效缓解了这些不利影响(图2B-C)。接着,研究通过应用Oil Red O和HE染色技术,对富含脂质的斑块进行了深入分析,以评估PU对斑块形成的影响。
结果显示,与饲料喂养的小鼠相比,HFD喂养的小鼠主动脉斑块的发展更为显著,然而,经过PU处理的小鼠在斑块形成方面展现出显著的减少(图2D-E)。此外,与饲料喂养的小鼠相比,HFD喂养的小鼠体内炎症因子水平显著上升,这些炎症因子包括肿瘤坏死因子、白介素6、白介素1以及粘附分子,如细胞间粘附分子1和血管细胞粘附分子1。但PU的使用显著降低了这些炎症标志物的水平(图2F-G)。综上所述,PU在改善AS方面具备积极的效应。
值得关注的是,经过口服PU后,虽然在肝脏(浓度约50µM)和血液中(浓度范围50-100µM)检测到了PU的存在,然而,PU的主要显著积累现象主要出现在粪便样本中(浓度高达250µM,图2H),这一发现提示PU可能在肠道中通过调节肠道微生物群,发挥其局部抗AS的作用。鉴于肠道微生物群相关的TMAO已被证实为加速AS病变发展的因素,研究随即对ApoE−/−小鼠血浆中的TMA和TMAO水平进行了测量。结果表明,在PU处理后,TMA和TMAO的水平均呈现下降趋势(图2I-J)。
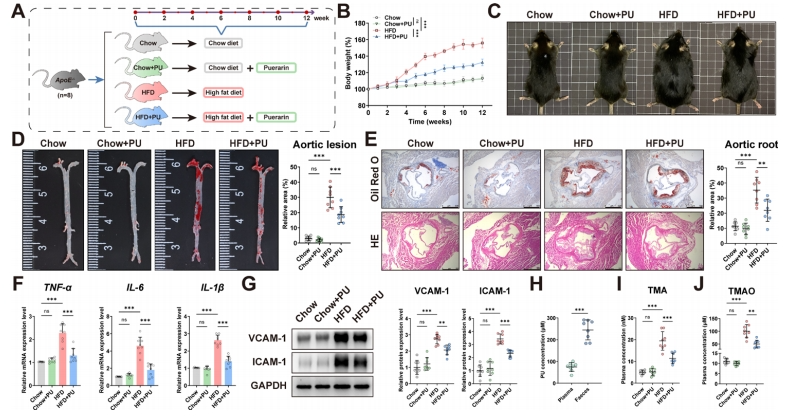
图2 PU可降低HFD喂养的ApoE−/−小鼠的AS和血浆TMAO水平
PU对AS的改善作用由肠道菌群介导
为了深入探究PU对AS改善作用的潜在机制是否经由肠道微生物群介导,研究首先从PU处理的供体小鼠(HFD+PUFMT)或载体处理的小鼠(HFD-FMT)中分离并提取了粪便微生物群,随后将这些微生物群移植至以HFD饮食维持的受体小鼠体内(图3A)。结果显示,与HFD-FMT组相比,接受HFD+PUFMT处理的小鼠在体重方面呈现显著降低(图3B-C),且AS斑块病变明显减少(图3D-E)。同时,研究观察到炎症因子水平(图3F)和粘附分子水平(图3G)在HFD+PUFMT组中均有显著降低。此外,血浆TMAO浓度在HFD+PUFMT组中相较于HFD-FMT组也表现出显著下降(图3H)。这些结果表明,PU对AS的有益改善作用是通过肠道微生物群的调节实现的。
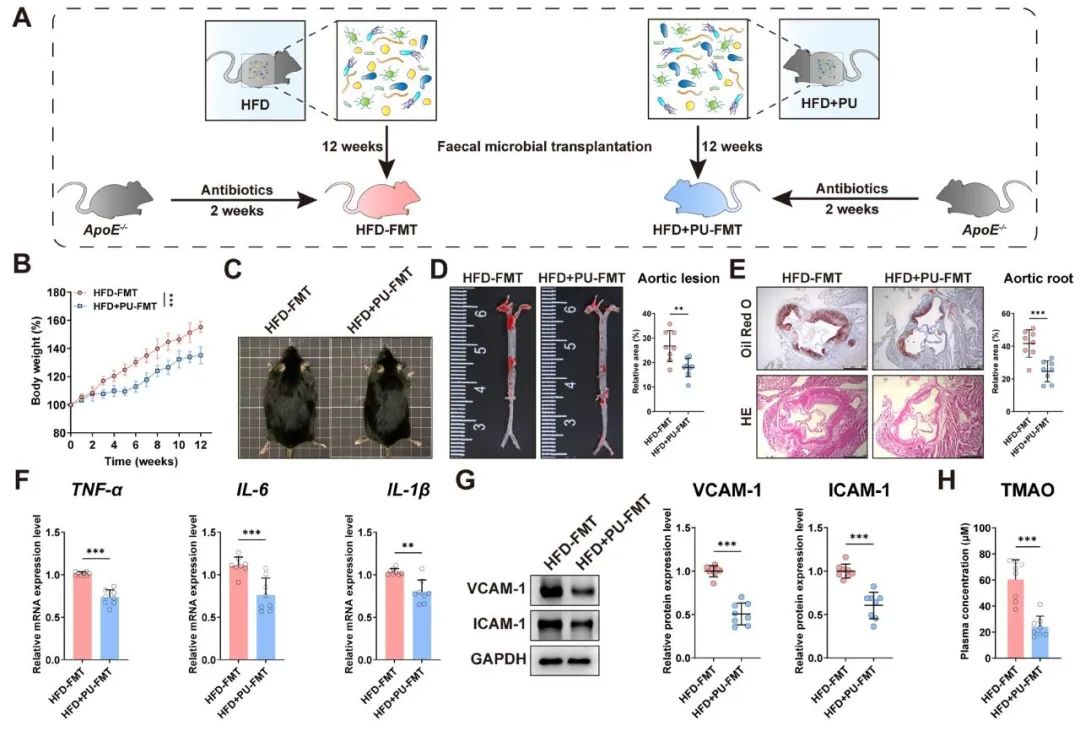
图3 PU对AS的改善作用由肠道菌群所介导
PU通过作用于P. copri改善AS的具体作用机制
在深入探索PU对特定微生物群落的影响时,研究者借助微生物测序技术,对接受PU处理与未经处理的HFD喂养的ApoE-/-小鼠的肠道微生物进行了详尽分析。结果显示,PU显著改变了肠道微生物的构成,特别是降低了普雷沃氏菌(Prevotella copri,简称P. copri)的丰度(图4A-D)。且Spearman相关分析显示,P. copri与血浆中TMAO水平存在正向关联性(图4E-F)。在体外培养实验中,独立分离的P. copri被证实能促进TMA的产生(图4G)。PU干预后的结果表明,PU能有效抑制TMA的生成(图4H)。随后,通过流式细胞术分析及基因表达影响研究(图4I-J),研究推断PU可能通过特异性地破坏P. copri的膜功能,进而减少其TMA的合成,最终降低TMAO的产量,从而对AS疾病产生积极的改善作用。
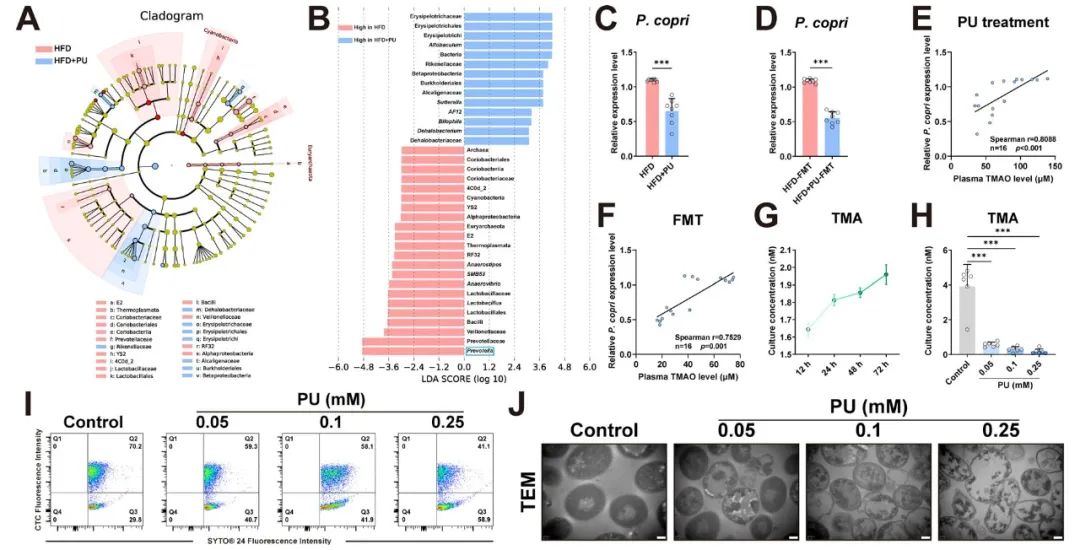
图4 PU通过作用于P. copri改善AS的具体作用机制
PU抑制P. copri从而降低颈动脉斑块患者血浆TMAO水平
为了深入探究临床环境中P. copri菌、TMAO水平与动脉粥样硬化斑块形成之间可能存在的关联,该研究系统地收集了AS患者的样本,并进行了颈动脉斑块评分(图5A-B)、P. copri菌表达量(图5C)以及TMAO(图5D)水平的详尽检测。随后,对收集到的数据进行了严格的相关性分析。结果显示,AS患者的P. copri菌丰度以及血浆TMAO水平均呈现显著上升的趋势,并且这种上升与患者的斑块评分呈现出正相关关系(图5E-G)。这一发现为P. copri菌及其代谢产物TMA在动脉粥样硬化发生发展过程中的作用提供了重要的临床依据。
为进一步验证该发现,研究随后招募了24名已确诊为AS的患者,并让他们每天口服PU进行为期一周的治疗。治疗结束后,研究观察到P. copri菌的丰度有所下降,同时血浆TMAO水平也呈现降低趋势(图5H-K)。这一结果表明,PU干预能够有效缓解AS患者的疾病表型,从而进一步证实了PU在临床治疗中的潜在价值。
此外,潜在结构判别分析(PLS-DA)(图5L)揭示了代谢组数据的内在结构。图5M和图5N中的火山图展示了代谢谱的显著差异,而图5O和5P展示了PU对TMAO代谢途径的显著调节。结果表明,PU治疗有效地降低了胆固醇水平,这显示了PU对胆固醇的调节作用,并可能进一步支持PU在AS治疗中的积极效果。这些发现强化了PU对AS的有益作用与抑制P. copri之间的潜在关联。这种抑制效应可能通过调节人类的TMAO代谢途径实现,进而对胆固醇代谢产生积极影响。
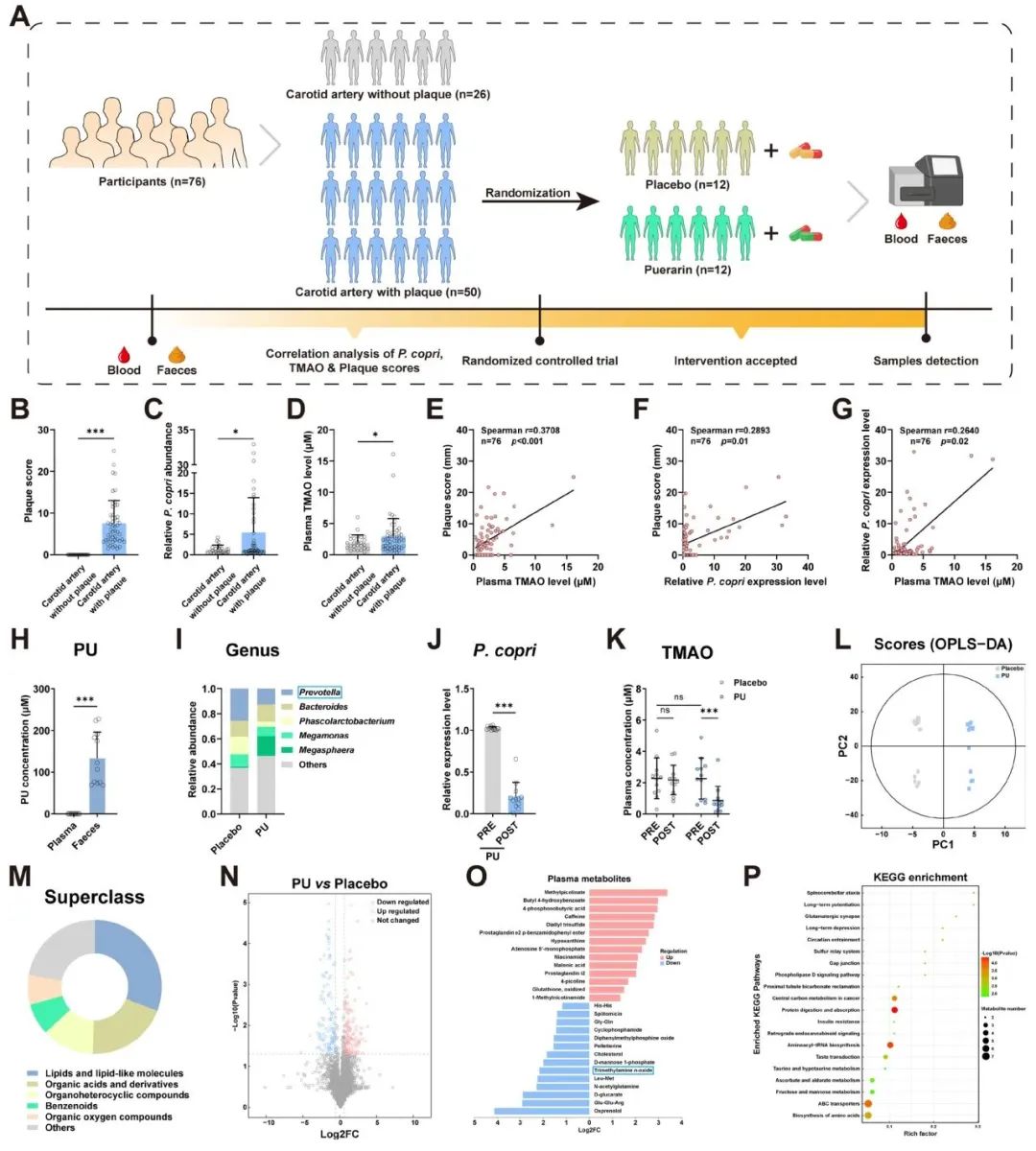
图5 PU抑制P. copri从而降低颈动脉斑块患者血浆TMAO水平
结论
总之,该研究明确了P. copri作为一种关键的细菌物种,其存在能够显著促进小鼠及人类体内的TMAO积累,进而加剧AS的进展。在此基础上,该研究进一步揭示了PU干预的潜在价值,即其通过抑制P. copri的活性来降低TMAO水平,为临床微生物靶向治疗动脉粥样硬化提供了极具潜力的新途径。这一发现不仅为相关领域的研究提供了新的方向,也为未来的临床治疗策略提供了宝贵的参考依据。
参考文献:
Puerarin alleviates atherosclerosis via the inhibition of Prevotella copri and its trimethylamine production. Gut. 2024 Jun 10:gutjnl-2024-331880. doi: 10.1136/gutjnl-2024-331880


