Nat Commun:基于长读长测序高分辨率解析完整端粒序列,揭示端粒与衰老、癌症等的新关联
时间:2024-07-18 16:02:25 热度:37.1℃ 作者:网络
导 读
端粒是位于真核细胞线状染色体末端的一种特殊结构,能维持染色体稳定、控制细胞分裂周期;端粒的长度则反映了细胞复制史及复制潜能,被称作细胞寿命的“ 有丝分裂钟”。端粒长度会随着年龄的增长而缩短,进而导致细胞衰老、细胞凋亡和致癌转化,可以说,人类健康深受端粒长度的影响,端粒过短或者过长均会引发相关疾病。已有研究发现,端粒缩短与疾病发病率增加和生存率降低存在关联,但这种缩短发生的具体时间和方式、以及某些染色体是否比其他染色体受到的影响更大至今仍不清楚。
为测量端粒长度,科研人员目前已开发出各种方法,包括末端限制性片段(TRF)分析、STELA、TeSLA、定量PCR、Q-FISH、Flow FISH以及基于新一代测序数据的端粒长度估计等。但由于端粒的重复性和长度等原因,这些传统方法无法解析染色体臂和单个端粒的等位基因特异性组成,因此在分辨率和准确性方面存在局限性。近年来,随着长读长测序技术的出现,使得对完整端粒的长度和组成进行解析成为可能。例如,PacBio HiFi和Oxford Nanopore(ONT)等长读长测序技术均可以以更高的分辨率对端粒进行测序和测量。
近日,由美国索尔克生物研究所和斯坦福大学领衔的两个研究团队在Nature Communications背靠背发表了两篇文章。研究团队利用ONT公司的原生长读长测序技术开发了一种突破性新技术Telo-seq,可解决端粒序列分析难题,以前所未有的分辨率研究发育、衰老和癌症过程中的端粒生物学。此外,研究团队还开发了一种使用纳米孔测序对单个完整端粒进行高分辨率、高通量测量的方法,可促进人们对端粒维护机制的理解,以及端粒长度作为衰老和疾病的临床生物标志物的应用。
主要研究内容
在题为“High resolution long-read telomere sequencing reveals dynamic mechanisms in aging and cancer”的文章中,索尔克生物研究所的研究团队开创性地发明了一种全新方法——Telo-seq,其使用纳米孔测序来有效地对人类端粒进行测序,能确定单个染色体上端粒的完整序列和精确长度,为端粒在健康和疾病中的动态变化提供了新见解。研究团队使用Telo-seq分析了整体、染色体臂特异性和等位基因特异性的端粒长度,并探究了五个群体倍增(PD)中端粒缩短的问题。

结果显示,同一样本内端粒长度是异质性的,其缩短率也存在较大差异;尽管存在异质性,但一些染色体臂的端粒相对于平均端粒长度始终偏长或者偏短,这些染色体臂特异性端粒长度差异在不同个体之间是保守的;相较于老年人,年轻人的端粒通常更长,表明随着年龄的增长端粒变短。综上,Telo-seq是一种高效且可重复的方法,能够揭示样本内、染色体臂特异性、等位基因特异性端粒长度的异质性。
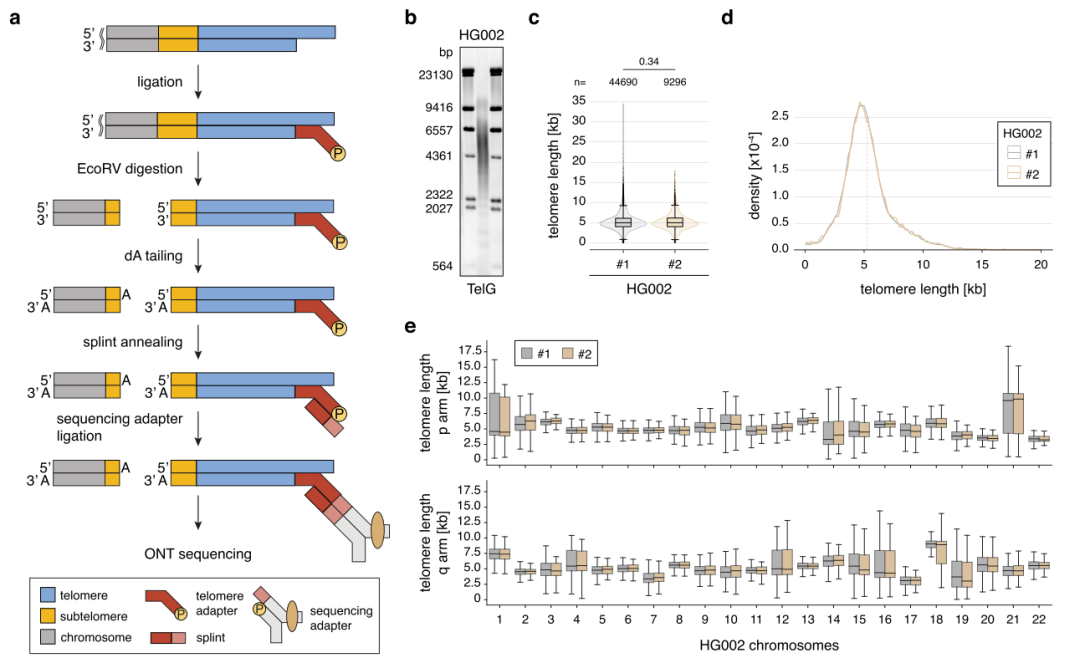
图1. Telo-seq测量染色体臂特定端粒的长度
此外,研究团队对癌细胞的分析表明,Telo-seq可以有效地区分端粒酶阳性(TERT+)和端粒选择性延长(ALT+)阳性的癌细胞系;既可分析正常复制危机细胞中的短端粒,也可分析ALT+癌细胞系中的超长端粒。 ALT 阳性癌症通常更具侵袭性,需要与端粒酶阳性癌症采用不同的治疗方法;从这一意义上讲,Telo-seq 可以用作快速可靠的诊断工具,以识别癌症类型并指导更个性化的治疗计划。同时,结合全基因组测序,Telo-se还将有助于研究遗传性端粒综合征,并解决潜在的基因改变对端粒结构的影响。
利用Telo-seq,研究团队描述了许多先前科学家无法获得的端粒生物学特征,发现可能存在潜在的染色体臂特异性因素影响衰老和疾病中的端粒动态;Telo-seq还提高了人们对衰老过程的复杂性以及端粒修复机制的理解,并加深了对端粒相关疾病的认知,可使科研人员能够研究这些疾病是在家族内遗传还是与个体染色体有关,以便制定更有针对性的干预措施。上述结果表明,Telo-seq为人类在发育、衰老和疾病过程中的端粒动力学研究奠定了基础。
文章通讯作者Jan Karlseder教授表示 :“Telo-seq 的最大影响是将开启端粒研究的新时代,其能够解答有关发育、衰老、干细胞和癌症的问题,而这些问题我们无法使用以前的工具来解决。我认为我们现在开始了解的东西实际上只是冰山一角,随着进一步了解,Telo-seq技术将揭示更多未知的生物学奥秘。
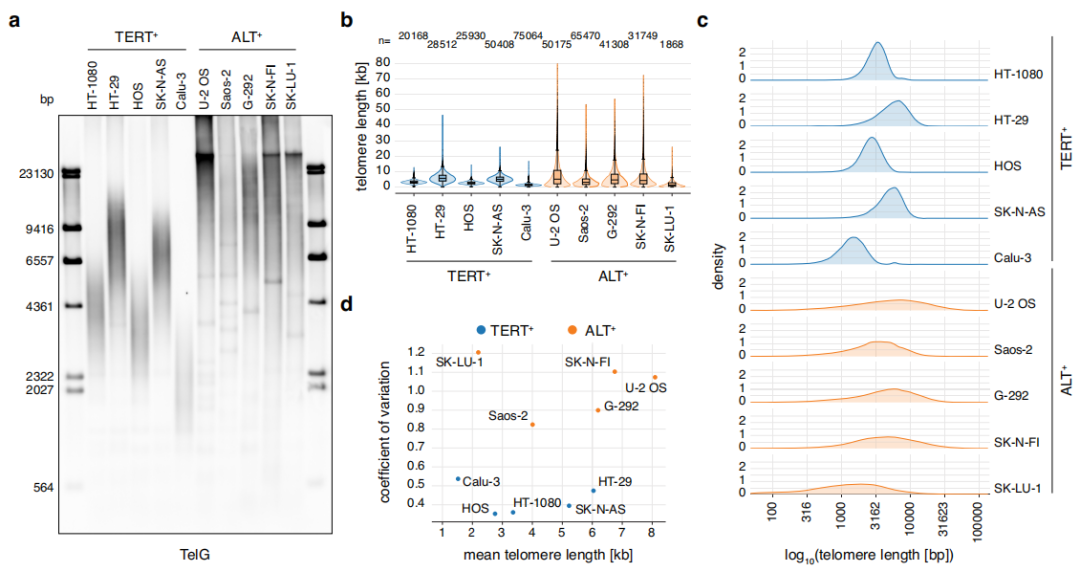
图2. Telo-seq揭示TERT+和ALT+癌细胞端粒长度分布
另一篇题为“Digital telomere measurement by long-read sequencing distinguishes healthy aging from disease”的文章中,斯坦福大学的研究团队则开发了一种测序准备和生物信息学分析流程—Telometer,能够从全基因组或富集端粒的长读长测序数据重复测量端粒,即采用纳米孔测序进行数字端粒测量(DTM),以了解人类端粒长度的分布如何随着年龄和疾病的变化而变化。

通过将端粒重复序列与最近完成的T2T人类参考基因组的染色体末端对齐,研究团队可识别出含有端粒的reads;将每个端粒的范围定义为从染色体末端的末端重复序列到亚端粒序列前最后两个连续重复序列的距离,这个亚端粒序列将端粒区域锚定到其参考染色体上。经验证,通过长读长测序测量的平均端粒长度与现有的金标准、TRF和Flow-FISH高度相关。
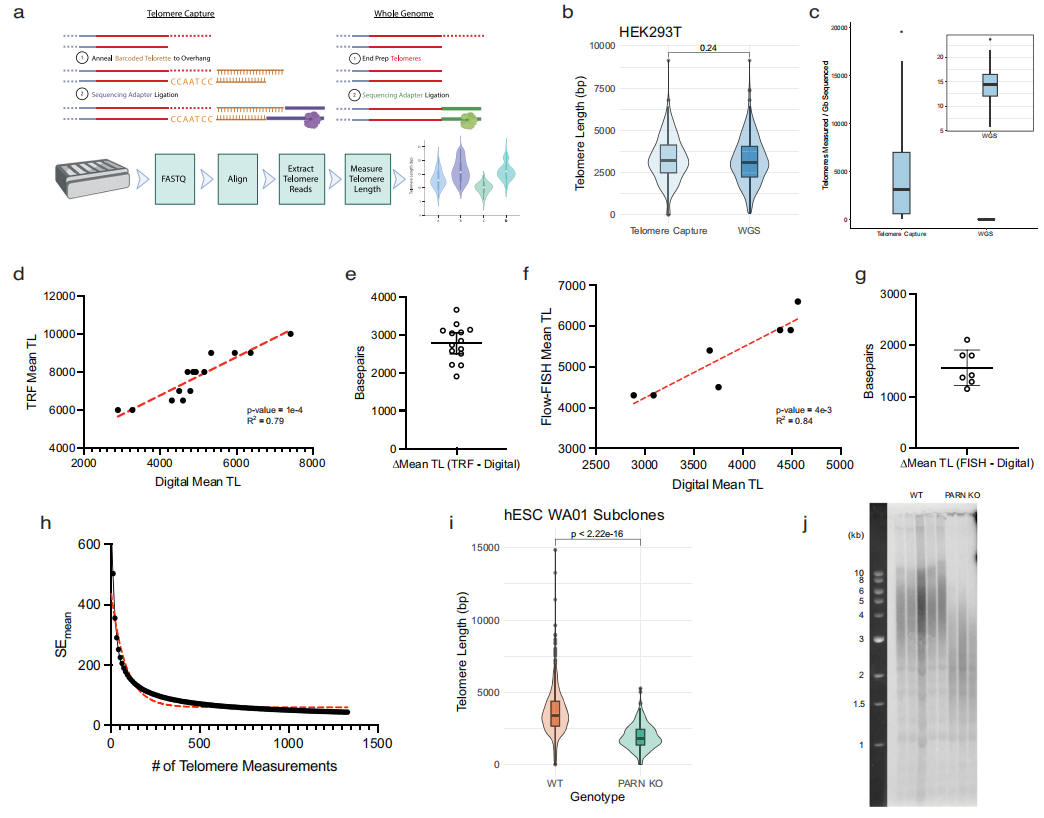
图3. 纳米孔长读长测序用于高分辨率端粒测量
同时,随着额外端粒测量的增加,该方法测量的标准误差呈指数衰减,最终达到30-40个碱基对的最大精度。随后,研究团队以高达30 bp的分辨率测量了遗传定义的人类细胞群体、健康供者的血细胞和端粒维持遗传缺陷患者血细胞的端粒磨损和新生延长。结果显示,人类的衰老伴随着长端粒的逐渐丧失和短端粒的积累,而在端粒维持缺陷的患者中,短端粒的积累更为明显,并与表型严重程度相关。
此外,基于生成的高分辨率测量数据集合,研究团队应用机器学习训练了一个二元分类模型,该模型可以将健康个体与端粒生物学障碍(TBD)个体区分开;值得注意的是,DTM可高灵敏度区分无症状携带者与正常个体,有望作为评估 TBD 的诊断或预后工具。
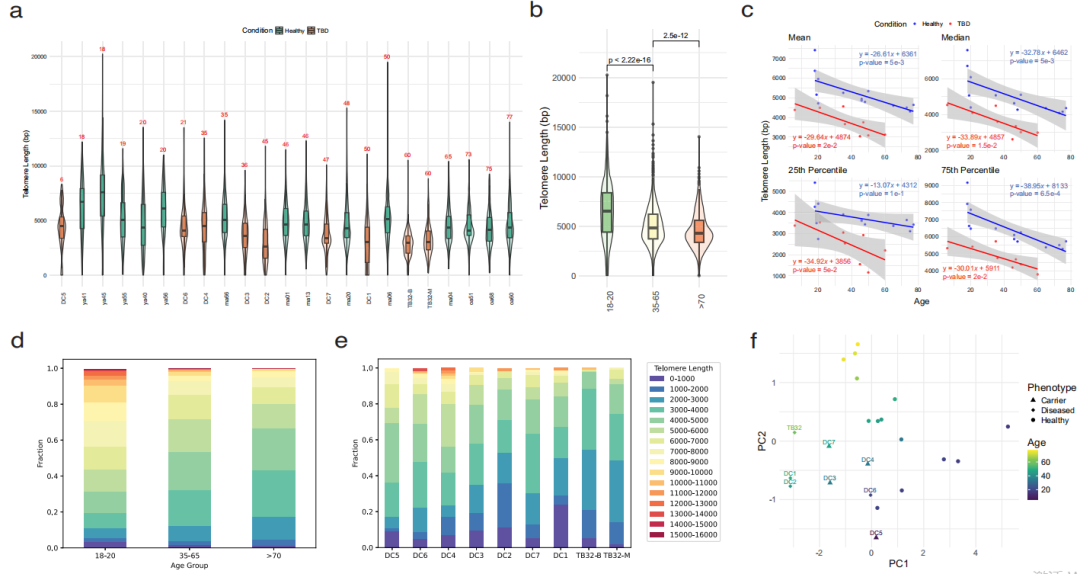
图4. 基于端粒长度分布区分健康人的衰老和疾病
综上所述,研究团队使用DTM方法高精度地测量了三种TBD基因型在培养和体内观察到的端粒缩短;并发现端粒酶在人类中优先作用于最短的端粒。随着长读长基因组数据库的增长,从更大、更多样化和理想的纵向研究中分析端粒长度分布,将使端粒长度成为更强大、甚至可能是衰老和疾病的预测生物标志物。
参考原文:
1. Schmidt, T.T., Tyer, C., Rughani, P. et al. High resolution long-read telomere sequencing reveals dynamic mechanisms in aging and cancer. Nat Commun 15, 5149 (2024).
https://doi.org/10.1038/s41467-024-48917-7.
2. Sanchez, S.E., Gu, Y., Wang, Y. et al. Digital telomere measurement by long-read sequencing distinguishes healthy aging from disease. Nat Commun 15, 5148 (2024).
https://doi.org/10.1038/s41467-024-49007-4.


