胃癌新疗法:恒定自然杀伤T(iNKT)细胞抑制体内CD1d阳性肿瘤增殖,刺激细胞因子分泌,诱导肿瘤细胞凋亡!
时间:2024-07-22 12:00:20 热度:37.1℃ 作者:网络
亮点
1、在细胞水平上,iNKT细胞对CD1d阳性表达胃癌细胞有极强的靶向性,且伴随着细胞因子分泌的增加。
2、在动物水平上,iNKT细胞联合α-半乳糖基神经酰胺(α-GalCer)治疗,显著抑制CD1d+小鼠的肿瘤增殖,并诱导了肿瘤细胞凋亡。
3、顺铂通过上调CD1d的表达,使胃癌细胞更容易受到iNKT细胞的“攻击”,进一步提高抗胃癌的治疗效果。
胃癌是全球第二大高发恶性肿瘤,也是全球第三大癌症致死原因。尽管随着药物研究领域的发展,人们在治疗策略上取得了巨大的进步,患者生存率也有了显著的提高,但由于耐药性等原因,胃癌患者的长期预后依然不尽人意。
恒定自然杀伤T(iNKT)细胞分别在人和小鼠体内表达恒定的Vα24-Jα18链和Vα14-Jα18α链。近年来,人们发现iNKT细胞能够强烈刺激体内的抗肿瘤免疫反应,这一过程主要由iNKT细胞配体——α-半乳糖基神经酰胺(α-GalCer)所介导。
那么, iNKT细胞是否能够为胃癌的免疫疗法提供新思路呢?
无独有偶,近期一项题为Utilization of invariant natural killer T cells for gastric cancer treatment的研究表明,iNKT细胞对胃癌细胞表现出较强的细胞毒性,能够显著抑制肿瘤增殖,这一过程极大的依赖于胃癌细胞CD1d的表达。此外,顺铂治疗可上调胃癌细胞CD1d含量,增强其对iNKT细胞介导的杀伤易感性。

近年来的研究表明,部分肿瘤细胞可以高度表达 CD1d 分子。因此,研究人员首先检测了胃癌中CD1d的表达。有趣的是,在44例胃癌根治性切除术患者的组织切片中,近半数患者组织对CD1d抗体有强烈反应,具体表现为,CD1d在18.2%的样本中高表达(n = 8),在18.2%的样本中中等表达(n = 8),在23.6%的样本中低表达(n = 10),仅40%的样本中未检测到CD1d (n = 18)。
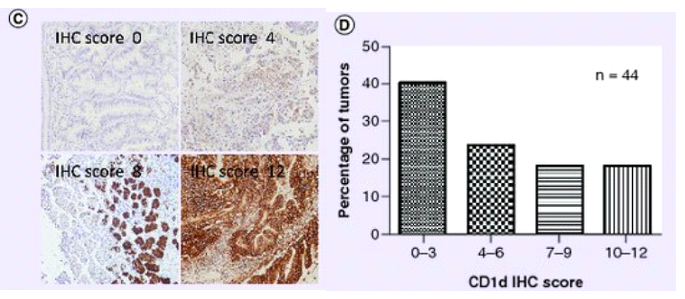
患者原发肿瘤中CD1d的表达情况
这一结果令研究者脑海中灵光一现——CD1d可否作为癌症标志物用于iNKT细胞治疗人类胃癌呢?
随后,他们将体外扩增的iNKT细胞与胃癌细胞共培养,发现在加入α-GalCer的情况下,iNKT细胞对CD1d+细胞的毒性以效应细胞与靶细胞比例(E:T)依赖的方式显著增强。为进一步验证iNKT的抗肿瘤活性依赖于CD1d表达,研究人员将CD1d—的人胃腺癌细胞(AGS)异位表达CD1d,发现在α-GalCer存在下,iNKT细胞诱导AGS-CD1d的细胞溶解增强;而在阻断CD1d表达后,iNKT细胞对癌细胞的杀伤作用则被大大削弱。
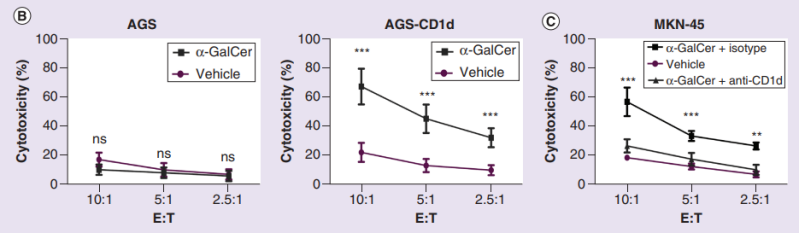
α-GalCer存在下,iNKT细胞对CD1d+胃癌细胞的细胞毒性增强
已有研究表明,iNKT细胞诱导的细胞杀伤主要通过穿孔蛋白/颗粒酶介导的颗粒胞吐过程(以下简称“脱粒”)。为了确定在胃癌细胞中,iNKT细胞是否通过“脱粒”发挥功能,研究人员将iNKT细胞与AGS或AGS- CD1d细胞共培养,随后检测iNKT细胞的CD107a(一种“脱粒”标志物)。令人惊讶的是,在α-GalCer的刺激下,仅AGS- CD1d细胞中CD107a“脱粒”明显增强,证实了iNKT细胞依赖于胃癌细胞的CD1d发挥肿瘤杀伤力。
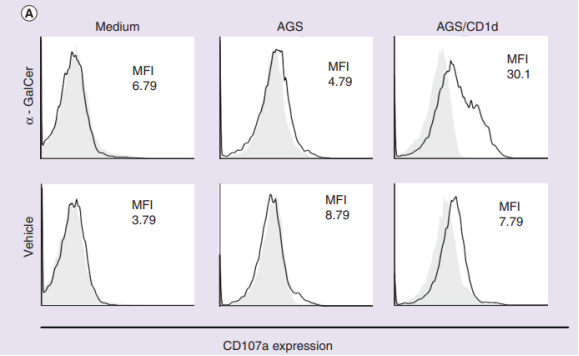
iNKT细胞与培养基、AGS或AGS-CD1d共培养下,CD107a的表达情况
众所周知,iNKT细胞在激活后可产生大量如IFN-γ等细胞因子,为了确定其介导的肿瘤杀伤是否伴随着细胞因子分泌的增加,研究人员将iNKT细胞与AGS或AGS-CD1d共培养。结果显示,在存在AGS-CD1d和α-GalCer的情况下,iNKT细胞的上清液中IFN-γ水平大幅度升高;此外,iNKT细胞激活后也能产生中等水平的IL-4和IL-13。
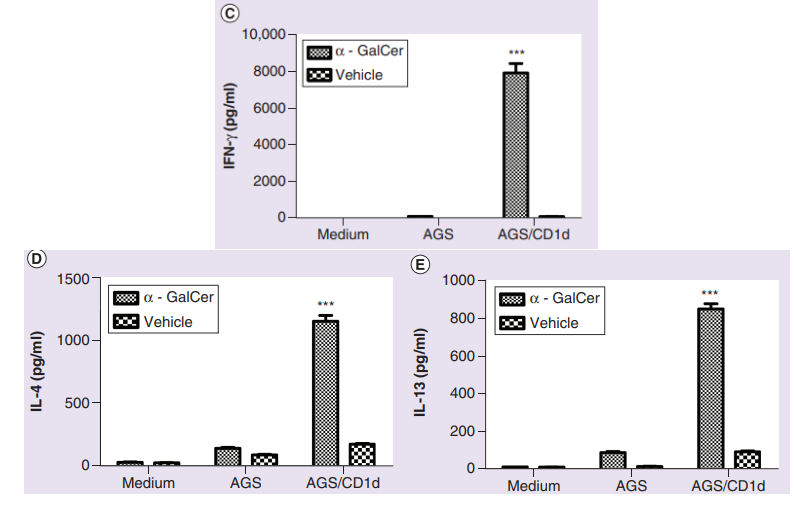
CD1d+胃癌细胞中细胞因子分泌升高
截至到这里,研究人员已经在体外水平证明了iNKT细胞可以“杀死”CD1d+胃癌细胞,那么它在体内是否同样抑制胃癌异种移植物的生长呢?
为解决这一疑问,研究人员建立了皮下移植AGS或AGS-CD1d的小鼠,随后用iNKT细胞联合α-GalCer治疗。令人惊喜的是,在注射iNKT细胞联合α-GalCer的情况下,AGS-CD1d小鼠的肿瘤增殖被显著抑制,iNKT细胞在肿瘤部位明显积聚,并诱导了肿瘤细胞凋亡。
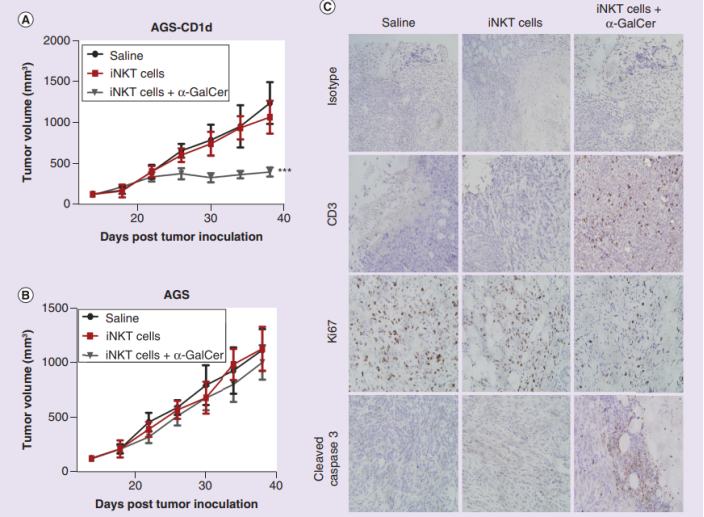
iNKT细胞对胃癌异种移植物的CD1d依赖性生长抑制作用
然而,仅仅拥有iNKT细胞却无法完全控制肿瘤的进展,因此,合理的联合利用化疗手段对于恶性疾病的治疗也具有关键作用。
顺铂作为治疗晚期胃癌常用的化疗药物,吸引了研究人员的目光。他们惊讶地发现,在低剂量顺铂预处理的情况下,iNKT细胞对胃癌细胞的杀伤作用更好;此外,在与肿瘤细胞共培养的、经顺铂预处理的iNKT细胞培养基中,研究人员也观察到了更高的细胞因子IFN-4和IFN-γ释放量。这表明,顺铂可以使胃癌细胞对iNKT细胞介导的细胞毒性敏感,从而进一步提高抗胃癌的治疗效果。
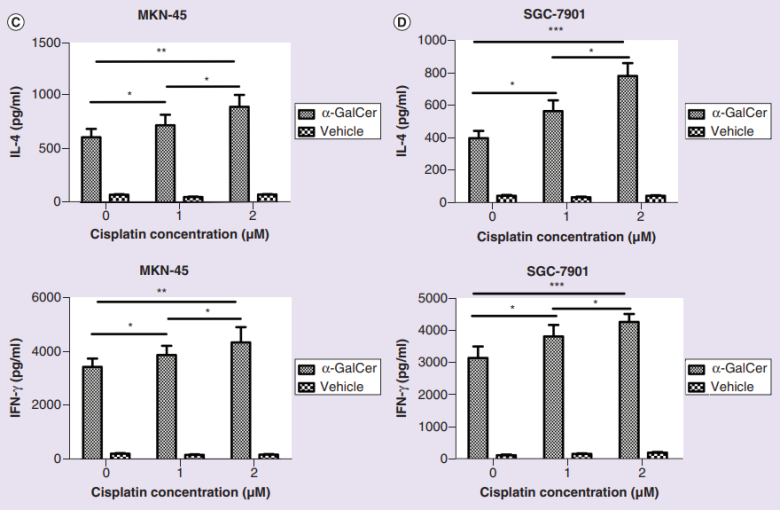
iNKT细胞培养基中IFN-4和IFN-γ释放量
那么,顺铂是否通过上调CD1d来诱导iNKT细胞的协同杀伤力呢?
于是,研究人员检测了顺铂处理下,胃癌细胞中CD1d蛋白的表达情况。与对照组相比,顺铂以剂量依赖性显著增加了胃癌细胞中CD1d蛋白量。为了确定这种上调是否与iNKT细胞易感性增加有关,他们构建了CD1d敲除胃癌细胞系。结果显示,在CD1d敲除后,细胞不再受顺铂诱导的、iNKT细胞介导的细胞毒性的影响,这表明顺铂通过上调CD1d的表达使胃癌细胞更容易受到iNKT细胞的“攻击”。
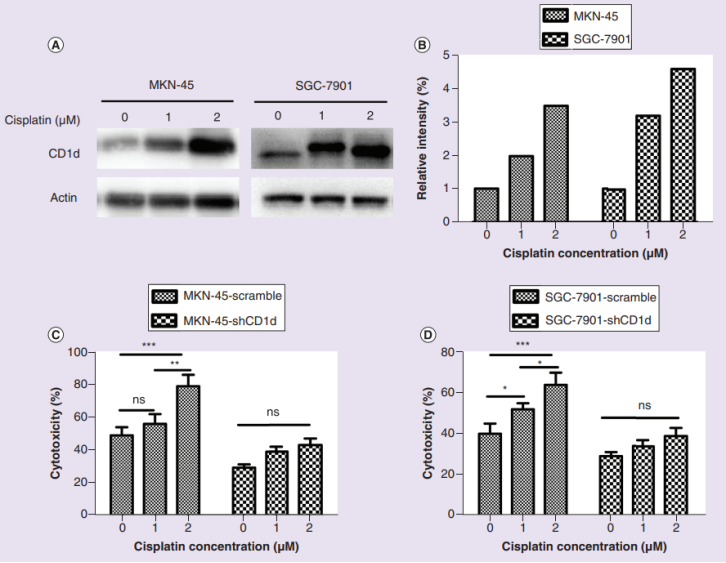
顺铂诱导CD1d上调和iNKT细胞疗法对胃癌的疗效
综上,这项研究表明iNKT细胞疗法能够用于癌症免疫治疗,无论是其单独使用还是与顺铂联合使用,iNKT细胞疗法必将为胃癌患者提供新的、更为安全的治疗选择。
来源:
微信公众号: 基因启明
参考文献:
Xu Q, Li J, Zhang N, Zhang L, Qian R. Utilization of invariant natural killer T cells for gastric cancer treatment. Future Oncol. 2018 Aug;14(20):2053-2066. doi: 10.2217/fon-2017-0724. Epub 2018 Jul 27. PMID: 30051730.


