【协和医学杂志】新型[18F]-FES PET/CT无创功能性诊断乳腺癌迟发性肺转移致霍纳综合征一例
时间:2024-07-22 18:00:28 热度:37.1℃ 作者:网络
1 病例资料
患者女性,58岁。因“右肺占位性病变,拒行穿刺活检”于2022年7月15日就诊于北京协和医院乳腺外科。
2006 年,患者因“穿刺诊断为右乳癌2周”就诊于北京中医医院并行右侧乳腺癌改良根治术。
术后病理示:右乳腺浸润性导管癌,肿瘤最大径2 cm,右腋窝淋巴结未见癌转移(0/11)。
免疫组化结果示:雌激素受体(ER)(+),孕激素受体(PR)(+),人表皮生长因子受体2(HER2)(-)。
诊断为右乳浸润性导管癌(T1cN0M0 Ⅰ期,Luminal A型),术后行6程紫杉醇+环磷酰胺(TC方案)化疗,之后给予口服他莫昔芬内分泌治疗,治疗5年后未再规律复查。
2022年4月,患者出现声音嘶哑,无咳嗽、咳痰、呼吸困难,自行服用润喉药物后无好转。
2022年6月,患者因“左侧眼睑下垂、瞳孔缩小、颜面无汗”,就诊于当地医院神经内科,诊断为霍纳综合征,病因待查。
2022年7月,患者就诊于北京市隆福医院,胸部CT检查示:右乳腺术后缺如,右肺尖软组织团块(最大横截面大小约2.9 cm×2.4 cm),周围似见毛刺,与纵隔胸膜分界不清,考虑恶性可能性大(图1)。
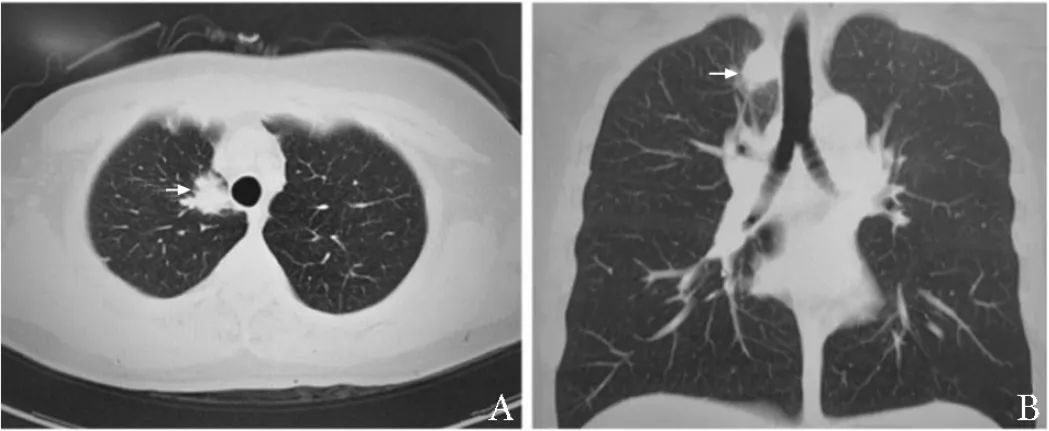
图1 患者胸部CT检查(2022-07)
A.右肺尖软组织团块,周围似见毛刺(箭头);B.病变与纵隔胸膜分界不清(箭头)
18F-FDG PET/CT检查示:右肺尖纵隔胸膜下见不规则团块影(大小约2.8 cm×2.7 cm×2.2 cm),边缘见毛刺及索条,内见支气管中断,放射性摄取增高,标准摄取最高值(SUVmax)为16.2;右肺门及纵隔见多发放射性摄取增高的淋巴结肿大(较大者短径约1.5 cm),SUVmax为18.3。右肺尖纵隔胸膜下代谢增高的团块,考虑肺原发恶性病变可能性大,伴右肺门及纵隔淋巴结多发转移(图2)。
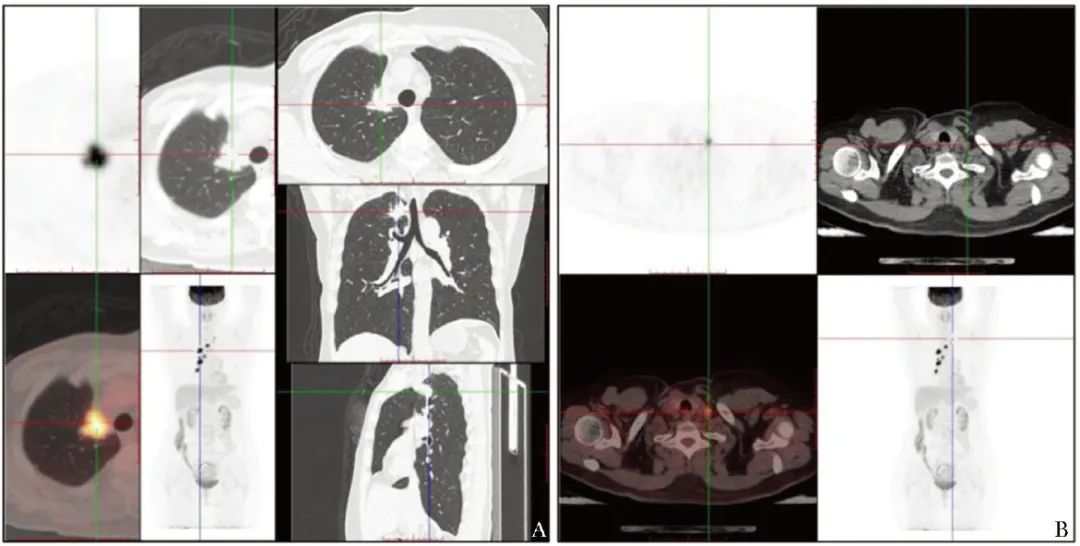
图2 患者18F-FDG PET/CT检查(2022-07)
A.右肺尖纵隔胸膜下代谢增高的团块;B.左侧锁骨上窝淋巴结代谢增高
乳腺癌已超越肺癌成为全世界最常见的恶性肿瘤,也是我国女性最常见的恶性肿瘤,严重威胁女性健康[1]。约3%~10%的女性在确诊时即有远处转移;即使是规范治疗的早期乳腺癌患者,其中也有30%~40%最终发展为晚期乳腺癌,而晚期乳腺癌5年生存率仅为20%[2-3]。
约75%的乳腺癌患者ER呈阳性表达,对内分泌治疗敏感;其中激素受体(HR)(+)、HER2(-)的腔上皮型是乳腺癌最为常见的分子亚型,占所有乳腺癌的60%。发生于10年后的乳腺癌复发通常称为迟发性复发(late recurrence),以HR+/HER2-亚型多见[4],并可能具有特殊的基因表达亚型及种族差异[5-6]。
乳腺癌患者肺部恶性结节(肺转移与肺原发肿瘤)的鉴别诊断目前仍是临床中的疑难问题之一,因此应采用多学科诊疗模式(MDT)[7]。肺尖部癌又称为肺上沟瘤,易压迫颈部交感神经,并引起霍纳综合征,临床表现为患侧眼睑下垂、瞳孔缩小、眼球内陷,同侧额部与胸壁少汗或无汗,但肺上沟瘤可以是原发性肺癌抑或是转移性肺癌。然而,临床中常用的18F-FDG PET/CT通常仅提示恶性可能,难以鉴别肿瘤来源。
患者遂就诊于北京协和医院乳腺外科,并于2022年7月27日行18F-氟雌二醇(FES) PET/CT检查,提示:右侧乳腺术后缺如;右肺上叶尖段见放射性摄取增高的不规则软组织密度影(大小约2.4 cm×2.3 cm×2.3 cm),SUVmax为8.7,边缘见索条并牵拉邻近胸膜;左侧锁骨上窝、纵隔多区、右肺门多发放射性摄取增高的淋巴结,部分肿大,SUVmax为6.9;成像范围内另见左侧顶骨放射性摄取增高灶,同机CT相应部位骨密度减低,SUVmax为5.5。上述病变ER均呈阳性表达,考虑为乳腺癌转移灶(图3)。
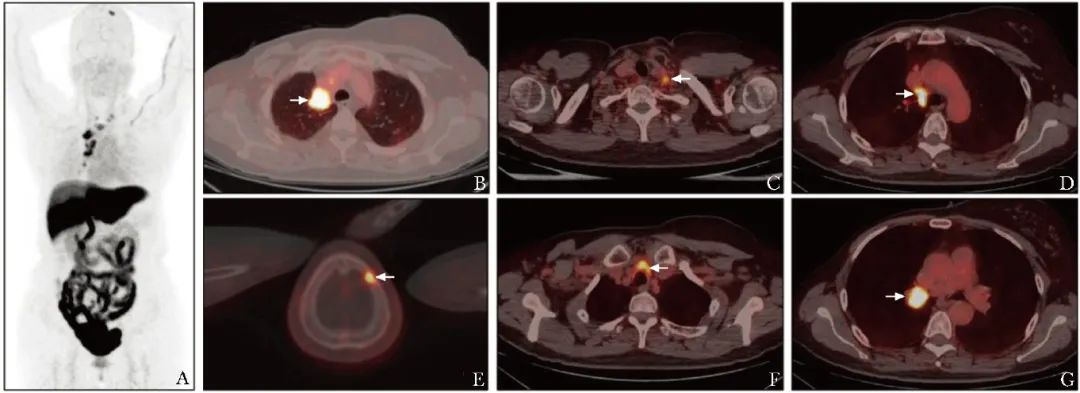
图3 患者18F-FES PET/CT检查(2022-07-27)
A.PET最大密度投影图;B.右肺上叶尖段胸膜下肿物ER(+)(箭头);C.左侧顶骨病灶ER(+)(箭头);D~F.纵隔多发淋巴结ER(+)(箭头);G.右肺门肿大淋巴结ER(+)(箭头)
18F-FES新型放射性显像剂可靶向结合ER,定量显示肿瘤组织ER表达情况[8];如与18F-FDG PET/CT结合使用,可在提示原发、转移性病灶摄取活性的同时,定量显示ER表达,无创性评估全身多处肿瘤病灶的ER表达谱[9];18F-FDG和18F-FES摄取如有不一致,则可个体化提示患者病灶的ER表达异质性,也提示非乳腺来源肿瘤。
最新研究表明,18F-FES PET/CT对于乳腺癌转移灶ER表达评估的灵敏度达76.6%~95%,特异度达80%~100%,可有效替代有创性病理活检,准确、无创性评估转移性乳腺癌患者全身多发病灶的总体ER表达情况,并提示后续治疗方案,补足转移性乳腺癌多病灶受体评估缺失的短板[10]。
在安全性方面,18F-FES作为放射诊断用药,其使用剂量很低,为临床常规诊断用药剂量。当使用最大推荐剂量2.22×108Bq时,有效剂量当量为0.002 mSv/MBq,此时人体关键摄取器官为肝脏,其有效剂量当量为0.13 mSv/MBq。已发表的研究中尚未发现18F-FES对人体有任何毒性或不良反应。
18F-FES于2020年5月被美国食品药品监督管理局批准上市,并已在北美、欧洲和亚洲逐渐开展临床研究。北京协和医院乳腺外科与核医学科合作,使用自主合成的18F-FES(伦理审查编号JS-2959、K3629)无创性评估晚期乳腺癌患者的全身病灶ER总体表达情况(ClinicalTrials.gov ID:NCT05613270,NCT05861830),工艺稳定性好,成像质量高;能在同一晚期乳腺癌患者体内精准鉴别肺转移病灶与放射性肺炎[11],并可连续指导患者多线解救治疗[12]。
患者于2022年8月起使用CDK4/6抑制剂(CDK4/6i)+芳香化酶抑制剂作为内分泌解救治疗,具体方案为口服阿贝西利150 mg 每日2次+依西美坦25 mg每日1次。治疗期间规律监测血常规及肝肾功能,并给予对症支持治疗。
治疗3个月后,于2022年11月复查胸部CT示右肺上叶不规则实性结节,牵拉邻近胸膜,长径约1.3 cm;双肺胸膜下多发结节、斑片及实变影,考虑炎性可能,建议随访(图4)。
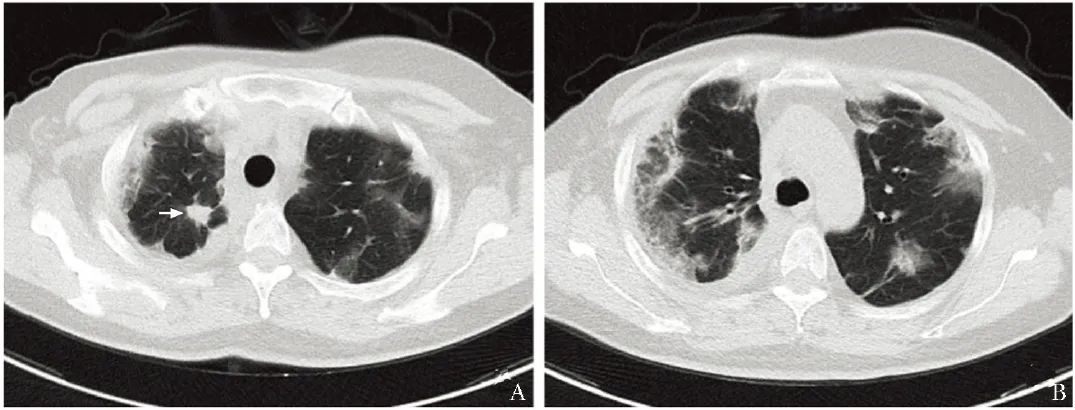
图4 患者治疗3个月后行胸部CT检查
A.右肺尖软组织肿物,周围见索条并牵拉邻近胸膜(箭头);B.双肺胸膜下多发结节、斑片及实变影
与治疗前相比,右肺占位体积明显缩小,考虑当前治疗有效,达到部分缓解(PR),继续当前内分泌解救治疗。此后规律复查,至2023年初因贫血、粒细胞减少、肺间质纤维化,阿贝西利减量至50 mg每日2次后耐受较好。2023年11月(治疗15个月)复查胸部CT,提示肺部转移灶大小为1.6 cm×0.8 cm,考虑疾病稳定(SD),治疗有效,遂继续目前治疗。目前该患者已获得无进展生存期(PFS)15个月。
CDK4/6i能通过抑制细胞周期素D1与CDK4/6激酶的结合,阻滞细胞周期从G1期到S期的进程,抑制肿瘤细胞增殖;其对ER(+)乳腺癌具有延缓和逆转内分泌耐药的作用。
近年来,随着MONARCH系列[13-14]、PALOMA系列[15-16]、MONALESSA系列[17]等10余个临床研究结果的问世,在大量循证医学证据支持下CDK4/6i已成为腔上皮型(HR+/HER2-)转移性乳腺癌的标准一线解救治疗方案,但仍存在以下治疗难点:
1 复发转移病灶ER表达与原发病灶可能不同,其一致性仅为66%~83%,且ER表达变化谱存在异质性,例如肺转移灶ER的表达并不能代表肝转移灶ER的表达情况,也不能直接预测治疗敏感性或提示预后[18]。
2 乳腺癌骨、肺、肝转移病灶活检有一定创伤性,花费高,且有失败风险,患者常有顾虑而拒绝操作,在临床实践中难以获取转移病灶的病理活检结果;若根据原发病灶的分子亚型进行治疗,可能导致治疗不精确、疗效不佳。
3 目前的影像学检查,包括常用的18F-FDG PET/CT显像,通常仅能显示复发转移病灶的存在而提示分期,但不能提示其激素受体表达的分子亚型情况。
新型18F-FES PET/CT解决了上述治疗难点,补足了转移性乳腺癌多病灶受体评估缺失的短板,可更好地指导后续个体化治疗。
综上,新型18F-FES PET/CT可准确、无创、安全评估HR+/HER2-转移性乳腺癌患者全身多发病灶的ER表达情况,并可预测性提示后续治疗方案。但该检查亦存在不足之处:因FES人体关键摄取器官为肝脏,故该方法评估乳腺癌肝转移病灶的ER表达情况准确性降低[19],仍有待后续研究积累经验并予以改进。
参考文献
[1]Sung H, Ferlay J, Siegel R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249.
[2]徐兵河, 王树森, 江泽飞, 等. 中国晚期乳腺癌维持治疗专家共识[J]. 中华医学杂志, 2018, 98(2): 87-90.
[3]国家肿瘤质控中心乳腺癌专家委员会, 中国抗癌协会乳腺癌专业委员会, 中国抗癌协会肿瘤药物临床研究专业委员会. 中国晚期乳腺癌规范诊疗指南 (2020版)[J]. 中华肿瘤杂志, 2020, 42(10): 781-797.
[4]Pedersen R N, Esen B Ö, Mellemkjær L, et al. The incidence of breast cancer recurrence 10-32 years after primary diagnosis[J]. J Natl Cancer Inst, 2022, 114(3): 391-399.
[5]Rueda O M, Sammut S J, Seoane J A, et al. Dynamics of breast-cancer relapse reveal late-recurring ER-positive genomic subgroups[J]. Nature, 2019, 567(7748): 399-404.
[6]Glass C C, Pride R M, Freedman R A, et al. Racial disparities in locoregional recurrence in postmenopausal patients with stage Ⅰ-Ⅲ, hormone receptor-positive breast cancer enrolled in the NSABP B-42 clinical trial[J]. Ann Surg Oncol, 2023, 30(13): 8320-8326.
[7]沈松杰, 韩志军, 于双妮, 等. 乳腺癌合并恶性肺结节: 乳腺癌肺转移? 还是乳腺和肺双原发癌?[J]. 协和医学杂志, 2020, 11(1): 109-114.
[8]Peterson L M, Kurland B F, Schubert E K, et al. A phase 2 study of 16α-[18F]-fluoro-17β-estradiol positron emission tomography (FES-PET) as a marker of hormone sensitivity in metastatic breast cancer (MBC)[J]. Mol Imaging Biol, 2014, 16(3): 431-440.
[9]Chae S Y, Ahn S H, Kim S B, et al. Diagnostic accuracy and safety of 16α-[18F]fluoro-17β-oestradiol PET-CT for the assessment of oestrogen receptor status in recurrent or metastatic lesions in patients with breast cancer: a prospective cohort study[J]. Lancet Oncol, 2019, 20(4): 546-555.
[10]Van Geel J J L, Boers J, Elias S G, et al. Clinical validity of 16α-[18F]fluoro-17β-estradiol positron emission tomography/computed tomography to assess estrogen receptor status in newly diagnosed metastatic breast cancer[J]. J Clin Oncol, 2022, 40(31): 3642-3652.
[11]Pan B, Hao Z X, Zhou Y D, et al. Increased 18 F-fluoroestradiol uptake of radiation pneumonitis in a patient with metastatic breast cancer[J]. Clin Nucl Med, 2023, 48(5): 437-438.
[12]Pan B, Hao Z X, Xu Y, et al. Case report: 18F-FES PET/CT predicted treatment responses of second-line and third-line CDK4/6 inhibitors after disease progression on first-line CDK4/6 inhibitor in a HR+/HER2- metastatic breast cancer patient[J]. Front Oncol, 2022, 12: 1095779.
[13]Sledge G W, Jr, Toi M, Neven P, et al. The effect of abemaciclib plus fulvestrant on overall survival in hormone receptor-positive, ERBB2-negative breast cancer that progressed on endocrine therapy-MONARCH 2: a randomized clinical trial[J]. JAMA Oncol, 2020, 6(1): 116-124.
[14]Goetz M P, Toi M, Campone M, et al. MONARCH 3: abemaciclib as initial therapy for advanced breast cancer[J]. J Clin Oncol, 2017, 35(32): 3638-3646.
[15]Finn R S, Martin M, Rugo H S, et al. Palbociclib and letrozole in advanced breast cancer[J]. N Engl J Med, 2016, 375(20): 1925-1936.
[16]Cristofanilli M, Turner N C, Bondarenko I, et al. Fulves-trant plus palbociclib versus fulvestrant plus placebo for treatment of hormone-receptor-positive, HER2-negative metastatic breast cancer that progressed on previous endocrine therapy (PALOMA-3): final analysis of the multicentre, double-blind, phase 3 randomised controlled trial[J]. Lancet Oncol, 2016, 17(4): 425-439.
[17]Tripathy D, Im S A, Colleoni M, et al. Ribociclib plus endocrine therapy for premenopausal women with hormone-receptor-positive, advanced breast cancer (MONALEESA-7): a randomised phase 3 trial[J]. Lancet Oncol, 2018, 19(7): 904-915.
[18]Lu Y J, Tong Y W, Chen X S, et al. Association of biomarker discrepancy and treatment decision, disease outcome in recurrent/metastatic breast cancer patients[J]. Front Oncol, 2021, 11: 638619.
[19]Boers J, Loudini N, De Haas R J, et al. Analyzing the estrogen receptor status of liver metastases with [18F]-FES-PET in patients with breast cancer[J]. Diagnostics (Basel), 2021, 11(11): 2019.


