为啥基因检测重复做?EGFR/HER2/MET和ROS1变异晚期肺癌治疗长达7年,ROS1融合出现又消失
时间:2024-07-31 14:00:22 热度:37.1℃ 作者:网络
本文介绍了一名 70 岁、从不吸烟的女性病例,患有表皮生长因子受体(EGFR)p.L858R 突变的转移性非小细胞肺癌(NSCLC)。在接受三个月的厄洛替尼一线治疗后出现病情进展,遂开始接受铂类/培美曲塞治疗,随后取得两年多的缓解。病情再次进展后,对脊椎转移瘤进行分子检测,发现除了已知的EGFR p.L858R突变外,还存在ROS原癌基因1(ROS1)重排和人表皮生长因子受体2(HER2)p.S310F突变。随后应用克唑替尼并带来了长达 17 个月的持久缓解。对复发性胸腔积液中获得的肿瘤细胞重新进行分子检测,结果显示不存在ROS1重排,而EGFR和HER2突变仍然存在。在克唑替尼中加入阿法替尼后,联合治疗为患者带来了持续两年以上的缓解。患者在最初诊断转移性NSCLC后 7 年多去世。该病例表明,对转移性NSCLC进行多次分子检测可能会发现新的可用药变异,从而影响患者的临床管理并改善患者预后。
背 景
指南建议对转移性非小细胞肺癌(NSCLC)患者进行多次肿瘤基因检测,以指导疾病进程中的治疗决策。理想情况下,如果检出可靶向驱动突变则可应用靶向治疗。关于可能改变靶向治疗反应的共突变,目前了解有限。因此,在这种情况下,决策时需要审慎。
病 例
患者女,70 岁,从不吸烟,在运动时出现咳嗽和呼吸困难。CT和FDG PET-CT显示肺舌段有毛刺状结节、双侧肺结节和局部区域淋巴结肿大。通过支气管肺泡灌洗(BAL)和支气管肿块活检诊断为原发性肺腺癌(TNM分期第 7 版:cT4、cN3、cM1a、IV期)。肿瘤DNA NGS检测显示在 21 号外显子中存在经典的表皮生长因子受体(EGFR)突变(p.L858R;c.2573T>G)。此外,通过荧光原位杂交(FISH)检测到MET扩增(平均拷贝数 9;MET/CEN7比率 2.4)。患者于 2015 年 11 月开始使用厄洛替尼(150 mg/d)一线治疗,病情稳定。2016 年 2 月,患者因肺部进展出现咳嗽和呼吸困难加剧。对BAL获得的癌细胞进行分子检测,未发现EGFR T790M突变,遂开始使用卡铂和培美曲塞治疗,随后以培美曲塞作为维持治疗,部分缓解 32 个月。2018 年 11 月,患者因第 12 胸椎病理性骨折接受脊柱手术。对手术时切除的硬膜外肿瘤组织进行了分子检测。除了最初的EGFR p.L858R突变外,还发现了人表皮生长因子受体2(HER2)突变(p.S310F,c.929C>T)。FISH检测显示ROS原癌基因1(ROS1)呈阳性(39% 的肿瘤细胞核中有分裂信号,图1)。此外,FISH显示MET扩增持续存在(平均拷贝数 4.6;MET/CEN7比率 2.2)。
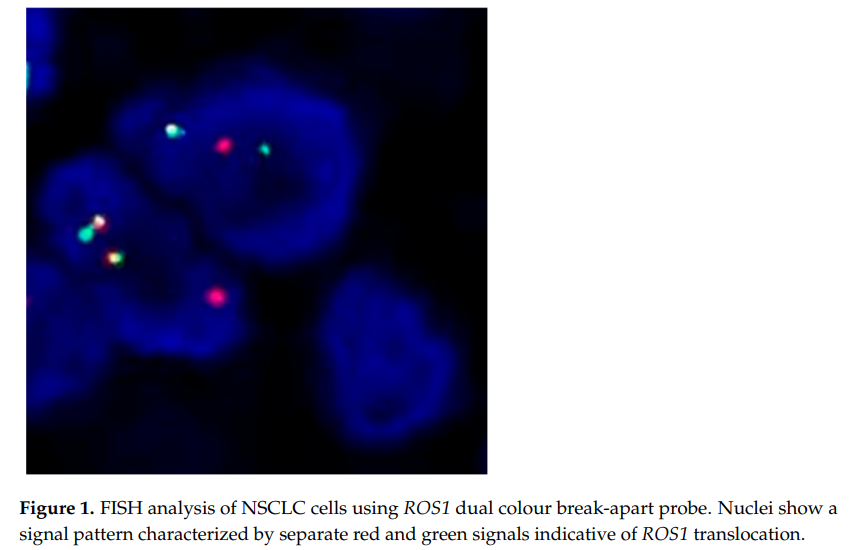
▲图1 ROS1 FISH检测结果
2019 年 2 月开始接受克唑替尼单药三线治疗(250 mg,每日两次),产生了持续 17 个月的部分缓解,直到 2020 年 7 月,肺部和胸膜再次出现疾病进展。对胸腔积液中的肿瘤细胞进行了分子检测,结果显示持续存在EGFR p.L858R和HER2 p.S310F突变,但没有ROS1融合转录本。此外,ROS1 FISH检测也呈阴性。由于胸腔外的病变保持稳定,研究人员认为对克唑替尼治疗有反应,因此继续使用克唑替尼,并于 2020 年 10 月添加了泛HER抑制剂阿法替尼,剂量为 30 mg/天,用于靶向EGFR和HER2。随后由于患者出现水肿,不得不将克唑替尼剂量减少至每隔一天 200 mg,阿法替尼因皮肤毒性而减量至第一、第二天每天 20 mg,第三天休息。在剂量调整后可以观察到具有临床获益的部分缓解,持续两年(图2)。不幸的是,患者于 2022 年 11 月因病情恶化和疑似副肿瘤性多发性梗塞性痴呆导致精神错乱而出现病情恶化,并于 2022 年 12 月去世,距最初诊断为转移性NSCLC已过去七年多。图3总结了疾病过程中的分子学发现。
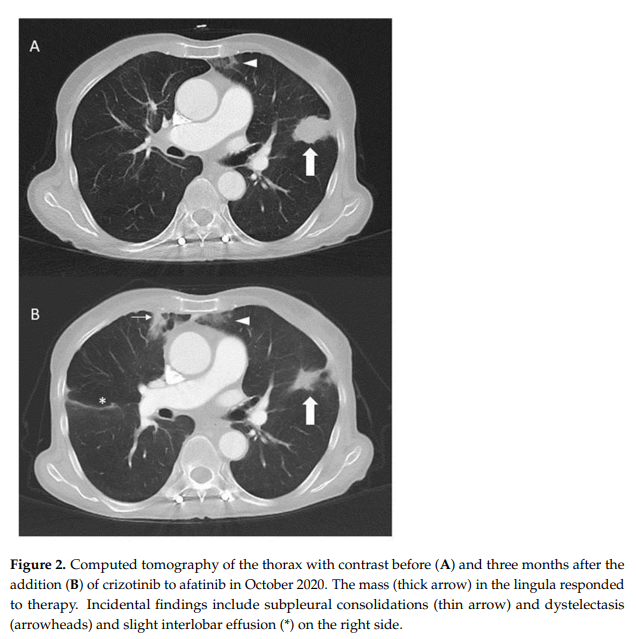
▲图2 应用阿法替尼联合克唑替尼前(A)和三个月后(B)的CT影像
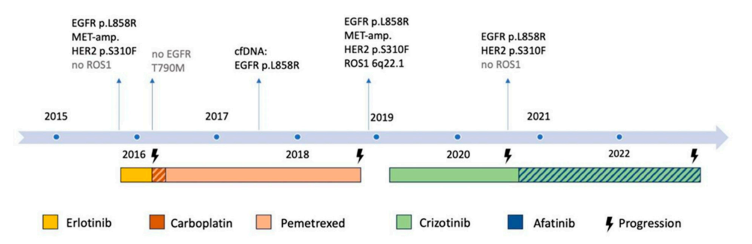
▲图3 病程中分子检测结果和治疗概述
讨 论
本文描述了一位从不吸烟的女性患者的病史,该患者罹患转移性肺腺癌,在病程中检出EGFR p.L858R突变、HER2 p.S310F突变、MET扩增以及ROS1重排。本文病例说明了在接受靶向治疗的NSCLC患者中,多次进行分子检测对疾病进程至关重要,国际指南也建议进行多次检测。
西方人群中 10–20% 的肺腺癌患者会发生EGFR突变。本例患者使用选择性EGFR酪氨酸激酶抑制剂(TKI)厄洛替尼治疗后疾病控制时间较短。尽管EGFR p.L858R突变患者的预后不如EGFR 19号外显子缺失患者,但厄洛替尼一线治疗通常可使无进展生存期达到 12 个月。厄洛替尼治疗缓解持续时间较短的原因之一可能是首次诊断时发生了MET扩增。据报道,在对第一代EGFR TKI产生获得性耐药的患者中,约有 5% 出现MET扩增;在未接受EGFR TKI治疗的患者中,也很少同时出现MET扩增。HER2 p.S310F突变也有可能是导致本文患者对厄洛替尼疗效降低的原因之一。使用较大panel进行的事后NGS检测显示,该突变在诊断时已经存在。
在EGFR TKI治疗进展后,基于培美曲塞的化疗为患者带来持续两年多的缓解。令人惊讶的是,在培美曲塞治疗进展时对NSCLC进行分子学复检,FISH检测发现了ROS1重排(39% 的肿瘤细胞有分裂信号)。然而,对肿瘤RNA进行事后分析时无法检测到ROS1融合转录本。在初次诊断时并不存在ROS1易位,对初次诊断时获得的肿瘤细胞进行的事后检验证实了这一点。与ALK或EGFR阳性疾病相比,ROS1变异的NSCLC患者使用培美曲塞的预后更好。ROS1和EGFR基因的共突变极其罕见。
根据ROS1 FISH的阳性结果,开始使用克唑替尼(一种抑制ROS1、MET和ALK的TKI)进行系统性治疗。PROFILE 1001试验对克唑替尼进行了研究,结果显示其对ROS1变异NSCLC有效,且缓解时间长(中位缓解持续时间 24.7 个月;95%CI 15.2-45.3)。本文患者取得了 2 年的临床获益,这表明ROS1可能是肿瘤进展的驱动因素,而不是MET。患者在接受克唑替尼全身治疗约 15 个月后出现新的胸腔积液。有趣的是,ROS1易位消失,而已知的EGFR和HER2突变仍然存在。将泛HER抑制剂阿法替尼添加到克唑替尼中以靶向HER2和EGFR突变,再次延长缓解时间超过 2 年。阿法替尼不仅对经典EGFR有一定活性,而且对HER2突变肿瘤也有一定活性。此外,阿法替尼已成功用于治疗一名转移性肺腺癌患者,该患者同时携带EGFR p.L858R突变和HER2 p.S310F突变。最近的INSIGHT2研究显示,首选方法是使用联合疗法同时抑制所有检测到的变异,而不是针对假定的耐药突变进行单一药物治疗。在该研究中,对于患有EGFR突变且以MET扩增为耐药机制的NSCLC患者,奥希替尼联合使用特泊替尼的客观缓解率(ORR)明显高于特泊替尼单药(54.5% [95%CI 32.2–75.6] vs. 8.3% [95%CI 0.2–38.5])。根据这一观察结果,从检测到耐药突变开始,最好立刻使用阿法替尼联合克唑替尼治疗本文患者。
本文病例强调了在NSCLC靶向治疗期间多次进行分子检测的重要性,以便在疾病过程中进行个性化治疗。由于肿瘤异质性,当携带不同EGFR或其它基因变异的亚克隆肿瘤细胞与仍携带EGFR敏感突变的肿瘤细胞共存时,可能会出现EGFR TKI的混合反应和寡进展。随着分子检测的深入和广泛应用,在TKI治疗过程中共突变的存在和新的耐药突变的出现对临床实践的挑战越来越大。目前,对于携带经典EGFR突变(19 号外显子缺失或 21 号外显子L858R突变)的肺癌患者,一线治疗通常是奥希替尼(第三代EGFR TKI),联合或不联合化疗。ROS1重排导致的耐药极为罕见,尽管也有相关报道。本文病例报告强调了在疾病进展的情况下多次检测分子变异的重要性。对于携带EGFR、HER2、ROS1和MET变异的 NSCLC患者,阿法替尼联合克唑替尼治疗可产生持久缓解,并且在剂量调整后耐受性良好。
参考文献:
Plomer, E.; Früh, M.; Lauber, A.; Demmer, I.; Jochum, W.; Koster, K.-L. Prolonged Response to Afatinib and Crizotinib in a Rare Case of EGFR-, HER2-, MET- and ROS1-Alterated Lung Adenocarcinoma. Int. J. Mol. Sci. 2024, 25, 5698. https://doi.org/10.3390/ijms25115698



