特别关注|肝癌类器官的研究进展
时间:2024-08-11 06:00:39 热度:37.1℃ 作者:网络
肝癌在各类致死癌症中位居第四位,是我国第六大常见癌症疾病。我国肝癌的发病率位居世界前列,患者预后效果差且致死率高。肝癌治疗一般以手术切除和化疗联合为主,多数患者由于其发现病症时已经处于肝癌中晚期,治疗效果并不理想。近年来,尽管肝癌治疗方式不断完善,如手术、微创介入、免疫、靶向治疗等,患者5年生存率有了一定提高,但整体治疗效果仍不理想。因此,开发新型抗肿瘤药物以及个体化药物迫在眉睫,而抗肿瘤药物从研发到临床应用肿瘤模型的选择至关重要。
肝癌研究的传统模型包括体内模型和体外模型两种,由于肝脏疾病存在明显的异质性,而传统肝癌研究模型对于细胞真实形态、空间结构和细胞微环境无法完全准确反映及表达,故研究结果无法应用到临床实践;动物模型的种属差异性限制了其在临床研究的延续性。致力于反映人体真实情况的肝癌模型是研究者梦寐以求的目标,类器官作为一种新型体外模型,不仅弥补了传统模型不准确、不全面、不稳定的缺点,还为肝癌免疫研究和血管生成等微环境研究提供了可能性,并可用于高通量药物筛选和生物样本库的构建。类器官模型将在精准治疗与再生医学方面提供更大的潜力。
1肝癌的发病机制
目前已知肝癌的发生和发展是一个多基因、多步骤、多阶段的复杂过程,肝癌通常由慢性肝炎、肝硬化逐渐发展而来,是一种典型的炎症驱动的肿瘤。肝脏长期处于刺激环境(HBV、过度饮酒等)会产生炎症反应,经长期积累最终导致肝癌发生。肝癌发病机制主要由两方面导致,其一是原癌基因的激活,在正常生物体内均存在原癌基因,但一般处于低表达或不表达状态,而在病毒感染或者辐射的作用下,原癌基因就会被激活转变成为癌基因,诱导细胞发生癌变。其二是抑癌基因失活,抑癌基因的作用是具有潜在抑癌作用,抑癌基因与原癌基因相互制约,如果抑癌基因发生突变导致其调控细胞增殖和分化作用失活,则最终造成细胞恶性增殖进而发展成为肿瘤。
近年来发现多种信号通路异常也会导致癌变,例如在动物胚胎发育早期、Wnt信号通路(形成器官)活化异常可能会促进肝癌的发生。Notch信号通路、Hedgehog信号通路及生长因子异常都与肿瘤的发生有关。尽管针对肿瘤的研究日益增加,但成效均不乐观。肝癌能够通过多种机制逃逸免疫杀伤,继续发展并转移,早期肝癌可手术切除或肝移植治疗,但对于晚期肿瘤虽然使用靶向药物治疗可延长患者寿命,但是治疗效果及预后不是很理想,因此现有的治疗策略不能有效控制肝癌生长和复发,对肝癌发病机制的研究及治疗手段的探索依然是研究的热点问题。
2类器官概述
类器官是指由干细胞或器官祖细胞以一种类似体内细胞分化的形式组织成器官特异性的细胞集合。Nuciforo等对于类器官的定义主要有3个基本要求。首先要有一个以上的器官细胞类型;其次需具备该器官的一些功能;最后具有该器官的相对应空间结构。Huch等对类器官提出了一个可能更准确的概念,将类器官定义为一群来自体外的3D细胞群,并且如果是来自于组织的干细胞或者多能干细胞(PSC),还具有自我更新和组织的功能,最终呈现出具有原始器官结构和功能的细胞体系。肿瘤类器官是一种恶性细胞团,且可利用原代恶性细胞保留原代肿瘤的病理学形态特征、基因组与转录组特征、药物敏感性及恶性细胞间异质性,还可以持续增殖。
机体内细胞处于一个十分复杂的微环境,会受到各种调控,包括细胞内和细胞外的一些化学信号、物理信号,而细胞外基质是这些信号相互作用的关键区域。理想的肿瘤模型应能在体外重现体内肿瘤的特征,比如一些基因组特征、组织学形态特点、恶性细胞间异质性及肿瘤微环境。在传统的培养模型中,仅能构建出单维度细胞间的联系,而类器官的培养则可有类似体内组织器官的相互作用。目前研究构建出胃、脑、肝脏等多种体外类器官。类器官模拟肿瘤等疾病的发生发展相关研究和类器官药物敏感性的检测研究越来越引起学者高度重视。
类器官所建立的环境复杂且具有生理生物学特征,会影响到诸如细胞形态、活性、细胞增殖与迁移等多个方面。研究表明,如果可将多能干细胞诱导并且分化成器官祖细胞,那么原则上就可以产生相应的类器官。但目前该模型依然存在不足,如无法完全重现体内肿瘤微环境,使其在临床方面的应用仍然受限。
3肝癌类器官的构建和培养
3.1 类器官的构建
3.1.1 选择适宜的细胞
类器官构建所选择的细胞需要具有自我更新的能力,以及可被诱导分化为不同类型。由于肝脏的结构比较复杂,较难形成具有功能的小叶结构,导致体外的原代肝细胞培养和扩增一直难以实现,目前随着干细胞技术发展才使其成为可能。在此基础上通常会选择胚胎干细胞(ESC)、诱导性多能干细胞(iPSC)和来自组织器官的干细胞以及祖细胞作为种子细胞,以上细胞各自存在优缺点。
ESC大多都是从囊胚期的内细胞团提取,其分化潜能比较高,在异体移植时不会存在排斥反应,理论上是比较理想的构建类器官的细胞,但是不能排除有致畸的可能性,而且由于涉及到胚胎,所以存在伦理争议等问题。
iPSC是由日本科学家山中伸弥将已分化的体细胞通过导入4种转录因子使其发生重编程而获得的,同时也具有分化的能力。由于诱导iPSC的过程不涉及到胚胎,伦理争议较小,故应用较为广泛。然而重编程会影响基因组的稳定性,所以iPSC发挥作用的具体机制需要进一步探究。
来源于组织器官的干细胞和祖细胞,其培养方式相对较便捷,能够特定分化,所以针对性比较强,但是其只能分化与来源组织相似的一种或几种,相较于前述的两种细胞其应用范围较窄,限制性较高。
3.1.2 选择培养载体支架
在三维培养过程中,“细胞基质”和“细胞沟通”起到了重要的作用,因此需要选择一个合适的支架作为结合载体。支架的作用不仅是为细胞提供适合生长的环境,还可以促进细胞的生长和黏附。支架的选择取决于类器官构建的需求,不同类型的支架各有其优点,根据类型不同分为两种支架,一种是合成聚合物支架,其合成技术较成熟,机械强度高,价格低廉;另一种是生物聚合物支架,生物活性好,且能够促进细胞和组织之间的相互作用。
随着技术的不断发展,逐渐发现了一些新类型的支架,例如脱细胞支架、水凝胶等,均各有优势并且应用在不同环境中。脱细胞支架主要用于除去离体组织器官中的细胞,同时能够保留器官的基本形态和结构,由于这一优势,使其能够更好地适配于细胞动态多变的内环境。天然状态的水凝胶可以从胶原蛋白、纤维蛋白等聚合材料中获得,含水量高且毒性低,在水凝胶中的细胞会均匀分布在各处,不仅起到支撑的作用,还可以通过可溶性细胞因子,所以水凝胶常用于骨、软骨、血管等组织工程中。此外,Ng等发现聚乙二醇丙烯酸酯可构建胆管类器官;石墨烯疏松多孔可以运输氧气,而且可降解,故可以用于心脏、软骨、神经元等组织的构建。合成支架使用时需配合细胞外基质蛋白,将细胞外基质蛋白涂在表面可以促进细胞黏附,Ⅰ型胶原相比于细胞质基质蛋白等其他蛋白效果更好。
3.1.3 选择合适的细胞因子
培养类器官时需要进行培养基的选择,根据不同类型类器官的需求选择加入不同的细胞因子。表皮生长因子(EGF)、肝细胞生长因子(HGF)和成纤维细胞生长因子(FGF)等细胞因子可以促进细胞的增殖,待细胞大量增殖到足够的数量便可以进行下一步。接着根据实验的需求定向分化目的细胞。例如:如果要分化为肝细胞可以用骨形态发生蛋白或是地塞米松等细胞因子;如果需要诱导为肝胆细胞,则需要在培养基中加入一定量的mTeSR。
3.2 类器官培养
多种细胞的共培养起到两个主要作用。一是为细胞的分化提供所需细胞因子来诱导细胞分化,如间充质干细胞与肝细胞共同培养4周就可以获得肝样细胞,细胞损伤释放出细胞因子也可以使间充质干细胞转化为肝细胞。二是促进类器官的构建和形成,肝细胞和星状细胞如果进行共培养,肝细胞便会聚集在星状细胞周围形成一个大的团块。肝癌类器官的构建过程参见图1。
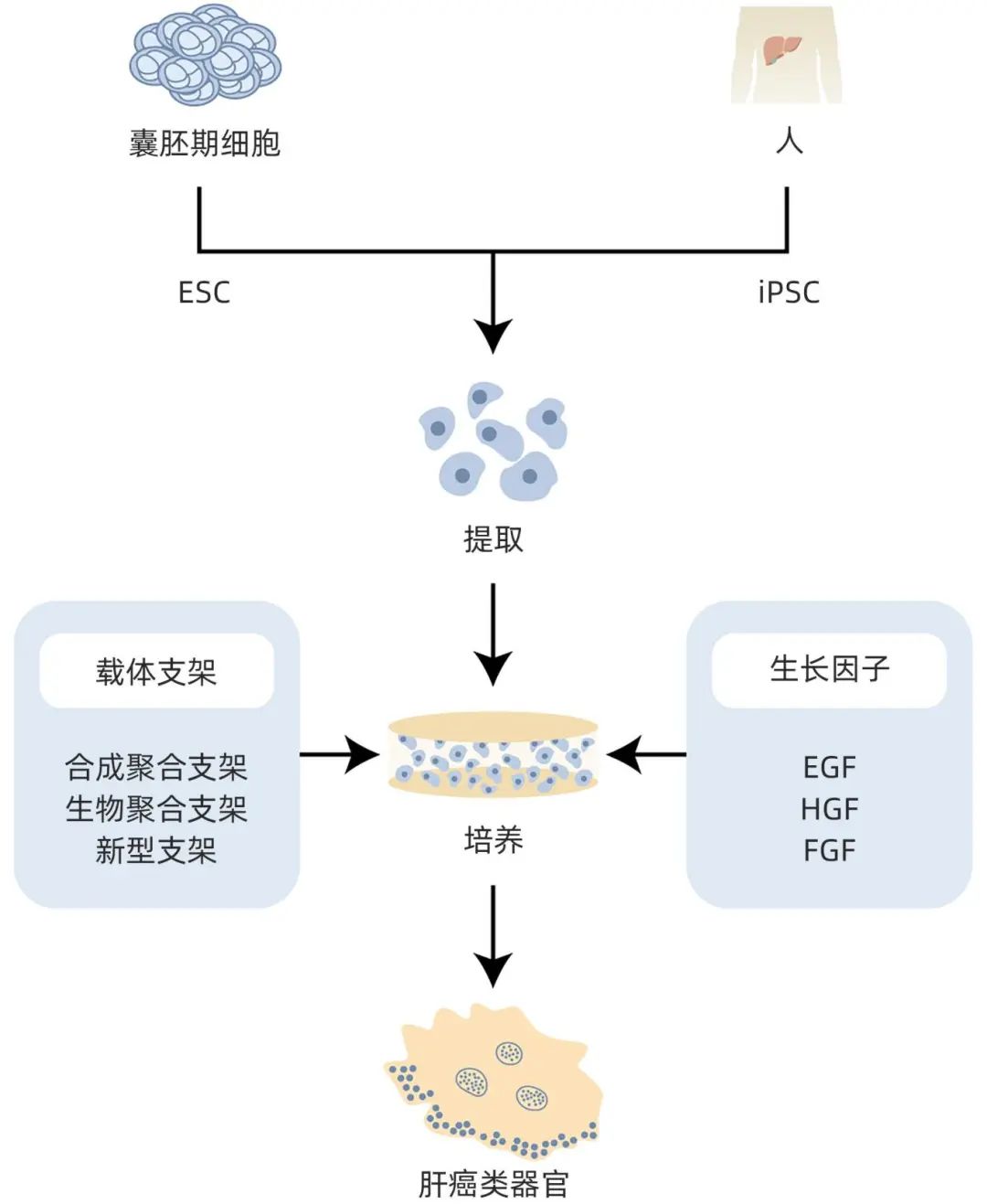
注:对ESC或iPSC进行提取和培养,加入所需的细胞因子EGF、HGF、FGF等,载体支架为细胞提供生长环境,在培养皿中进行培养待其长成初步具有形态的类器官。
图1 肝癌类器官的构建过程
3.3 类器官培养的细胞来源
类器官按照来源分类可分为组织来源和细胞来源两大类。组织来源一般是先将组织(组织的选取应从器官的各个位置进行取样)剪碎后用酶消化,不同类器官构建所用的酶和时间均不同,消化后过筛,通过台盼蓝染色观察分离细胞状态,若细胞状态良好则可以将其种到培养板进行培养,同时给予特定的生长因子,后续即可进行培养和传代。用细胞构建类器官现阶段有两种方式,其一是通过转染方式成功构建肝癌类器官;其二是将肝星状细胞、肝癌细胞及肝窦内皮细胞按一定比例混合构建类器官。由于对类器官的研究较少,故这两种方法都需要进一步研究其确切机制及稳定性。
对肝癌类器官早期研究一直集中于测试和验证该系统的准确性和遗传特征。如患者来源的肝癌类器官,可保留器官部位特异性的组织学和遗传特征,从而有助于个体化治疗,但是由于其复杂性以及成功率不高限制了广泛应用。鼠肝肿瘤来源类器官,由于肿瘤细胞增殖迅速,使得来自肿瘤类器官的单个细胞具有很高的起始效率,并且此类类器官能够在小鼠体内促进肿瘤的发生,在一定程度上模仿肝癌患者在表型、癌细胞组成和治疗方面的异质性,但是不能用于研究癌症的起始。原代人肝细胞修饰的肝肿瘤类器官,通过重编程成纤维细胞而生成,由于该类类器官来源于正常的肝细胞,故可以用来模拟肝癌的发病机制;癌细胞自组装肝肿瘤类器官则更接近人类疾病的进程,因此具有很好的前沿性,尤其在研究肝癌发生过程中细胞间(癌细胞和非实质细胞之间)的相互作用以及创新治疗方面,但其处于研究初期,仍需要进一步的研究与证明。目前类器官正在逐步改进,研究者致力于发现一个可以更好、更经济的新型模型,以代替传统2D细胞模型或者是小鼠模型,新型模型-类器官的发现,可进一步应用于肿瘤方面的相关研究。
4肝癌类器官的应用
4.1 药物筛选
药物筛选是新药研发的关键步骤,而类器官具有稳定的基因组,更接近人体细胞的生理状态并且更适合于生物转染和高通量筛选。此外,类器官不仅可以用于药物研发阶段,还可以用于临床前试药,通过对患者来源类器官的分析,能够了解遗传学变化的原因,为后续治疗提供数据支撑。Li等用肝癌类器官进行药物筛选,从胆管癌手术标本不同位置取材,构建27个肝癌类器官细胞株并用129种抗肿瘤药物进行筛选,最后仅有一小部分药物广泛有效,表明应用肝癌类器官可以达到筛选药物的作用。由于肝脏是负责药物代谢的主要器官,肝脏类器官也被用于研究治疗带来的潜在副作用。
4.2 疾病建模
由于类器官可以高度模拟组织的生理结构、功能以及发育和分化的过程,不仅可用于研究肝脏肿瘤的起始,还可以研究肝脏肿瘤的微环境,因此肝癌类器官可以作为一种良好的体外预测模型。通过建立类器官生物库,将患者肿瘤特征与生物库中的类器官进行对比,从而为患者选择更为精准的治疗方案。
4.3 再生医学
肝移植是治疗肝纤维化、肝癌等疾病最有效的方法之一,但适合进行移植的组织缺乏,导致肝移植存在一定局限性,而肝脏类器官的出现为此提供了一种可能性。有学者对肝脏类器官培养体系进行了改进,使其存活率大大增加,还能够分泌更多的白蛋白。Sampaziotis等建立的不同胆囊区域(肝内胆管、胆总管和胆囊)类器官模型的效果良好,修复了人类肝脏的胆管系统,为临床研究提供了实验基础。
4.4 个性化医疗
个性化医疗也称为精准医疗。肿瘤具有异质性,从而导致个体差异显著,对肿瘤药物的研究难点亦在于此。肝癌类器官较好地解决了该问题,在肝癌类器官培养过程中保存了原始肿瘤基因的特征,故而对临床肿瘤样本进行取样与诱导形成具有该患者肿瘤特征的肝癌类器官,对后续研究与治疗都更为便利。将类器官应用于肝癌研究的另一个前沿方向是使用从类器官收集的组学分析来间接指导临床用药,通过RNA测序还有代谢组学的分析,可推测药物对肝癌细胞系的生长是否起到抑制作用,为药物疗效的评价提供依据。
4.5 生物标志物
通过分子分析方法,包括蛋白质组学、代谢组学、转录组学,能够发现一些关键的生物标志物,可对辅助诊断和精准医疗起到重要作用。胰腺和结直肠癌患者来源的类器官已经通过组学分析,将遗传、转录信息与药物作用建立了联系,但是肝脏类器官由于样本量小而尚未建立。
5类器官的难点及不足
肝癌类器官作为一种具有前景的体外研究模型,仍存在缺点和不足。肝脏类器官的培养和应用处于早期阶段,其代谢功能尚不成熟,且肝脏类器官所包含的细胞种类也不是很全面,因此对于后续的使用和研究存在局限性。类器官是否能培养成功,与诸多因素有关,如原始肿瘤的分化程度、肿瘤细胞的增殖率、类器官尺寸和形态的不确定性均会影响类器官的构建。对于类器官的培养亦不十分清楚,如生长因子的具体浓度配比以及相关机制等,不仅如此,目前培养出的肝癌类器官并不完全符合肿瘤细胞微环境。肝癌类器官可执行大多数肝脏功能,例如药物代谢等,但能力无法与成熟的成人肝脏相比较,转录组学研究表明,其功能与胎儿肝脏相似。开发更全面的肝脏类器官,包括间质、血管还有神经,可以更好地揭示肝细胞与基质的相互作用,诠释肝癌细胞和肿瘤微环境之间的关系。此外,类器官的技术亦存在问题。首先,类器官的建立过程和质量缺少全球范围的标准化,各实验室在进行操作时重复度比较低。其次,类器官的建立无法完全概括正常肝脏在体内的复杂环境,并且过程中有可能会出现血管化,由于类器官的不断生长,可能出现缺氧的情况,导致代谢废物积累、组织坏死。2018年,Jin等开发了一个3D-iHep(3D-induced hepatic)类器官芯片培养系统,在动态的细胞外基质环境下培养的类器官改善了血管化的问题。
此外,免疫系统和基质成分的缺乏亦会影响肿瘤细胞-基质-免疫相互作用构建肝癌类器官。患者来源的异种移植物能够保留肿瘤组织病理学,包括肿瘤浸润淋巴细胞、基质成分、患者恶性上皮细胞的整体基因表达和甲基化谱等,从而解决上述问题,但类器官培养植入率低、周期长、成本高,不适合大规模的药物敏感测试。原发性肝癌类器官的出现为此带来了转机,其不仅保留了原始肿瘤的组织学结构,而且适用于大规模的药物测试,与个性化医疗兼容。有研究表明肿瘤类器官亦可以通过免疫细胞浸润进行重建,并且这些重组的肿瘤类器官能够很好地模拟抗PD-1或PD-L1抗体的治疗效果,但具体机制仍需要进一步研究。
6小结
综上所述,肝癌类器官在药物开发、癌症研究、疾病建模、再生医学、精准医疗和器官移植等研究领域显示出巨大潜力。相较于传统模型,肝癌类器官能够更完整地模拟原肿瘤细胞的微环境。前期的药物研究均基于传统模型,结论具有普遍性,而肝癌异质性的存在导致传统模型无法适应个体间不同的肿瘤特征,若根据不同个体构建对应的类器官,这对于药物筛选和研发将具有很大的帮助。未来需对类器官进一步研究和探索,形成标准化制备流程与质量控制标准,为科学研究和临床治疗提供新思路和新方法。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCH240730



