特别关注|脂肪自噬在非酒精性脂肪性肝病防治中的作用
时间:2024-08-11 06:00:48 热度:37.1℃ 作者:网络
非酒精性脂肪性肝病(NAFLD)是除外酒精和其他明确的损肝因素诱导肝内脂质蓄积及肝细胞脂肪样变,导致肝脏代谢应激性损伤的病理综合征,根据疾病发展的不同阶段可分为非酒精性单纯性脂肪肝(NAFL)、非酒精性脂肪性肝炎(NASH)、肝硬化和肝细胞癌。NAFLD在全球的患病率从2005年的25.5%上升到2016年的37.8%;2008—2018年我国NAFLD的患病率为29.2%。目前NAFLD在全球患病率持续增长,是医疗防治的重点内容,制订相关防治策略十分必要。脂肪自噬是一种靶向选择性自噬,通过自噬对脂滴进行选择性降解,从而维持脂质稳态。在NAFLD防治过程中,脂肪自噬具有促进脂肪分解、缓解肝细胞脂肪变性等作用,是NAFLD防治的重要研究方向。
1脂肪自噬的概述
自噬是一种自我降解过程。在去除错误折叠或聚集的蛋白质、清除受损细胞器以及消除细胞内病原体方面起着重要作用。自噬包括大自噬、微自噬和伴侣介导的自噬三种定义类型。脂肪自噬是自噬的一种亚型,属于分子伴侣介导的自噬,在维持细胞脂质稳态方面发挥重要作用,脂滴由分子伴侣蛋白识别并结合带有特定氨基酸序列的可溶性蛋白质,再经过溶酶体膜上的受体转运到溶酶体内,从而被水解酶降解。
脂肪自噬最早是在肝组织中发现,现已被证明存在于许多非肝脏组织,包括神经元、脂肪组织、肾小管细胞、泡沫巨噬细胞等。脂滴中间为胆固醇酯和甘油三酯,周围环绕着磷脂单分子层和部分脂滴相关蛋白。有研究表明脂肪分解与脂肪自噬可能是连续的途径,脂肪分解以较大的脂滴为目标,产生小脂滴和新生合成的小脂滴,这些小脂滴再通过脂肪自噬代谢。脂肪自噬过程大致相同,通过热休克同源蛋白(HSC70)和溶酶体相关膜蛋白2A(LAMP2A)协同作用介导降解脂滴的外壳蛋白(Perilipin 2和Perilipin 3),脂滴的外壳蛋白降解后,允许脂肪酶和脂溶性细胞器进入并进行脂肪分解。微管相关蛋白1A/1B-轻链3(LC3)阳性膜吞噬小脂滴,并将其运送至溶酶体,被溶酶体内的酸性脂肪酶降解,产生的脂肪酸也在线粒体中参与β氧化途径(图1)。
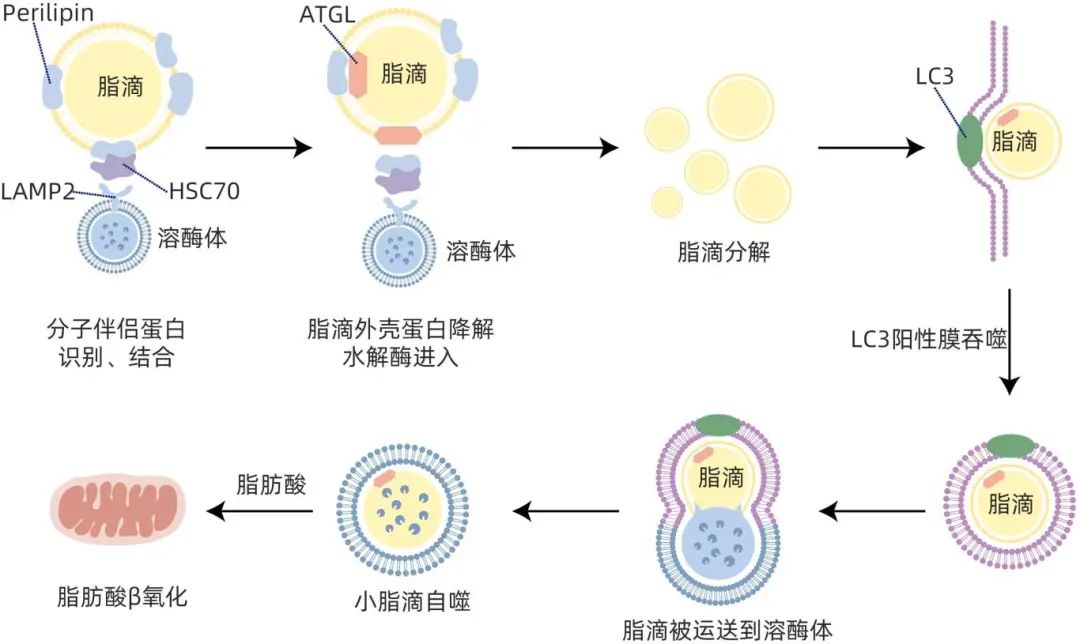
注:ATGL,脂肪甘油三酯脂肪酶。
图1 脂肪自噬过程
脂肪自噬的发生需要一定的条件。机体按照糖类、脂质、蛋白质的顺序进行氧化分解供能,当糖类物质不足时,脂质方能分解。研究表明饥饿状态可促进脂肪的自噬分解,其启动机制与哺乳动物雷帕霉素靶蛋白(mTOR)通路和腺苷酸激活蛋白激酶/UNC-51样激酶1[AMPK/ULK1]通路有关。在饥饿条件下AMPK活化,mTOR失活,活化的AMPK催化ULK1相关丝氨酸发生磷酸化,从而促进自噬。
2NAFLD与脂肪自噬
肝脏是脂肪生成和脂质氧化的主要场所,也是脂质代谢的中枢器官。脂质以三酰基甘油(TAG)的形式储存在脂滴中,肝脏通过脂肪分解和脂肪自噬维持脂质的稳定状态。NAFLD包括一系列脂肪性肝病的发展过程,在相关诱因下肝内脂质代谢失调,脂肪过度积累,出现肝脂肪样变发展为NAFL,随着肝细胞功能受损,肝脏慢性炎症、纤维化,进一步进展至NASH及其肝硬化,甚至肝癌。肝细胞脂质积累和脂肪样变是NAFLD的核心,脂质积累超过了的肝脏代谢能力会影响脂肪自噬能力,脂肪自噬功能下降则影响脂质的消耗,形成恶性循环。恢复脂肪自噬功能、调节肝细胞脂质稳态在NAFLD的治疗中至关重要。脂肪自噬包括脂滴分解、脂滴自噬、脂肪酸β氧化三个过程,通过促进脂肪自噬对NAFLD具有积极作用。有研究证实肝脏脂滴降解与脂肪自噬作用相关,在脂肪自噬受损的条件下,肝脏整个脂质含量,特别是TAG水平增加,肝脂肪自噬受损促进了NAFLD的病理学改变。此外,有研究进一步表明脂肪分解和脂肪自噬在维持TAG及胆固醇代谢稳态方面起着协同作用。由此提示NAFLD的发生与脂肪自噬功能关系密切,脂肪自噬是防治NAFLD的重要方向(图2)。
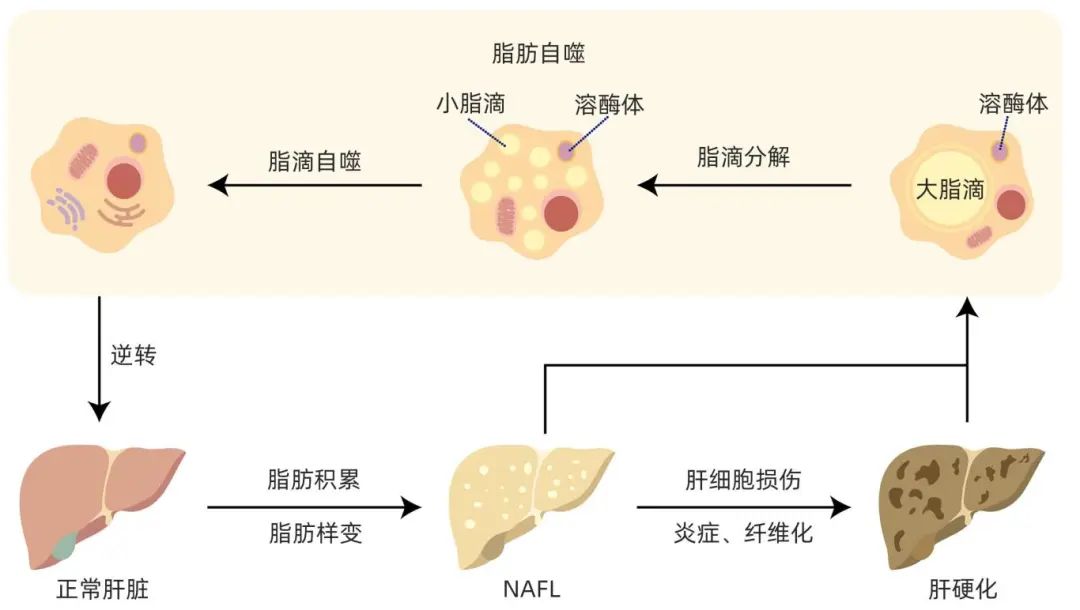
图2 NAFLD发展过程及其脂肪自噬的作用
3NAFLD中脂肪自噬的相关靶点
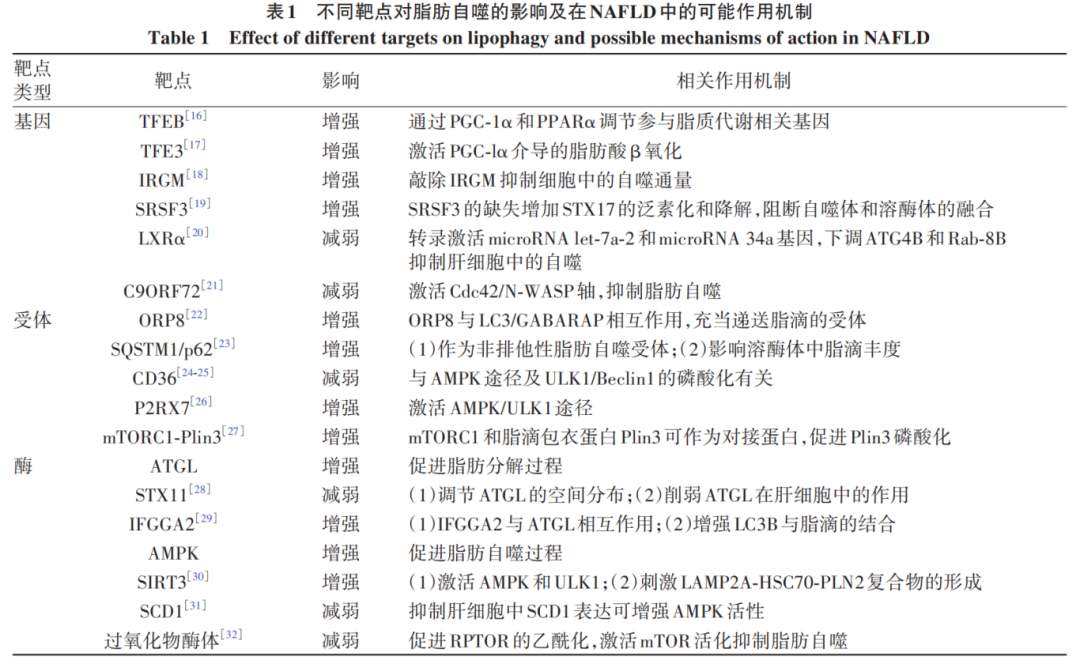
脂肪自噬的过程比较明确,但其分子机制十分复杂,涉及基因、受体、酶、信号通路等方面。自噬的驱动受多种因素调控,这也为NAFLD的防治提供了相关靶点。
3.1 NAFLD中脂肪自噬的基因靶点
研究者使用定制siRNA阵列结合高含量胆固醇外排测试筛选候选脂肪自噬因子(共91个),发现最显著下调胆固醇外排的基因是微管相关蛋白1轻链3α(Map1LC3α);其他已知的自噬调节因子包括自噬转录因子EB(TFEB)及其下游基因紫外线抵抗相关基因和黏脂蛋白TRP阳离子通道1、自噬相关蛋白5(Atg5);此外敲低已鉴定的脂滴相关蛋白、分子伴侣、溶酶体蛋白、中性脂肪酶以及单体GTP酶的相关基因,包括高迁移率族蛋白B1/B2、热休克蛋白5和清道夫受体B类成员2,均降低了胆固醇外排,由此表明这些基因在脂肪自噬中起到了积极作用,但相关机制有待进一步研究。
3.1.1 基因对脂肪自噬的促进作用
NAFLD中脂肪自噬的相关基因研究较多,部分基因表达可通过促进脂肪自噬的作用预防NAFLD。TFEB和转录因子E3(TFE3)是调节溶酶体功能与自噬的关键因子。Settembre等研究表明TFEB通过饥饿诱导自动调节反馈回路,并通过过氧化物酶体增殖受体γ辅激活因子1α(PGC-1α)和过氧化物酶体增殖物激活受体α(PPARα)调节参与脂质代谢的相关基因,此外饥饿引起的肝脂肪分解代谢与TFEB调节的脂肪自噬途径有关。Xiong等研究发现TFE3基因过表达可显著缓解肝细胞脂肪变性,这依赖于其诱导的脂肪自噬和PGC-1α介导的脂肪酸β氧化。免疫相关的GTP酶家族M(IRGM)基因是一种自噬相关基因,Lin等试验发现IRGM敲除抑制人肝癌细胞(HepG2)和人肝癌亚力山大细胞(PLC/PRF/5细胞)中的自噬通量并增加脂滴含量,而IRGM过表达则导致脂滴含量降低,IRGM可能通过脂肪自噬途径调节肝脂代谢。Li等研究富丝氨酸和精氨酸的剪接因子3(SRSF3),发现其在正常肝脏中高度表达,但高脂肪条件下表达缺失,SRSF3的缺失显著增加突触融合蛋白17(STX17)的泛素化和降解,阻断自噬体和溶酶体的融合并损害脂肪自噬,SRSF3是参与肝脂肪自噬的重要因素,有利于脂滴清除,SRSF3的肝脏特异性过表达可能成为预防NAFLD的潜在靶点。
3.1.2 基因对脂肪自噬的抑制作用
部分基因表达对脂肪自噬具有抑制作用,抑制或敲除某些基因亦可促进脂肪自噬。肝脏X受体α(LXRα)是肝脂肪自噬的负调控因子,Kim等研究发现LXRα通过转录激活microRNA let-7a-2和microRNA 34a基因,下调了自噬相关的半胱氨酸蛋白酶ATG4B和自噬体、溶酶体形成相关的Rab-8B,抑制肝细胞中的自噬,降低线粒体物质合成和能量消耗,最终导致肝脂肪变性和脂肪性肝炎的进展。C9ORF72基因是由6个DNA碱基的重复序列编码,Cang等发现C9ORF72敲减可促进2型糖尿病小鼠肝细胞的脂肪自噬以缓解肝胰岛素抵抗,在肝细胞中C9ORF72与脂肪自噬呈负相关,C9ORF72与胰岛素抵抗刺激的肝细胞内细胞分裂周期蛋白42(Cdc42)相互作用并激活,进而通过促进神经Wiskott-Aldrich综合征蛋白(N-WASP)表达来抑制脂肪自噬,因此C9ORF72通过激活Cdc42/N-WASP轴促进肝胰岛素抵抗,抑制脂肪自噬,敲减C9ORF72可能对胰岛素抵抗的NAFLD具有潜在的治疗作用。
3.2 NAFLD中脂肪自噬的受体靶点
3.2.1 受体促进脂滴与溶酶体的相互作用影响脂肪自噬
脂肪自噬属于分子伴侣介导的自噬,HSC70和LAMP2A可产生协同作用,二者是脂滴和溶酶体表面的重要受体。肝脂肪自噬还有很多其他受体。研究发现氧化甾醇结合蛋白8[ORP8]也可作为一种脂肪受体,其C端跨膜结构域定位在脂滴上,通过油酸或饥饿处理后,ORP8与LC3/GABA A型受体相关蛋白的亚家族蛋白(GABARAP)相互作用,从而充当受体介导脂滴递送至溶酶体以进行降解并释放游离脂肪酸。SQSTM1/p62(sequestosome 1,又称p62)最初是作为聚集体中的泛素结合自噬受体,研究发现在缺乏脂肪自噬受体的情况下,SQSTM1可作为非排他性脂肪自噬受体,其与脂滴共定位,在溶酶体中和脂滴共降解,并能够影响脂滴丰度,同时表明SQSTM1通过影响脂滴的标记、运动、聚集和隔离在脂肪自噬中发挥作用。这些受体通过促进脂滴与溶酶体的相互作用从而影响脂肪自噬。
3.2.2 受体通过激活自噬相关通路影响脂肪自噬
有研究者探究了部分受体的其他通路相关机制。脂肪酸分化转位酶簇(CD36)是一种多功能膜蛋白,也是一种膜受体,可识别多种脂质和非脂质配体,研究表明CD36棕榈酰化的抑制不仅改善了脂肪酸代谢紊乱,而且减少了体外和体内的炎症反应,同时在HepG36细胞中敲低CD36可促进脂肪自噬和β氧化,CD36是自噬的负调节因子,其机制可能与AMPK途径及ULK1/Beclin1的磷酸化有关。P2X7嘌呤能受体(P2RX7)是属于P2XR家族的ATP门控离子通道,激活P2RX7可以激活AMPK/ULK1途径,促进自噬体的生成和溶酶体降解,而抑制P2RX7具有相反的效果。哺乳动物雷帕霉素靶蛋白复合物1(mTORC1)和脂滴包衣蛋白Plin3可作为对接蛋白或参与自噬体形成以激活脂肪自噬,mTORC1通过依赖于Plin3磷酸化的机制调节肝脂肪自噬,刺激这一途径可以增强肝细胞中的脂肪自噬,以促进脂滴降解,帮助保护肝脏免受脂质介导的毒性,从而为NAFLD提供治疗策略。
3.3 NAFLD中脂肪自噬的酶靶点
3.3.1 脂肪分解相关酶
脂肪自噬需要两类酶的催化,一类为脂肪分解相关酶调节脂滴分解过程;一类为自噬相关酶促进自噬过程。脂肪分解需要ATGL驱动,调节脂滴代谢的酶还有中性脂肪酶,如脂肪酶E和羧酸酯酶1,其介导、作用于脂滴表面,目前脂肪分解酶的研究多聚集于ATGL。STX11作为一种囊泡转运蛋白,主要参与人体免疫反应的介导,研究发现STX11也会影响肝脏中的脂质代谢,STX11与ATGL结合,通过调节ATGL的空间分布及削弱ATGL在肝细胞中的作用来抑制肝脂肪分解和自噬;相反,肝细胞中STX11缺乏则有利于脂肪分解。此外,有研究者鉴定了两种防止肝脂肪储存的免疫相关GTP酶(IFGGA2、IFGGA4),确定IFGGA2与脂肪酶ATGL为结合伴侣,两种蛋白质与自噬标志物LC3B(MAP1LC3B,一类广泛使用的自噬标志物)部分共定位,同时发现肝细胞中IFGGA2的过表达可增加LC3B与脂滴的关联并降低甘油三酯的储存,证明了IFGGA2与ATGL相互作用,并通过增强LC3B与脂滴的结合防止肝脂肪变性。
3.3.2 脂肪自噬相关酶
脂肪自噬过程需多种酶的参与,其研究比较多的是AMPK。去乙酰化酶3(SIRT3)是一种线粒体辅酶Ⅰ依赖性脱乙酰酶,研究发现SIRT3过表达激活AMPK和ULK1,从而促进肝细胞脂滴中的自噬,以减轻脂滴积累;同时可刺激LAMP 2A-HSC70-PLN2(perilipin 2)复合物的形成,促进伴侣蛋白介导自噬过程,降低肝细胞脂滴的稳定性,由此证明SIRT3可促进脂肪自噬和伴侣介导的自噬,改善肝细胞中的脂毒性。硬脂酰辅酶A去饱和酶1(SCD1)是控制脂质代谢的关键酶,研究发现抑制肝细胞中SCD1表达导致AMPK活性和脂肪自噬增强,并减少脂质沉积,从而改善肝脂肪变性,提示SCD1-AMPK-脂肪自噬途径是NAFLD的潜在治疗靶点。过氧化物酶体在脂质代谢中起着重要的作用,其通过脂肪酸氧化衍生的乙酰辅酶A介导mTOR调节相关蛋白(RPTOR)乙酰化和mTOR活化,抑制脂肪自噬,因此抑制过氧化物酶体乙酰辅酶A的产生来诱导脂肪吞噬,可能为NAFLD提供一种新的治疗靶点。不同靶点对脂肪自噬的影响及其作用机制详见表1。
4基于脂肪自噬中西医有关NAFLD的防治进展
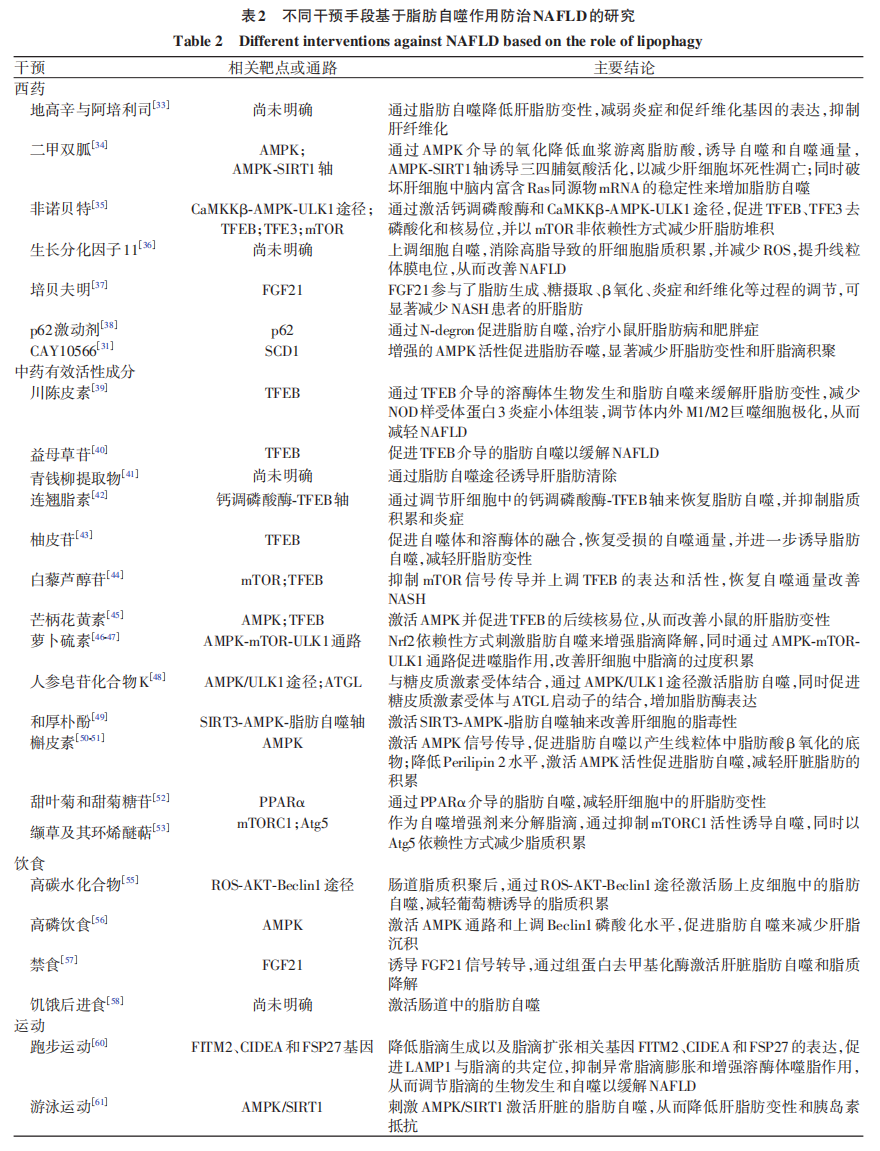
脂肪自噬相关机制为NAFLD的防治提供了重要靶点,目前中药、西药及饮食运动等干预手段基于上述靶点和通路在防治NAFLD方面也取得了重要进展。
4.1 西药通过脂肪自噬作用防治NAFLD的研究
地高辛主要用于心力衰竭和心房颤动的治疗,阿培利司是用于治疗乳腺癌的一种抑制剂,有研究表明这两种药物能显著降低肝脂肪变性,同时可减弱炎症和促纤维化基因的表达,抑制肝纤维化,并证实这种作用与脂肪自噬有关。二甲双胍是治疗2型糖尿病的一线药物,有研究发现其能通过促进脂肪自噬调节脂质代谢,改善脂肪过度堆积,减少肝细胞坏死性凋亡及肝脂肪变性,此过程与AMPK、AMPK-SIRT1轴及mRNA稳定性破坏有关。非诺贝特是一种降脂类药物,其通过激活钙调磷酸酶和CaMKKβ-AMPK-ULK1途径激活自噬,同时促进TFEB、TFE3去磷酸化和核易位,并以mTOR非依赖性方式减少肝脂肪堆积。
新药研究也是NAFLD防治的重要环节,部分激动剂或抑制剂类似物可为新药研究提供方向。生长分化因子11是转化生长因子β亚家族成员,可通过上调细胞自噬消除高脂导致的肝细胞脂质积累,并减少活性氧(ROS),提升线粒体膜电位,从而改善NAFLD。培贝夫明是成纤维细胞生长因子21(FGF21)类似物,临床证据表明FGF21类似物可显著降低NASH患者的肝脂肪,其机制与调节糖脂代谢途径相关。p62激动剂通过N端降解通路(N-degron)促进脂肪自噬,其在小鼠肝脂肪病和肥胖症中的疗效已得到验证。CAY10566是一种SCD1特异性抑制剂,可通过增强的AMPK活性促进脂肪吞噬,显著减少肝脂肪变性和肝脂滴积聚。
4.2 中药通过脂肪自噬作用防治NAFLD的研究
研究表明一些中药有效活性成分可调控脂肪自噬,减少脂肪积累,改善脂肪变性,以达到治疗NAFLD的目的。例如,川陈皮素是一种柑橘类黄酮,主要通过介导的溶酶体生物发生和脂肪自噬来缓解肝脂肪变性;益母草苷及青钱柳提取物也可通过脂肪自噬途径诱导肝脂肪清除,缓解NAFLD;此外,连翘脂素是一种从连翘中提取的木质素,具有保肝和抗炎作用,可恢复脂肪自噬并抑制脂质积累。
中药有效活性成分在NAFLD中的作用机制与脂肪自噬靶点有关。例如柚皮苷治疗可恢复TFEB介导的溶酶体生物发生,从而促进自噬体和溶酶体的融合,恢复受损的自噬通量并进一步诱导脂肪自噬,以减轻肝脂肪变性。白藜芦醇苷在小鼠模型中通过恢复自噬通量改善了NASH,其机制与抑制mTOR信号传导并上调TFEB的表达和活性有关。芒柄花黄素通过激活AMPK,促进TFEB的后续核易位,加强溶酶体生物发生和自噬体-溶酶体融合,解除自噬通量的阻断,诱导脂肪自噬,从而显著改善了小鼠的肝脂肪变性。萝卜硫素以核因子- E2相关因子2(Nrf2)依赖性方式刺激脂肪自噬来增强脂滴降解,同时通过AMPK-mTOR-ULK1信号通路促进噬脂作用,从而改善肝细胞中脂滴的过度积累。人参皂苷化合物K与糖皮质激素受体结合后,不仅通过AMPK/ULK1途径激活了脂肪自噬,还促进了糖皮质激素受体与ATGL启动子的结合,增加脂肪酶表达。和厚朴酚可以通过激活SIRT3-AMPK-脂肪自噬轴来改善肝细胞的脂毒性。槲皮素可以减轻各种肥胖和糖尿病动物模型中肝脂肪的积累,该机制与AMPK信号传导促进脂肪自噬作用有关。甜叶菊和甜菊糖苷通过PPARα介导的脂肪自噬减轻小鼠肝细胞中的肝脂肪变性。此外,缬草及其环烯醚萜可作为自噬增强剂来分解脂滴,通过抑制mTORC1活性诱导自噬,同时以Atg5依赖性方式减少脂质积累,从而有效缓解脂肪肝。
4.3 饮食运动通过脂肪自噬作用防治NAFLD的研究
研究发现运动和饮食干预降低了高脂肪饮食诱导的肝脏中的甘油三酯水平,运动和饮食干预可激活AMPK/ULK1,并抑制AKT/mTOR/ULK1途径来增强脂肪自噬作用,另外运动刺激了肌肉中FGF21的产生,随后通过AMPK依赖的途径促进肝脏中的脂肪自噬。
高碳水化合物摄入量过多会导致肠道脂质积聚,通过ROS-AKT-Beclin1途径可反馈性地激活肠上皮细胞中的脂肪自噬,减轻葡萄糖诱导的脂质积累。高磷饮食通过激活AMPK通路和上调Beclin1磷酸化水平促进脂肪自噬以减少肝脂沉积。禁食可诱导FGF21信号转导,通过组蛋白去甲基化酶激活脂肪自噬和脂质降解。此外,有研究发现饥饿一段时间后重新进食也会激活肠道中的脂肪自噬。
研究者通过有氧运动小鼠模型发现运动可以有效减轻肥胖小鼠的体质量,促进脂肪分解,此过程涉及中性脂肪酶分解及脂肪自噬参与。小鼠适度跑步机运动可抑制异常脂滴膨胀和增强溶酶体噬脂作用,从而调节脂滴的生物发生和脂肪自噬以缓解NAFLD,该过程与降低脂滴生长扩张基因FITM2、CIDEA和FSP27的表达,促进LAMP1与脂滴的共定位有关。此外,小鼠游泳运动还可刺激AMPK/SIRT1激活肝脏的脂肪自噬,从而降低肝脂肪变性和胰岛素抵抗。基于脂肪自噬作用防治NAFLD的研究总结见表2。
5总结与展望
综上所述,脂肪自噬的主要过程基本确定,但脂肪自噬的调控机制尚不明确,其调控过程复杂,涉及基因、受体、酶等多种因素,现阶段脂肪自噬相关机制研究仍处于探索阶段。目前已鉴定出脂滴相关蛋白、分子伴侣、溶酶体蛋白等相关基因,部分脂肪自噬基因可促进或抑制脂肪自噬,通过过表达或抑制基因靶点能够起到防治NAFLD的作用。脂肪自噬相关受体大多分布在脂滴表面,通过加强脂滴与溶酶体间的相互作用及促进相关通路可诱导脂肪自噬的发生。脂肪自噬相关酶包括脂肪分解酶和脂肪自噬酶,通过靶点激活ATGL和AMPK相关通路,能够促进脂肪自噬相关过程。基于脂肪自噬相关靶点,研究者对西药和中药有效成分进行筛选研究,探究了中西医药物及饮食运动干预在治疗NAFLD中的作用,这不仅验证了脂肪自噬相关靶点及通路,同时也为中西医防治NAFLD提供了新思路。
脂肪自噬的相关机制已取得了很多研究成果,这些研究大多是基于核心物质或通路进行单独研究,然而基因的转录翻译、酶的催化、受体的信号传递不是独立过程,它们之间联系密切,因此探究脂肪自噬相关基因、受体、酶三者之间的联系可能是未来NAFLD防治的一个重要方向。此外,中药有效活性成分作为脂肪自噬研究的热点,为防治NAFLD提供了思路,但相关临床研究比较少,缺乏指导临床用药的证据。未来随着研究的不断深入,通过脂肪自噬作用防治NAFLD的方案将逐渐成熟。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCH240725



