JACC-BTS 北大郭宇轩联合北京协和医院张抒扬/胡晓敏团队揭示非心肌细胞在LMNA相关心肌病rAAV基因替代疗法中的关键作用
时间:2024-08-26 06:00:16 热度:37.1℃ 作者:网络
遗传性扩张性心肌病的常见致病基因中,LMNA位居第二1。与排名第一的TTN相关心肌病以及其他心肌病相比,LMNA心肌病发病更早,伴随致命的心律失常,并且对常规心脏病治疗手段响应更差,严重缺乏有效的针对性的治疗策略2, 3。LMNA基因编码核纤层蛋白A/C,参与组成核纤层结构,在细胞骨架组装、核应力稳态、细胞信号转导、表观遗传调控以及转录调控等多方面发挥重要作用4-7。LMNA心肌病的致病突变包括错义突变和截短突变两类,其中截短突变的疾病表型更为严重8。LMNA截短突变触发无义mRNA降解机制,导致核纤层蛋白A/C蛋白表达水平下降9,影响心肌细胞内核纤层蛋白A/C的多层级调控功能。重组腺相关病毒(rAAV)作为遗传病基因治疗的主流递送载体,能在基因突变导致功能异常的情况下,通过转基因替代或补充实现治疗目的10, 11。虽然LMNA基因编码序列长度符合AAV的装载容量,但是目前使用rAAV递送补充LMNA基因治疗LMNA相关心肌损伤的研究尚不充分。
2024年8月21日,北京大学郭宇轩课题组与北京协和医院张抒扬/胡晓敏团队合作在JACC: Basic to Translational Science杂志上发表题为“Non-cell-autonomous cardiomyocyte regulation complicates gene supplementation therapy for Lmna-associated cardiac defects in mice”的论文。该研究基于AAV-CRISPR/Cas9和Cre-LoxP技术构建了3种Lmna截短突变小鼠模型和3种rAAV-LMNA基因治疗载体。在此基础上,本研究解释了不同Lmna突变小鼠看似矛盾的表型,发现非细胞自主性调控作用对Lmna突变心肌细胞表型的关键影响。在胚系Lmna突变小鼠模型中,针对非心肌细胞回补核纤层蛋白A能产生与全身回补类似的心肌恢复能力。因此,非心肌细胞是LMNA相关心肌病基因治疗的关键靶细胞。

首先,研究者通过CRISPR/Cas9介导合子突变建立胚系Lmna突变小鼠模型(以下简称LmnaΔ小鼠)。该模型在 Lmna基因第10号外显子出现5个碱基对缺失,进而导致阅读框移码及终止密码子提前出现。通过对Lmna基因mRNA和蛋白水平检测,研究者验证LmnaΔ/Δ小鼠存在全身核纤层蛋白A/C缺失,并且出现截短的核纤层蛋白Δ。与既往文献报道一致12, 13,LmnaΔ/Δ小鼠出现生长受限、肌肉萎缩、脂肪萎缩以及早期死亡的表型。
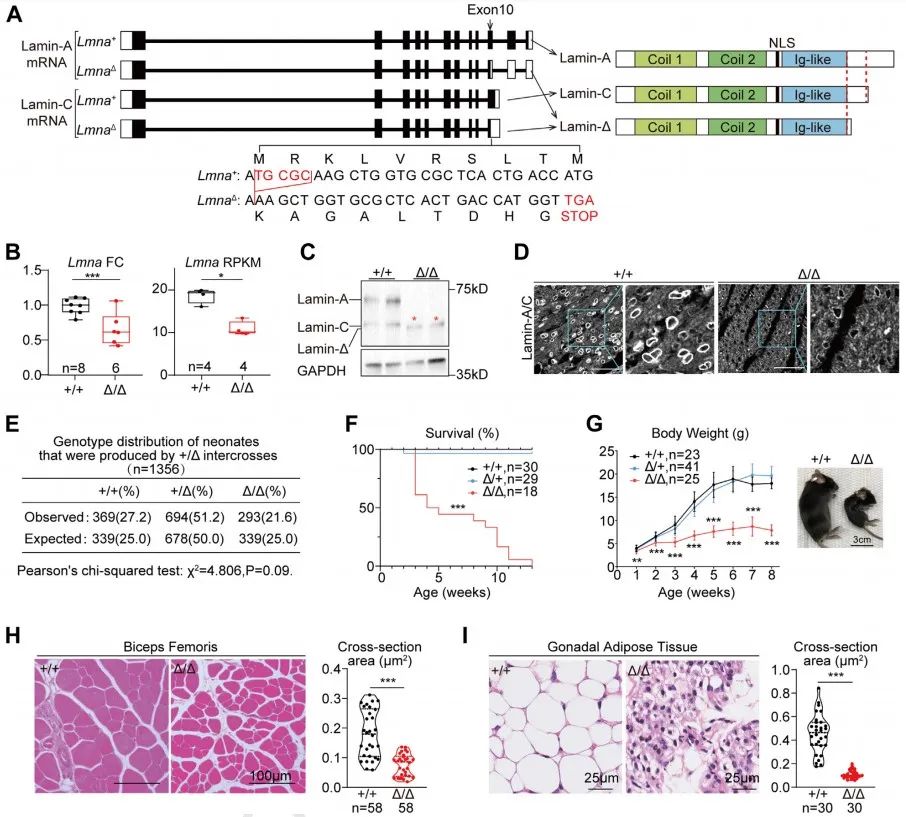
接下来,研究者对LmnaΔ/Δ小鼠心脏表型进行研究。LmnaΔ/Δ小鼠心脏整体变小,超声心动图结果提示LVIDs、LVIDd、LVPWs及LVPWd均显著降低,但心脏功能(FS)正常。研究者通过Langendorff灌流技术分离得到单个心肌细胞,发现LmnaΔ/Δ小鼠心肌细胞显著缩小且Z线间距缩短,细胞核缩窄。进一步,研究者通过IonOptix心肌细胞收缩检测发现心肌细胞收缩及舒张功能障碍。RNAseq分析揭示LmnaΔ/Δ小鼠存在心脏发育不成熟。上述结果提示,LmnaΔ/Δ小鼠心肌细胞在转录、形态和功能上均不成熟。
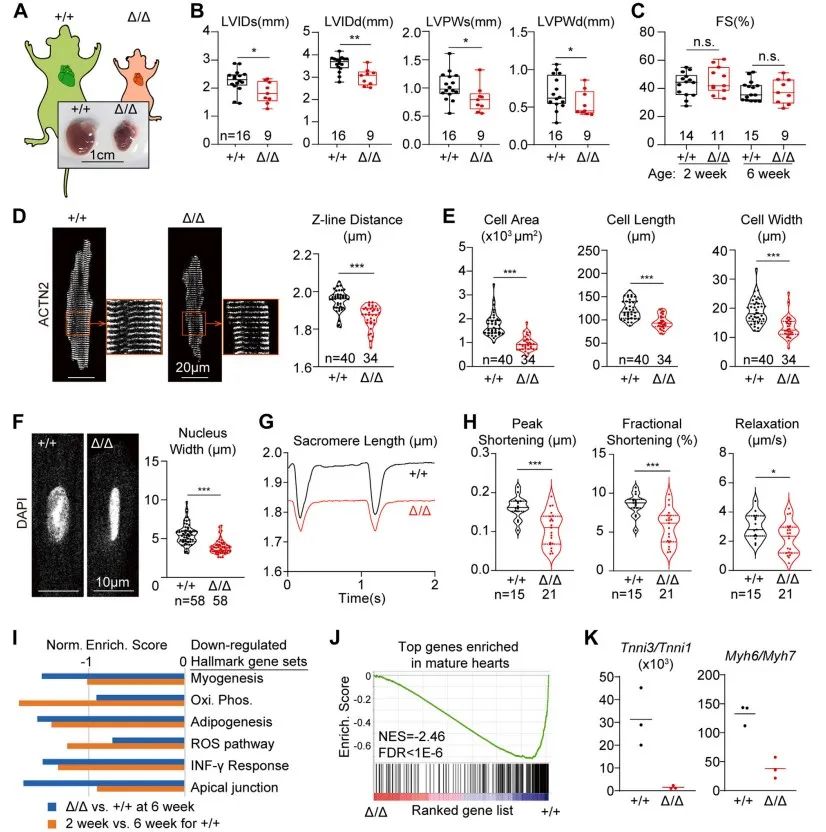
研究者猜想,LmnaΔ/Δ小鼠未表现出明显的心脏功能(FS)下降可能是由于该突变同时造成全身各器官发育受限。受损心肌细胞在降低全身负荷的情况下仍然能维持正常心功能。围绕上述猜想,研究者利用CASAAV技术建立心肌特异性Lmna突变小鼠(以下简称CASAAV小鼠)。该突变位点近似LmnaΔ,心脏组织核纤层蛋白A/C表达降低,同样出现截短的核纤层蛋白Δ样蛋白。与LmnaΔ/Δ小鼠不同的是,CASAAV小鼠出现明显心功能降低,室腔扩张,心肌纤维化,心肌细胞增长,细胞面积增大。与LmnaΔ/Δ小鼠相同的是,由于Lmna的缺失,细胞核缩窄。上述两种不同模型间看似矛盾的表型提示Lmna突变对心肌细胞的影响可能不是细胞自主性的,同时病理生理状态会影响Lmna突变带来的表型。
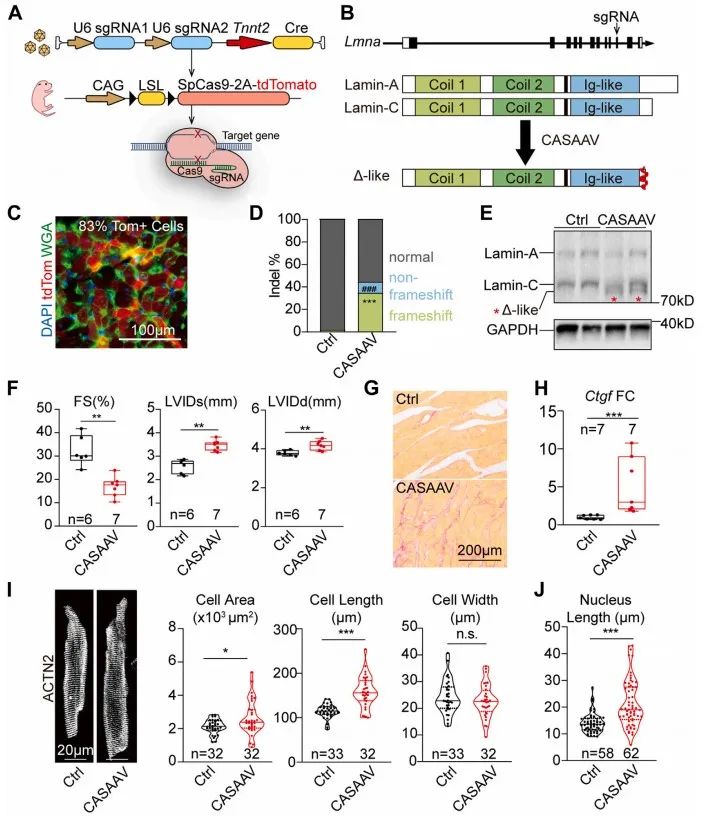
为消除心脏病理状态对心肌细胞表型的干扰,研究者采用低剂量CASAAV系统诱导心肌特异性Lmna突变嵌合体模型14, 15,即通过降低AAV的注射剂量减少发生突变细胞数量,使心功能维持正常状态。研究者设定高(1×1014vg/kg)、中(1×1013vg/kg)、低(1×1012vg/kg)剂量梯度,通过检测突变细胞百分比、心脏收缩功能及结构、心脏纤维化程度以及心肌损伤标志物变化,确定低剂量CASAAV能实现诱导嵌合体模型,并维持心功能正常。在嵌合体模型中,突变细胞与未突变细胞形态学无明显差异,而突变细胞核较未突变细胞核明显缩窄。上述结果提示,Lmna通过非细胞自主性机制调控心肌细胞形态,而通过细胞自主性机制调控细胞核形态。
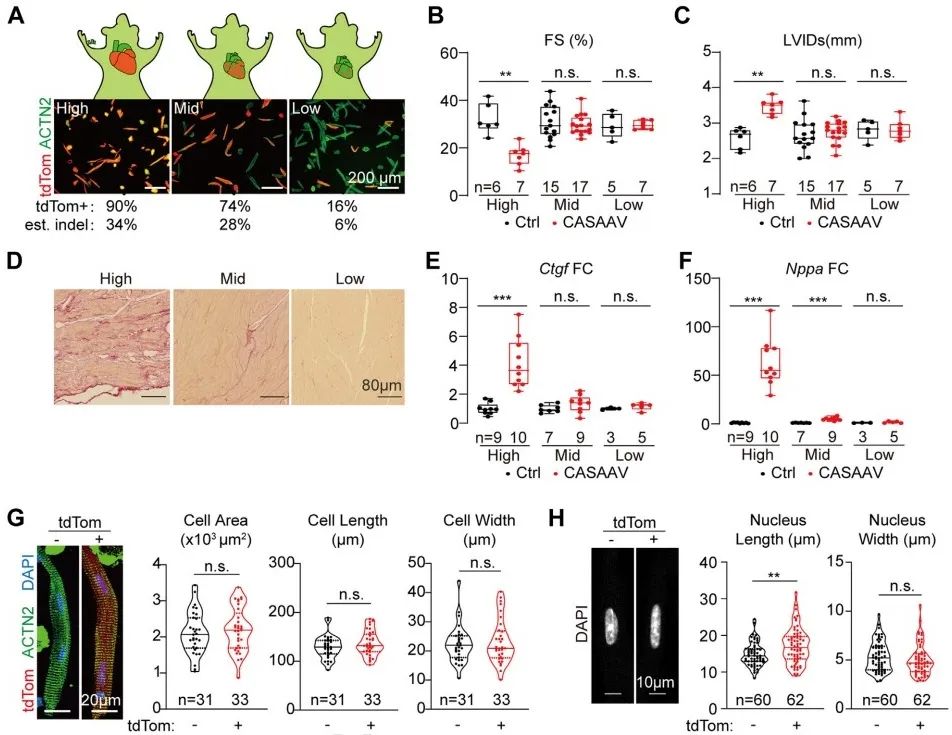
接下来,研究者试图通过rAAV递送Lmna基因治疗LmnaΔ/Δ小鼠。研究者在LmnaΔ/Δ小鼠出生后1天皮下注射AAV-CMV-LA实现全身外源性Lmna表达。注射AAV-CMV-LA后,LmnaΔ/Δ小鼠体重增加,左室后壁厚度增加,心肌细胞宽度增加,面积增大,细胞核变宽,心肌细胞收缩及舒张功能增强。上述结果提示,AAV-CMV-LA全身表达外源性Lmna基因对LmnaΔ/Δ小鼠存在一定的治疗效果。
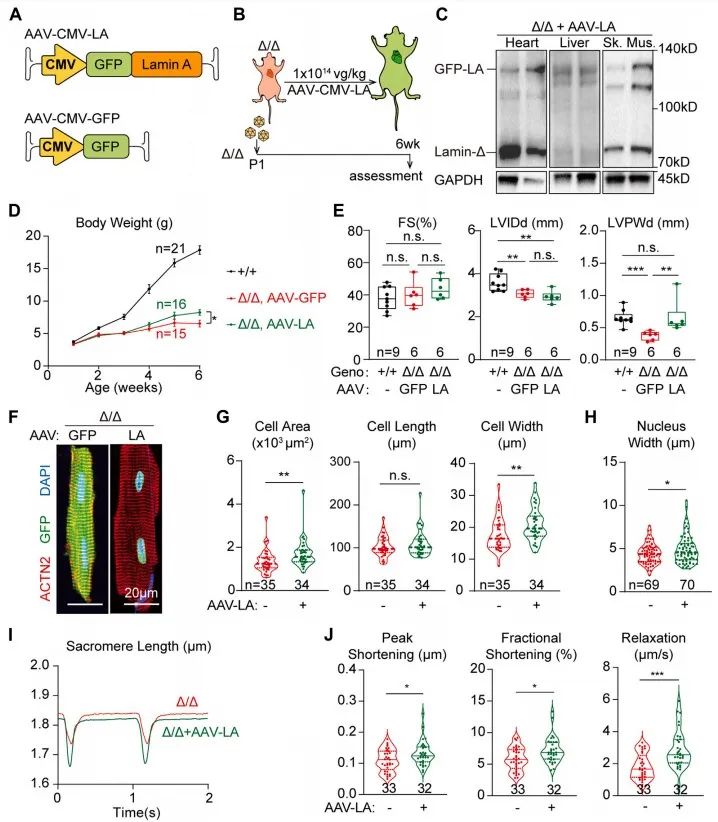
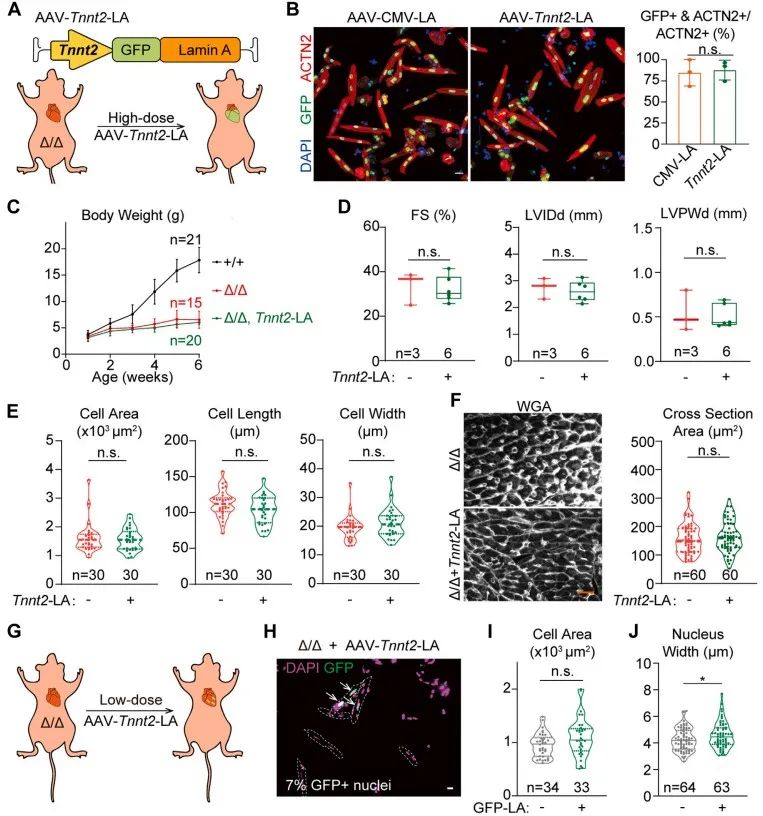
为进一步明确AAV-CMV-LA治疗LmnaΔ/Δ小鼠的机制是否与Lmna的非细胞自主调控有关,研究者使用心肌细胞特异性启动子Tnnt2构筑AAV-Tnnt2-LA载体,实现心肌特异性的外源性Lmna回补。AAV-Tnnt2-LA注射后LmnaΔ/Δ小鼠未出现体重、心功能、室壁厚度及心肌细胞大小改变。然而在AAV-Tnnt2-LA转导成功的心肌细胞中可发现细胞核形态的改善。该结果提示,AAV-Lmna并非在心肌细胞中改善心肌的结构与功能。
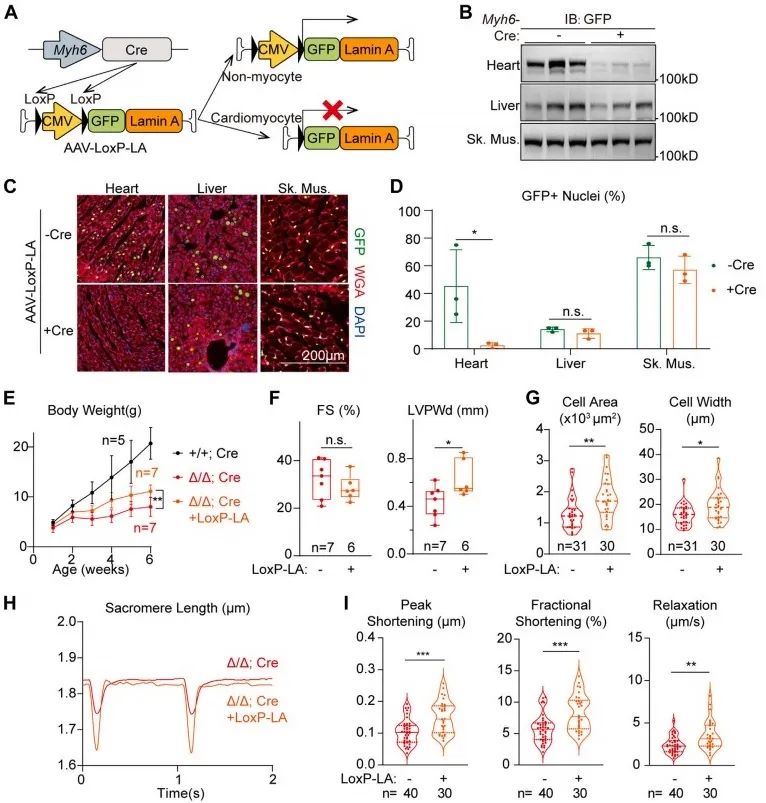
接下来,研究者构筑了AAV-LoxP-LA载体,结合Tg(Myh6-Cre)小鼠,通过Cre-LoxP系统排除心肌细胞表达,仅在除心肌细胞以外的其他细胞类型中回补Lmna。经过这种处理后,LmnaΔ/Δ小鼠出现体重增加,左室后壁厚度增加,心肌细胞宽度增加,面积增大,心肌细胞收缩及舒张功能增强的现象。AAV-LoxP-LA治疗效果与AAV-CMV-LA相同,提示AAV-CMV-LA或AAV-LoxP-LA治疗主要是通过在非心肌细胞中回补Lmna,通过非细胞自主调控机制改善Lmna相关心肌细胞表型。
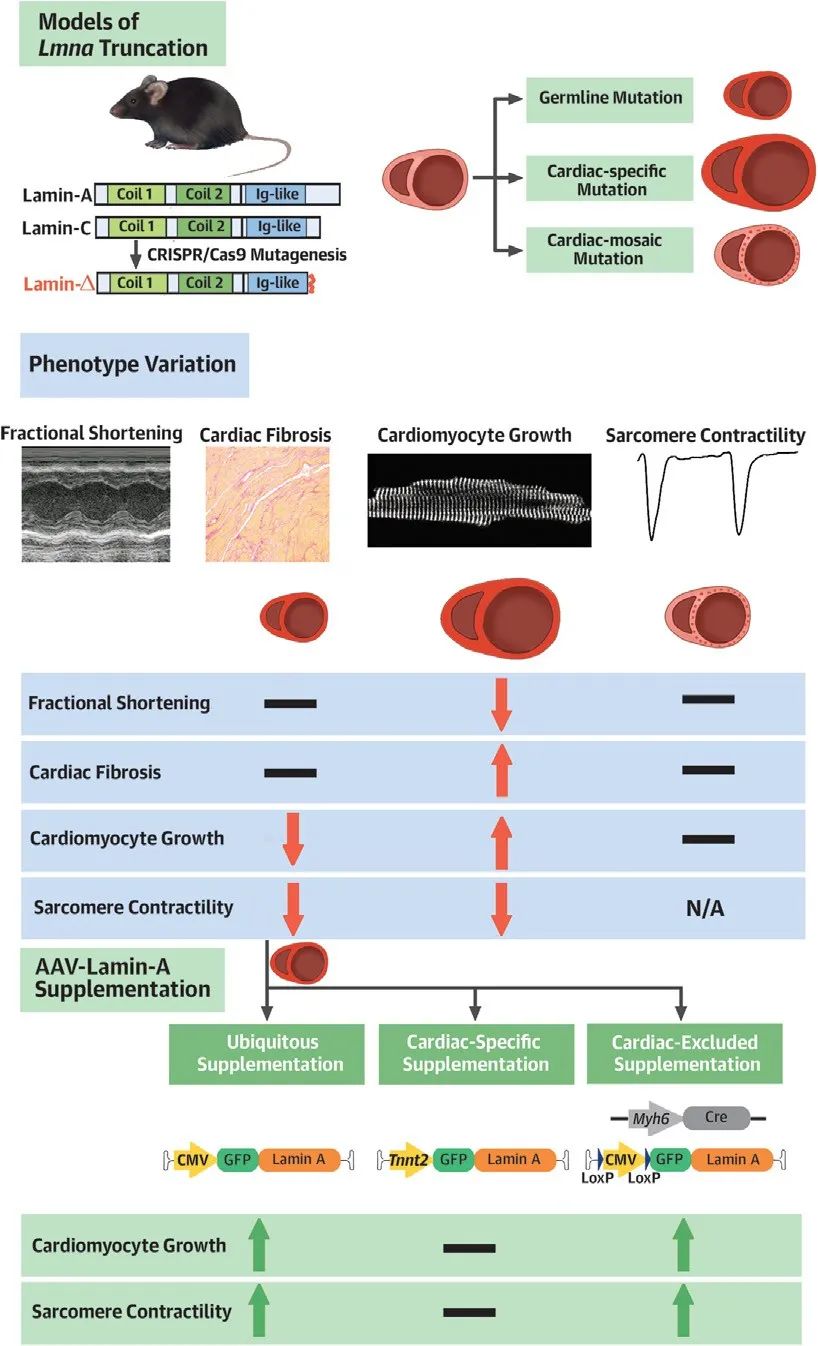
综上所述,研究者提出不同Lmna突变模型间的表型差异可能来源于Lmna对心肌细胞发育和功能的非自主性调控作用。基于Lmna的非自主性调控作用,非心肌细胞可能成为LMNA相关心肌病基因替代疗法中的关键靶细胞。
北京协和医院科研型直博生孙玥燊是本研究的第一作者。北京大学郭宇轩研究员和北京协和医院张抒扬教授为本文共同通讯作者。本工作获得了北京协和医院胡晓敏副研究员、北京大学赵东宇教授、波士顿儿童医院William Pu教授、北京大学董尔丹研究员的大力支持与帮助。本研究获得国家自然科学基金、国家重点研发计划、北京市自然科学基金、北京市科技新星计划、中国医学科学院医学与健康科技创新工程项目、细胞生态河海实验室创新基金以及中央高水平医院临床科研项目的资助。
参考文献:
1. Rosenbaum AN, Agre KE, Pereira NL. Genetics of dilated cardiomyopathy: practical implications for heart failure management. Nat Rev Cardiol. May 2020;17(5):286-297.
2. Jansweijer JA, Nieuwhof K, Russo F, et al. Truncating titin mutations are associated with a mild and treatable form of dilated cardiomyopathy. Eur J Heart Fail.Apr 2017;19(4):512-521.
3. Paldino A, Dal Ferro M, Stolfo D, et al. Prognostic Prediction of Genotype vs Phenotype in Genetic Cardiomyopathies. J Am Coll Cardiol. Nov 22 2022;80(21):1981-1994.
4. Chatzifrangkeskou M, Le Dour C, Muchir A. Modulation of cytoskeleton in cardiomyopathy caused by mutations in LMNA gene. Am J Physiol Cell Physiol. Jun 1 2023;324(6):C1223-c1235.
5. Kalukula Y, Stephens AD, Lammerding J, Gabriele S. Mechanics and functional consequences of nuclear deformations. Nat Rev Mol Cell Biol. Sep 2022;23(9):583-602.
6. Andrés V, González JM. Role of A-type lamins in signaling, transcription, and chromatin organization. J Cell Biol. Dec 28 2009;187(7):945-957.
7. Guénantin AC, Jebeniani I, Leschik J, et al. Targeting the histone demethylase LSD1 prevents cardiomyopathy in a mouse model of laminopathy. J Clin Invest. Jan 4 2021;131(1).
8. Kumar S, Baldinger SH, Gandjbakhch E, et al. Long-Term Arrhythmic and Nonarrhythmic Outcomes of Lamin A/C Mutation Carriers. J Am Coll Cardiol. Nov 29 2016;68(21):2299-2307.
9. Lee J, Termglinchan V, Diecke S, et al. Activation of PDGF pathway links LMNA mutation to dilated cardiomyopathy. Nature. Aug 2019;572(7769):335-340.
10. Wang D, Tai PWL, Gao G. Adeno-associated virus vector as a platform for gene therapy delivery. Nat Rev Drug Discov. May 2019;18(5):358-378.
11. Anguela XM, High KA. Entering the Modern Era of Gene Therapy. Annu Rev Med. Jan 27 2019;70:273-288.
12. Sullivan T, Escalante-Alcalde D, Bhatt H, et al. Loss of A-type lamin expression compromises nuclear envelope integrity leading to muscular dystrophy. J Cell Biol. Nov 29 1999;147(5):913-920.
13. Nikolova V, Leimena C, McMahon AC, et al. Defects in nuclear structure and function promote dilated cardiomyopathy in lamin A/C-deficient mice. J Clin Invest. Feb 2004;113(3):357-369.
14. Guo Y, Pu WT. Genetic Mosaics for Greater Precision in Cardiovascular Research. Circ Res. Jun 22 2018;123(1):27-29.
15. Guo Y, VanDusen NJ, Zhang L, et al. Analysis of Cardiac Myocyte Maturation Using CASAAV, a Platform for Rapid Dissection of Cardiac Myocyte Gene Function In Vivo. Circ Res. Jun 9 2017;120(12):1874-1888.
原文链接:
https://www.jacc.org/doi/10.1016/j.jacbts.2024.06.004


