【协和医学杂志】ERCP与EUS-FNA融合技术对胰腺癌合并梗阻性黄疸的诊治效能
时间:2024-08-26 06:00:28 热度:37.1℃ 作者:网络
胰腺导管腺癌(PDAC)是一种恶性度高、早期诊断困难的恶性肿瘤,是胰腺癌最常见的病理类型。中国国家癌症中心发布的2022年肿瘤统计数据显示,胰腺癌在恶性肿瘤导致的死亡中居第6位,预计至2030年胰腺癌死亡率将跃居第二位,仅次于肺癌[1]。
随着医学水平的提升,尽管胰腺癌的检测和治疗手段均取得了一定进展,但相对于其他恶性肿瘤,PDAC对化疗、放疗及免疫治疗均不敏感,术后复发/转移率均较高,患者生存获益极为有限,确诊后5年生存率仅约4%[2]。
手术切除是PDAC最有效的治疗方式,但仅10%~15%的患者适合手术治疗[3]。随着PDAC病情进展,肿瘤生长可阻塞胆管导致胆汁淤积,进而出现皮肤巩膜黄染、瘙痒、茶色尿、陶土样大便等临床表现,患者内环境紊乱加剧,胰腺癌治疗效果不佳[4-5]。对于合并梗阻性黄疸的胰腺癌患者,术前减黄治疗可解除胆道梗阻,改善患者一般状况,是临床治疗不可或缺的环节[6]。
国际共识推荐内镜下逆行胰胆管造影术(ERCP)经十二指肠乳头放置支架作为减黄方案之一,该策略也可通过ERCP行胆管刷检以辅助疾病的诊断。超声内镜引导下细针穿刺术(EUS-FNA)被认为是现今胰腺癌定位和定性诊断最为准确的方法,但无法进行减黄治疗[7]。内镜融合有助于弥补单一术式的缺陷,是内镜领域发展的重要趋势,鉴于在同一内镜单元开展EUS-FNA和ERCP融合技术是否可提升胰腺癌合并梗阻性黄疸患者的诊治效能尚不明确,本研究通过回顾性分析,探讨EUS-FNA和ERCP融合技术在胰腺癌合并梗阻性黄疸患者诊治中的作用。
资料与方法
1.1 研究对象
本研究为回顾性队列研究,研究对象为2023年1月1日—2024年2月26日北京协和医院消化内科住院接受ERCP胆管支架引流的胰腺癌合并梗阻性黄疸患者。
纳入标准:(1)根据病理学及影像学检查,出院诊断为胰腺癌的患者(病理类型为PDAC);(2)年龄≥18岁;(3)胰头占位合并梗阻性黄疸,需进行减黄治疗;(4)基线资料完整,如性别、年龄、基础疾病、入院时直接胆红素与总胆红素水平、肿瘤最大径等。
排除标准:(1)合并胰腺其他病变;(2)合并造成胆道梗阻的其余疾病(如胆石症)。
根据是否在同一内镜单元进行EUS-FNA,将胰腺癌合并梗阻性黄疸患者分为融合技术组和单纯ERCP组。
本研究已获得北京协和医院伦理审查委员会审批(审批号:K5908),并豁免患者知情同意。
1.2 内镜操作
1.2.1 单纯ERCP组
ERCP是一种专门用于诊断和治疗胰胆管疾病的微创内镜术式。术前需对患者进行一系列评估,包括病史收集和必要的实验室检测。ERCP检查时,患者通常取俯卧位,内镜经口置入,并经食管到达十二指肠。在十二指肠乳头处,利用乳头切开刀精准插入胆管或胰管,注入对比剂后通过X线观察胰胆管结构,评估是否存在狭窄、结石或其他异常情况。根据诊断结果,可能需要进行乳头切开、结石取出或支架置入等治疗操作。术后,医护人员需密切监测患者生命体征和术后反应,预防并及时处理可能出现的并发症。
1.2.2 融合技术组
单次内镜单元内,在ERCP前/后,或同时进行EUS-FNA操作。EUS-FNA检查时,经口置入内镜,通过内镜前端装置的超声探头实时显示胰腺和周围器官的超声图像,精确识别病变位置和大小,并调整内镜至最佳角度以便接近目标区域。在超声的精确引导下,可通过内镜活检通道插入一根细长的穿刺针,以采集病变标本。必要时,可进行多次穿刺以获取足够的细胞或组织样本。拔除穿刺针,推出针道内容物,将样本置于特制的介质中,确保样本的完整性和适宜性,以便后续进行细胞学或病理学分析。术后需密切监护,观察是否有出血、胰腺炎等并发症。
1.3 观察指标
比较两组患者病理诊断率、ERCP引流成功率、并发症发生率、单次住院时间。其中病理诊断率为经胰腺穿刺或胆管刷检后获得恶性肿瘤诊断的患者比例。ERCP引流成功率为ERCP插管成功并放置胆管支架进行胆管引流的患者比例。并发症包括出血(胰腺囊内出血、十二指肠乳头部出血、胆道出血、消化道出血等)、胰腺炎(满足
以下三项中的任两项可诊断为胰腺炎:腹痛、血清淀粉酶超过正常值上限3倍、影像学证实[8])、穿孔(腹膜内穿孔、腹膜后瘘、十二指肠穿孔)。单次住院时间为患者本次住院时间。
1.4 质量控制
1
北京协和医院消化内科是胰腺、胆囊疑难疾病诊治中心,医护团队均经严格规培,具备丰富的内镜操作经验;
2
严格按照纳入与排除标准筛选病例,研究过程规范、透明;
3
观察指标客观,标准化方法收集患者资料,确保数据完整性、准确性和一致性。
1.5 样本量估算
基于主要评价指标病理诊断率进行样本量估算。根据既往临床经验,预估单纯ERCP组和融合技术组病理诊断率分别为30%~50%和90%。两组样本比例为1:1,设定检验水准α=0.05(双侧检验),检验效能(1-β)=0.9。采用PASS 15软件计算后,每组所需最低样本为80例。
1.6 统计学处理
采用SPSS 23.0软件进行统计学分析。正态分布计量资料(年龄)以均数±标准差表示,组间比较采用独立样本t检验;非正态分布计量资料(胆红素水平、肿瘤最大径、单次住院时间等)以中位数(四分位数)表示,组间比较采用Mann-Whitney U检验。计数资料(性别、基础疾病、病理诊断率)以频数(百分数)表示,组间比较采用卡方检验或Fisher精确概率法。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床资料
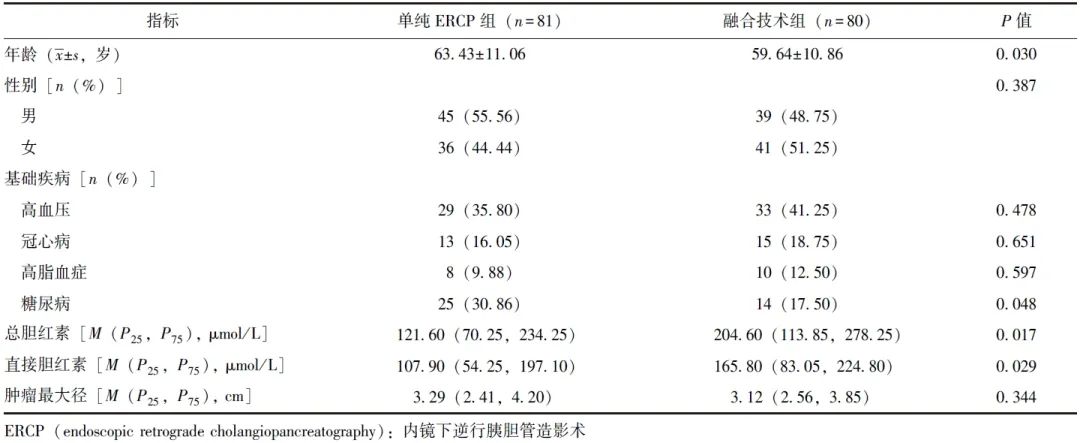
共入选符合纳入与排除标准的接受ERCP胆管支架引流的胰腺癌合并梗阻性黄疸患者161例,其中融合技术组80例,单纯ERCP组81例。融合技术组年龄、糖尿病患病率低于单纯ERCP组,总胆红素、直接胆红素水平高于单纯ERCP组(P均<0.05),两组余基线资料均无统计学差异(P均>0.05),见表1。
表1 两组患者基线资料
2.2 病理诊断率和ERCP引流成功率
单纯ERCP组26例行ERCP胆管刷检,病理诊断率为46.15%(12/26)。融合技术组80例均行ERCP胆管刷检,病理诊断率为92.50%(74/80),差异具有统计学意义(P<0.001)。单纯ERCP组ERCP引流成功率为86.42%(70/81),融合技术组ERCP引流成功率为82.50%(66/80),差异无统计学意义(P=0.360)。
2.3 并发症发生率和单次住院时间
单纯ERCP组术后发生胰腺炎1例(1.23%)、出血1例(1.23%),总并发症发生率为2.47%(2/81);融合技术组术后发生胰腺炎3例(3.75%)、出血1例(1.25%),总并发症发生率为5.00%(4/80)。两组术后胰腺炎、出血、总并发症发生率均无统计学差异(P均>0.05)。单纯ERCP组中位单次住院时间为5(3,9)d,融合技术组中位单次住院时间为4(4,7)d,差异无统计学意义(P=0.397)。
3 讨论
本研究基于真实世界、回顾性、单中心、观察性队列研究,以单纯ERCP为参照,评估了ERCP和EUS-FNA融合技术在胰腺癌合并梗阻性黄疸诊治中的临床价值。结果显示,融合技术组病理诊断率高于单纯ERCP组(92.50%比46.15%,P<0.001), ERCP引流成功率(82.50%比86.42%,P=0.360)、总并发症发生率(5.00%比2.47%, P=0.443)、单次住院时间[4(4,7)d比5(3,9)d,P=0.397]与单纯ERCP组均无统计学差异,提示EUS-FNA与ERCP相融合技术在不影响ERCP引流效果、不增加术后并发症率、住院时间的情况下,可显著提升胰腺癌诊断率。
ERCP和EUS-FNA是胰腺疾病诊疗的重要方法。其中ERCP为一种融合内镜和放射性造影技术的介入治疗手段,可通过内镜将导管置入十二指肠乳头,使操作器械进入胆胰管并注入造影剂,并借助X线成像技术对注入的造影剂在胰胆管系统中的分布和流动进行观察和诊断[9]。在胰腺疾病的管理中,ERCP不仅可用于诊断目的,还可提供治疗手段,特别是对于胰腺癌合并梗阻性黄疸患者。
此外,以ERCP技术为基础,可进行十二指肠乳头括约肌切开术、内镜下鼻胆汁引流术、内镜下胆汁内引流术等微创治疗,也可通过内镜定位胆管狭窄部位引导合适的支架置入以进行胆汁引流,保持胆管开放,在胰腺癌的治疗中发挥重要作用,但该技术无法探查肿瘤组织内部病变情况,从而影响病理诊断结果的准确性。
EUS-FNA为一种将内镜超声高分辨率成像能力与细针穿刺组织采样功能相结合的内镜技术,允许医生在极小的风险下获得胰腺病变的组织样本,是胰腺实性占位性病变定位和定性诊断最为准确的方法,具有极高的灵敏度和特异度[10]。操作过程主要为将一根细长、含超声探头的内镜通过患者的口腔插入,经食道进入胃和十二指肠,可对胰腺病变部位进行精确定位,并引导细针穿过胃壁或十二指肠壁,通过针头收集组织样本进行病理分析,以获得诊断结果。
研究显示,EUS-FNA可鉴别淋巴结和其他器官的转移病灶,具有侵入性损伤风险低的优点,识别胰腺癌的灵敏度可达93%,对于胰腺癌的诊断和治疗具有非常重要的意义[2],但对于胰腺癌合并梗阻性黄疸患者而言,该技术无法兼备术前减黄的功效。
随着内镜技术的不断发展,EUS-FNA融合ERCP应用开创了胆囊、胰腺疾病微创治疗的新时代。EUS-FNA与ERCP融合技术可使医生在ERCP前通过扫查胰腺、明确毗邻组织情况和胆管梗阻性质以辅助ERCP治疗策略的制订[11]。
此外,二者相融合可减少患者内镜操作次数,节约医疗资源。因此,建议消化内镜医生同时具备操作ERCP和EUS-FNA的能力。截止目前,国内尚缺乏系统性比较单独进行ERCP和在同一内镜单元内进行EUS-FNA和ERCP融合操作对胰腺癌合并梗阻性黄疸患者诊治效能的研究,国外虽有类似研究,但研究对象多局限于胆石症等良性胆道疾病患者。
鉴于目前国内能够同时进行EUS-FNA和ERCP的内镜医生较少,本研究旨在通过展现在同一内镜单元进行EUS-FNA和ERCP操作的优势,为未来内镜医师培训提供一种新思路。将EUS-FNA和ERCP融合至同一内镜单元中,可最大程度缩短患者的诊疗周期。
首先,允许患者在同一时间段内接受诊断和治疗干预,可提高诊疗效率。其次,融合模式可充分利用每种技术的互补优势:EUS-FNA提供胰腺及周围结构的高分辨率成像,有助于精确定位病变,并进行准确的组织采样,但无法解除黄疸;而ERCP可进行治疗干预,如胆道支架置入或结石取出,解除胆道梗阻及相关症状。二者融合在同一内镜单元中代表了内镜实践中的一种范式转变,提供了一种以患者为中心的诊疗方法,最大程度发挥内镜诊疗程序的效力,提高诊断准确性,并可优化医疗资源利用率。本研究结果显示,相较于单纯ERCP组,融合技术组胰腺癌病理诊断率显著提升,与两种内镜技术的特点和操作方法有关。
如前文所述,ERCP胆管刷检主要通过在胆管内部、依赖与胆管壁的摩擦获取细胞样本,无法深入肿瘤或病变组织内部,特别是对于浸润性生长的肿瘤,仅刷取表面组织可能难以获得足够具有代表性的恶性组织。相比之下,EUS-FNA可在超声引导下精确到达病变位置,通过细针直接穿刺肿瘤或病灶,获取更为深层的病变组织。
此外,ERCP胆管刷检通常仅可提供细胞学样本,当需要进一步判断较大范围的组织病变情况时,细胞学样本受到较大限制,而EUS-FNA可提供组织学样本,对于肿瘤确诊有重要价值。
因此,虽然ERCP下同时获取病理标本和引流胆管可缩短操作时间,但对于胰腺癌合并梗阻性黄疸患者,EUS-FNA仍是一种不可替代的诊断措施。在实际临床实践中,根据病变性质和位置,此两种技术可实现互补。
既往研究认为,EUS-FNA与ERCP融合使用可为ERCP操作及患者围术期管理带来困难,可能影响EUS-FNA与ERCP融合诊疗效果的因素主要包括:
1
操作过程中的干扰:在同一内镜单元进行EUS-FNA和ERCP可能会互相干扰,比如因EUS-FNA针刺引起的水肿、对十二指肠乳头及其周围黏膜的机械损伤、血肿及管腔内出血可能导致ERCP插管困难[12]。本研究未发现两组患者ERCP胆管引流成功率有显著差异,表明EUS-FNA并不影响ERCP操作。
2
并发症风险增加:虽然EUS-FNA术后不良事件少见,但并发症难以完全避免。Wang等[13]对51项队列研究共10 941例行EUS-FNA的患者进行分析后发现,术后胰腺炎、出血及穿孔发生率分别为0.44%、0.10%和0.02%。尽管研究者认为单独行EUS-FNA造成的胰腺轻微损伤通常不足以诱发胰腺炎,但可能成为后续行ERCP患者术后胰腺炎的危险因素。本研究亦未发现融合技术组与单纯ERCP组并发症发生率存有显著差异,提示二者相融合不增加ERCP并发症发生风险,安全性较高。
3
住院时间延长:传统认为,同时进行两项内镜操作可能增加手术的复杂性和安全风险,需延长住院时间以监测患者情况并处理可能出现的术后并发症。本研究未发现两组单次住院时间有统计学差异,提示EUS-FNA未增加患者围术期护理难度和监测时间。
本研究局限性:(1)为单中心小样本研究,研究对象未纳入疾病严重程度(如肿瘤分期)及既往治疗情况等资料,可能导致病例选择具有一定偏倚。(2)虽然参与ERCP操作的医生均具有丰富的操作经验,但未对操作者进行严格控制,可能影响操作的一致性。(3)在研究过程中,有诸多内容未被纳入考量范围。①麻醉方式:Berzin等[14]曾建立无插管、镇静麻醉的队列,并发现手术时长是麻醉相关并发症的风险因素。因此,EUS-FNA/ERCP融合治疗可能因延长操作时间而具有更高概率出现麻醉相关并发症。②支架类型:有文献报道,支架类型可在一定程度上影响内镜治疗效果[15]。支架的选择通常取决于多种因素,包括患者临床情况、梗阻类型与位置。在一些情况下,患者需要置入暂时性支架以缓解症状或减轻黄疸,直至手术或选择其他治疗,而在另一些情况下,患者可能需进行长期胆管引流,选择具有持久性功能的支架更适宜[16]。
除了目前较为常用的非覆膜自膨胀金属支架用于长期胆管引流外,还可选择覆膜金属支架、塑料支架、双腔吻合金属支架。可先通过超声内镜判断患者的肿瘤位置和梗阻性质,辅助选择最合适的支架,为患者提供个性化治疗方案。此外,融合治疗是否会影响支架放置后的位移与阻塞情况亦值得进一步研究。
综上所述,EUS-FNA与ERCP融合技术可显著提升胰腺癌合并梗阻性黄疸患者诊断率,同时不影响ERCP引流效果,不增加术后并发症发生率。联合应用此两种技术,可在不影响安全性的前提下,提升诊断准确性,为患者提供更加全面的治疗方案。
参考文献
[1]Han B F, Zheng R S, Zeng H M, et al. Cancer incidence and mortality in China, 2022[J]. J Natl Cancer Cent, 2024, 4(1): 47-53.
[2]中国医师协会超声内镜专家委员会. 中国内镜超声引导下细针穿刺抽吸/活检术应用指南(2021, 上海)[J]. 中华消化内镜杂志, 2021, 38(5): 337-360.
[3]Van Veldhuisen E, Van Den Oord C, Brada L J, et al. Locally advanced pancreatic cancer: work-up, staging, and local intervention strategies[J]. Cancers (Basel), 2019, 11(7): 976.
[4]Bang J Y, Hawes R, Varadarajulu S. Endoscopic biliary drainage for malignant distal biliary obstruction: which is better-endoscopic retrograde cholangiopancreatography or endoscopic ultrasound?[J]. Dig Endosc, 2022, 34(2): 317-324.
[5]Pavlidis E T, Pavlidis T E. Pathophysiological consequences of obstructive jaundice and perioperative management[J]. Hepatobiliary Pancreat Dis Int, 2018, 17(1): 17-21.
[6]中华人民共和国国家卫生健康委员会医政医管局. 胰腺癌诊疗指南 (2022年版)[J]. 中华消化外科杂志, 2022, 21(9): 1117-1136.
[7]Sadeghi A, Mohamadnejad M, Islami F, et al. Diagnostic yield of EUS-guided FNA for malignant biliary stricture: a systematic review and meta-analysis[J]. Gastrointest Endosc, 2016, 83(2): 290-8.e1.
[8]中华医学会外科学分会胰腺外科学组. 中国急性胰腺炎诊治指南(2021)[J]. 中国实用外科杂志, 2021, 41(7): 739-746.
[9]中华医学会消化内镜学分会ERCP学组, 中国医师协会消化医师分会胆胰学组, 国家消化系统疾病临床医学研究中心.中国ERCP指南 (2018版)[J]. 中华消化内镜杂志, 2018, 35(11): 777-813.
[10]李诗钰, 金震东. 内镜超声引导下胰腺细针穿刺术的研究进展[J]. 中国实用内科杂志, 2021, 41(5): 362-365.
[11]Fusaroli P, Lisotti A. EUS and ERCP in the same session for biliary stones: from risk stratification to treatment strategy in different clinical conditions[J]. Medicina (Kaunas), 2021, 57(10): 1019.
[12]Purnak T, El Hajj I I, Sherman S, et al. Combined versus separate sessions of endoscopic ultrasound and endoscopic retrograde cholangiopancreatography for the diagnosis and management of pancreatic ductal adenocarcinoma with biliary obstruction[J]. Dig Dis Sci, 2021, 66(8): 2786-2794.
[13]Wang K X, Ben Q W, Jin Z D, et al. Assessment of morbidity and mortality associated with EUS-guided FNA: a systematic review[J]. Gastrointest Endosc, 2011, 73(2): 283-290.
[14]Berzin T M, Sanaka S, Barnett S R, et al. A prospective assessment of sedation-related adverse events and patient and endoscopist satisfaction in ERCP with anesthesiologist-administered sedation[J]. Gastrointest Endosc, 2011, 73(4): 710-717.
[15]袁济钢, 夏明星, 赵毅, 等. 内镜支架引流治疗肝细胞肝癌所致肝门部胆管恶性梗阻的疗效分析[J]. 中华消化内镜杂志, 2023, 40(9): 719-723.
[16]胡良皞, 金震东. 内镜下胰管支架的临床应用及研究进展[J]. 中华消化内镜杂志, 2022, 39(10): 778-782.


