Nature:基于100kGP计划的WGS数据绘制全面的结直肠癌体细胞突变图谱
时间:2024-09-01 06:00:48 热度:37.1℃ 作者:网络
结直肠癌(CRC)是全球第三大常见恶性肿瘤。由于CRC测序项目往往仅限于几百个病例,或是基于全外显子组或panel测序,所以基因组病变的全貌及其与临床特征的关联尚未完全确定。
近日,英国癌症研究所的团队及合作者在Nature发表了题为“The genomic landscape of 2,023 colorectal cancers”的文章。研究人员对来自英国十万基因组项目参与者的2023份CRC样本进行了全基因组测序,绘制了详细的CRC体细胞突变图谱。综合分析确定了250多个假定的CRC驱动基因,其中许多基因以前未发现与CRC或其他癌症有关,包括编码基因组外的几种复发性变化。研究人员分析了参与CRC发展的分子途径,根据基因组特征定义了四个新的微卫星稳定(MSS)CRC常见亚群,并发现了几个罕见CRC分子亚群,其中一些具有潜在的临床相关性,包括微卫星和染色体不稳定性。该研究展示了整个结直肠的一系列突变特征,反映了病因的差异。免疫逃逸驱动突变在高突变肿瘤中几乎无处不在,它们发生在大约一半的MSS CRC中,通常以HLA拷贝数变化的形式出现。许多驱动突变是可操作的,包括与罕见亚组相关的突变(例如BRCA1和IDH1),这突出了全基因组测序在优化患者护理中的作用。

文章发表在Nature
1.CRC中的驱动基因和结构变异
首先,研究人员将CRC分为三种已确定的亚型:MSI(微卫星不稳定性阳性,错配修复缺陷;n=364);POL(DNA聚合酶ε校对缺陷;n=18);MSS(n=1641)。MSS肿瘤呈现出高度可变的倍性,而大多数MSI和POL肿瘤接近二倍体。单碱基替换(SBS)、双碱基替换(DBS)和小片段插入/删除(Indel)突变特征活动与已发表的研究大致一致。为测定不同的背景突变率,研究人员在MSS原发、MSI(全原发)、POL(全原发)和MSS转移CRC中分别进行了碱基对水平的驱动基因鉴定。研究共检测到193个CRC驱动基因(图1a),在多个亚型中确定了57个驱动基因,其中许多候选驱动基因以前没有在任何癌症中报道过。
新驱动基因的相关生物机制包括已知的途径,如WNT和TGFβ-BMP,以及预期之外的功能,如RNA调节(ZC3H13和ZC3H4)和转录控制(例如转录因子GTF2IRD2、MITF等)。同一家族或通路的多个基因经常发生突变。例如,几个RAS–RAF–MEK–ERK和其他MAP激酶途径基因是MSS肿瘤的驱动基因,不仅包括已确立的“主要驱动基因”(KRAS、NRAS或BRAF),还包括几个“次要驱动基因”(五个MAP2或MAP3激酶基因),主要参与JUN激酶激活和向MEK发出信号(图1a)。
研究人员鉴定了简单结构变异(SV)、染色体间易位和复杂SV。在整个队列中提取了9个SV特征(图1b),其中SV8(不平衡反转)和SV9(不平衡易位)以前在CRC中未被发现。通过模拟,在MSS原发性肿瘤中发现了45个非脆性SV热点(视为候选驱动基因改变),在MSI肿瘤中发现3个(图1c)。
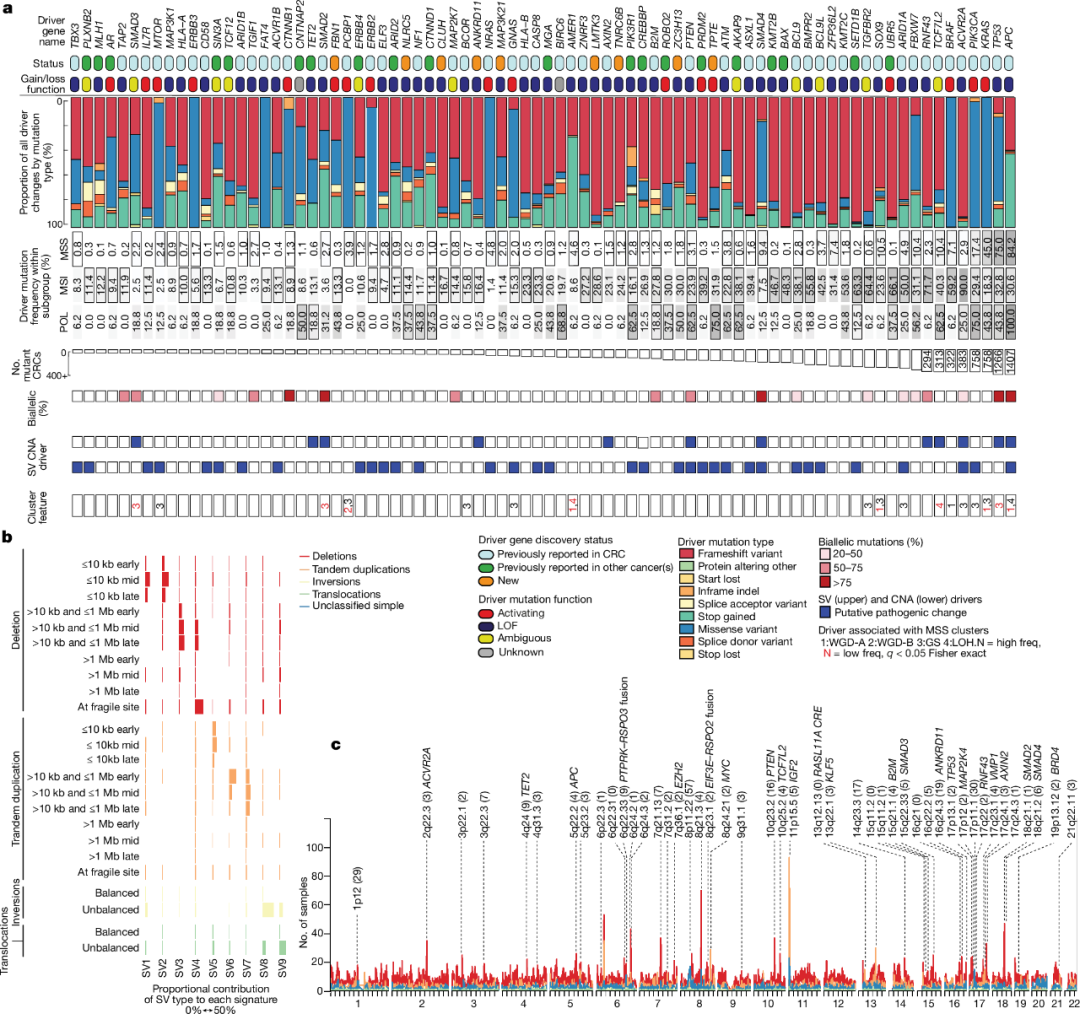
图1. CRC中的驱动基因和SV。
2.常见和罕见CRC亚群
结合Indel、SV和局灶性CNA,研究人员确定了201个驱动基因,大多数候选SV靶基因注释到了小规模突变分析中发现的驱动基因位置,约7%主要受Indel和单核苷酸变异(SNV)影响的驱动基因也存在SV突变,受小规模突变和CNA影响的驱动基因有很多重叠。CRC驱动基因的通路分析确定了许多与肿瘤发生和/或CRC发病机制密切相关的基因集。此外,几乎所有的CRC都有WNT的变化,大多数CRC都有TGFβ-BMP、ERRB-RAS-RAF-MEK-ERK和p53的变化。这些结果表明新的驱动基因直接参与了DNA修复或高频突变,许多肿瘤驱动基因或其他分子特征具有潜在的临床可操作性。
为探索CRC分子亚群的基因组特征,研究人员使用304个分子和临床变量进行了分层聚类。基于CNA数据的癌症,研究发现了1000个原发性、未经治疗的肿瘤病例存在6个稳定的亚群:MSI、POL,以及四个MSS亚群。MSS亚群表示为WGD-A(24%的初治原发MSS)、WGD-B(40%)、基因组稳定(GS;21%)和杂合性缺失(LOH;15%)。MSS亚群中的WGD频率分别为97%、99%、14%和0%(图1a和图2)。所有MSS亚群的SNV和Indel负荷与MSI和POL肿瘤不同。两个WGD亚群都显示出染色体不稳定(CIN)的特征。
MSS-GS癌症显示与CIN相关的事件很少,TP53突变最少(6%),KRAS突变的比例最大(83%),SBS18活性最大(97%)。此外,罕见癌症亚群可以加深我们对肿瘤发生的理解,例如POLE驱动基因突变,它仅发生在1-2%的CRC中,却与异常高的突变负荷和良好的预后有关。
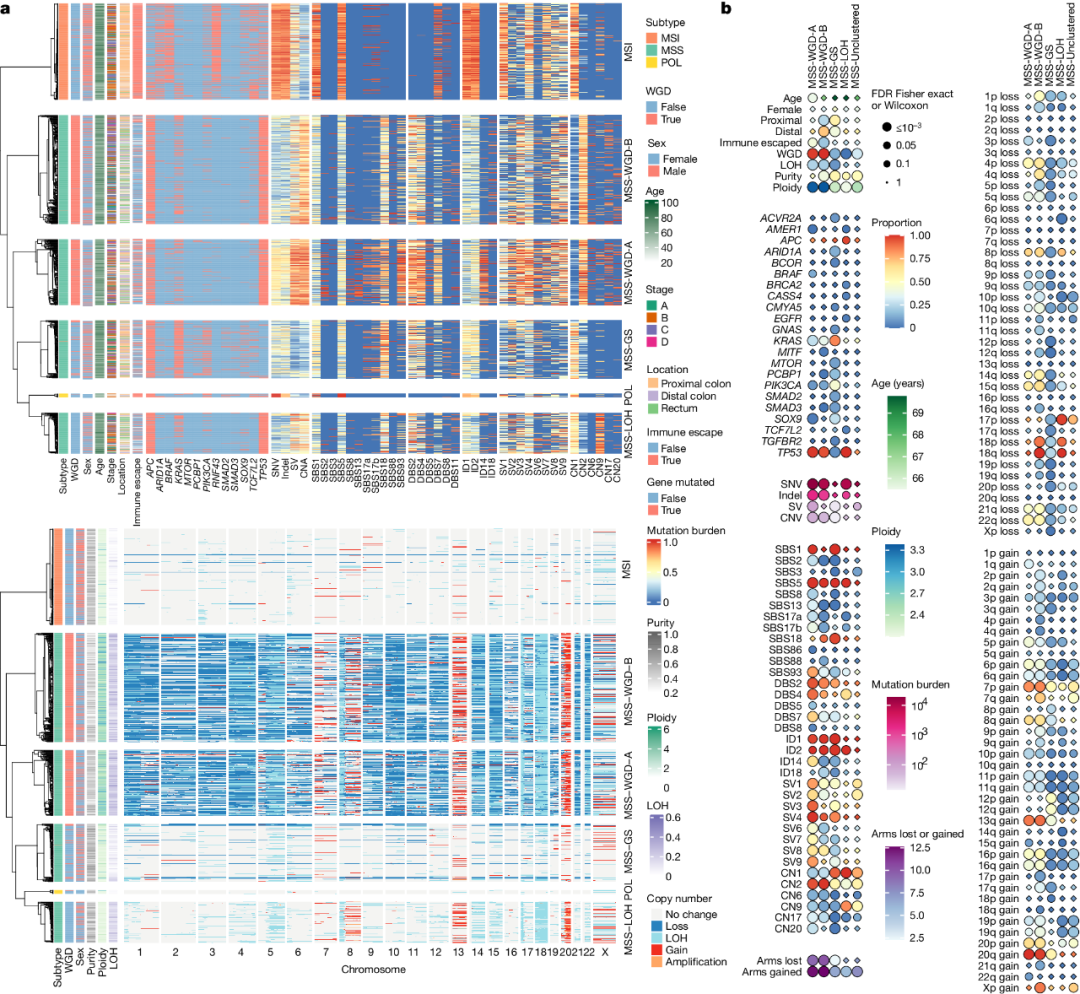
图2. 通过聚类分析鉴定MSS主要CRC分子亚群。
3.CRC的免疫状态
预测的肿瘤新抗原负荷与肿瘤突变负荷(TMB)相关(图3a)。分析显示,最常见的CRC驱动突变往往具有较低的免疫原性(图3b-d),且驱动突变在免疫原性低的患者中更为丰富。此外,由于突变或LOH导致的HLA等位基因功能丧失降低了驱动突变的免疫原性(图3e)。差异免疫原性分析确定了五个具有显著更高突变频率的驱动基因(BRAF、TP53、SMAD4、PIK3CA和KRAS),用于预测免疫原性较低的患者(图3f)。
部分驱动基因(特别是MSI和POL肿瘤中的驱动基因)在免疫和炎症中有公认的作用,特别是免疫逃逸。研究人员分别评估了HLA-A、HLA-B和HLA-C(MHC I型)基因中的等位基因失衡、LOH和蛋白质改变突变,以及一组其他抗原呈递或抗原加工核心基因中的体细胞突变。分析显示,在MSS癌症中,具有免疫逃逸突变的肿瘤具有更高的预测新抗原负荷(图3h)。
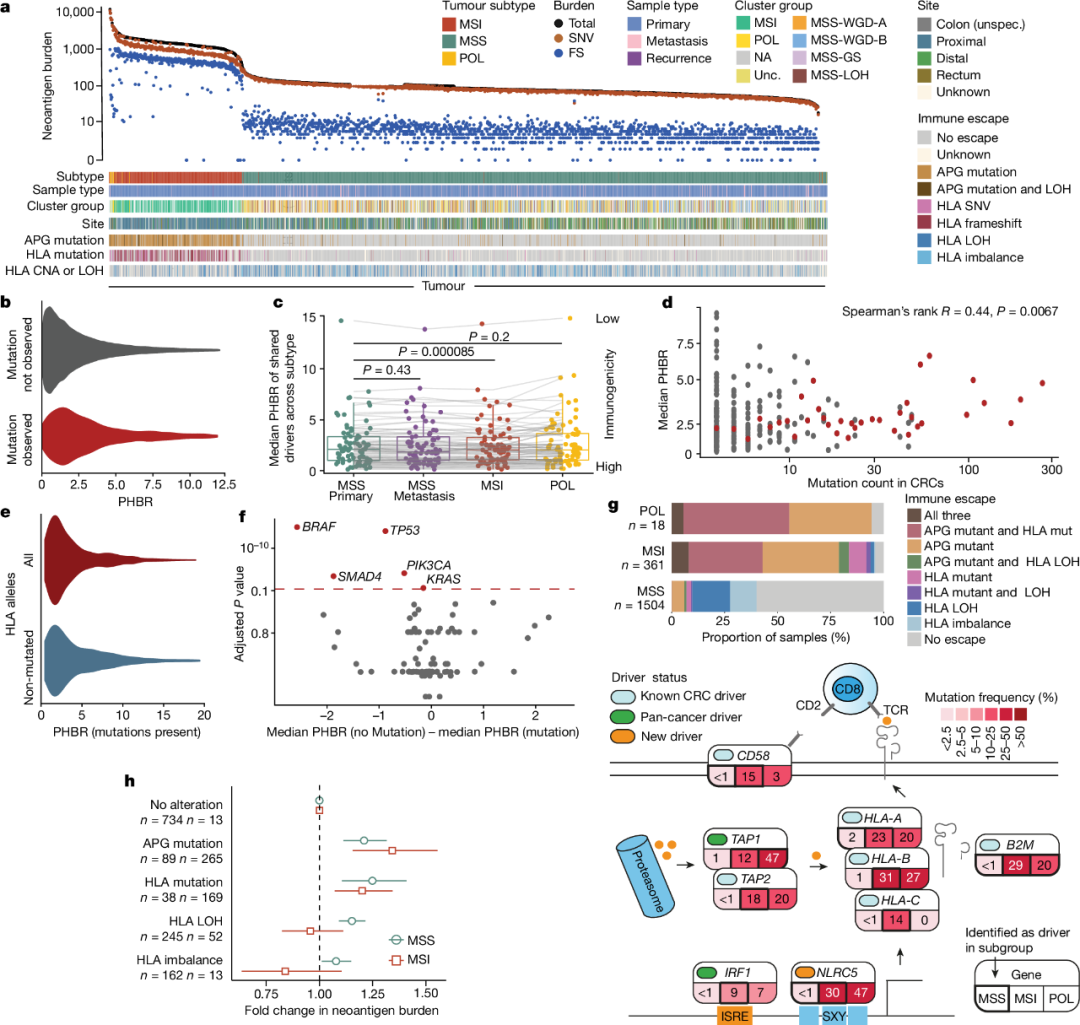
图3. CRC的免疫景观。
4.MSS CRC基因组的解剖学定位
由于解剖学部位与MSI状态共同变化,因此研究人员评估了肠道不同部位MSS原发性CRC的基因组特征。远端肿瘤的SV和CNA数量较多,但SNV和Indel较少(图4)。在远端癌症中也观察到较高的SBS8和较低的SBS1、SBS5、SBS18、ID1和ID2活性(图4)。远端CRC中E. colipks+和大肠杆菌素特征ID18的负荷更高,这一结果与健康结肠一致。
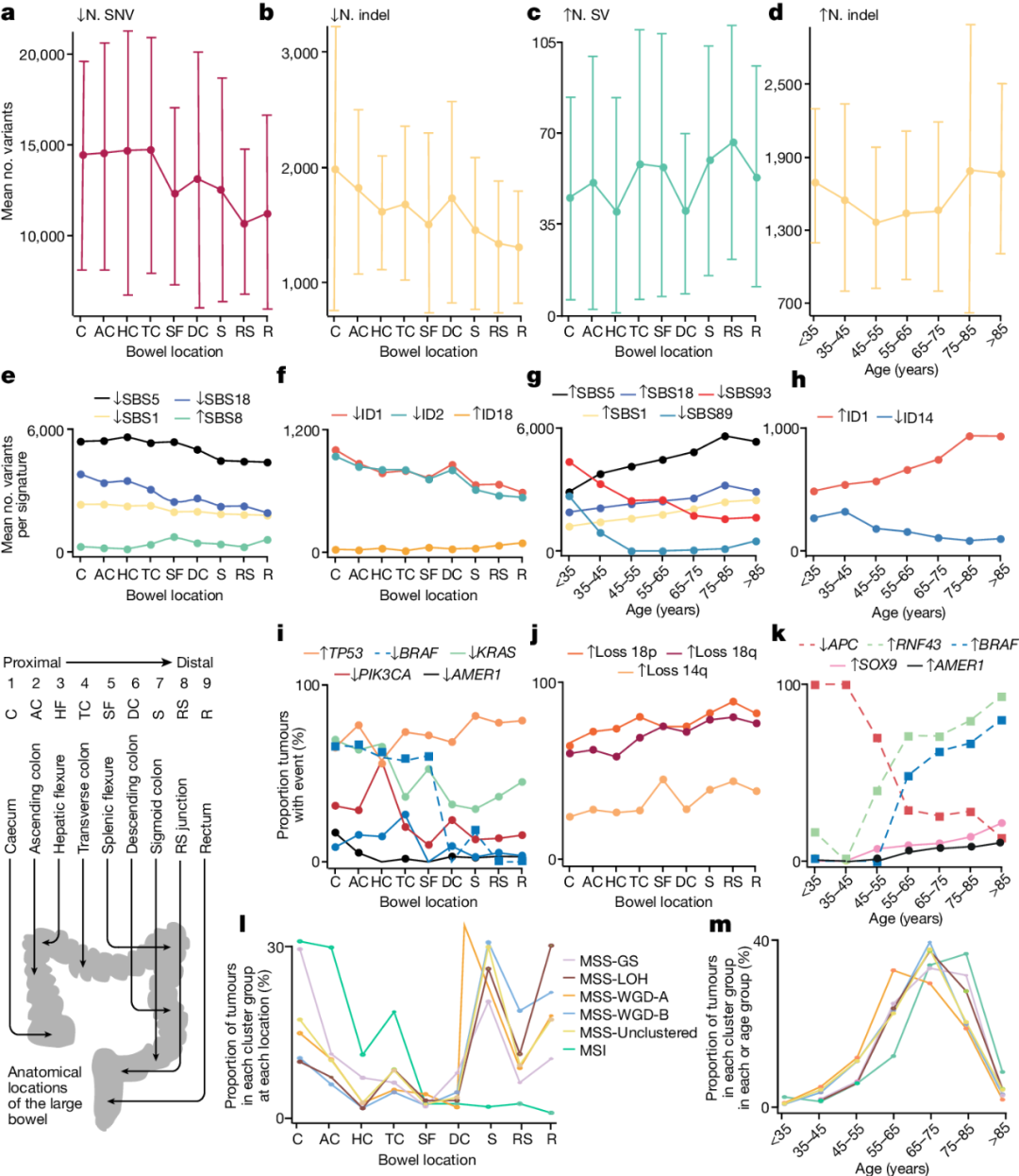
图4. 分子特征随MSS CRC在大肠中的解剖位置和患者发病年龄的不同而变化。
综上所述,该研究对2000多名CRC患者的基因组图谱进行了大规模的全面分析,提供了全面的包含各种类型突变的图谱,检测到许多新的驱动基因,包括SNV、Indel、SV和CNA,并具有潜在的临床意义或实用性。
论文原文:
Cornish, A.J., Gruber, A.J., Kinnersley, B. et al. The genomic landscape of 2,023 colorectal cancers. Nature (2024). https://doi.org/10.1038/s41586-024-07747-9


