Cell:脉络丛参与神经炎症的新发现
时间:2024-09-22 13:00:46 热度:37.1℃ 作者:网络
大脑屏障,包括血脑屏障(BBB)和血脑脊液(CSF)屏障,构成了中枢神经系统的防御前线。在急性炎症状态下,血液中的病原体如HIV、SARS-CoV-2等病毒,以及革兰氏阳性和阴性细菌都可能通过大脑的边界直接侵袭中枢神经系统。这些感染引发的炎症反应与多种神经系统疾病有关,并且常常伴随着脑脊液中的免疫细胞计数升高。这突显了对大脑如何应对和缓解炎症过程的深入理解的迫切需求。脉络丛(ChP)作为血脑脊液屏障的重要组成部分和脑脊液的生产基地,在调节中枢神经系统的物理和生物环境方面扮演着至关重要的角色。因此,深入探索脉络丛如何在神经系统炎症中发挥作用,对于我们理解大脑的免疫反应和开发新的治疗策略具有重要意义。
近日,来自美国波士顿儿童医院和哈佛医学院病理学系的Maria K. Lehtinen教授团队在Cell杂志在线发表了题为“The choroid plexus synergizes with immune cells during neuroinflammation”的研究,通过构建脂多糖(LPS)诱导的小鼠脑膜炎模型,使用清醒小鼠的纵向双光子成像和单细胞转录组学分析发现脉络丛是免疫活动的中心,存在一群特化的脉络丛上皮细胞(inf-Epi)通过基因表达模式响应LPS支持免疫细胞的招募、粘附、存活和分化。

作者首先通过病理学方法分析了确诊为细菌性脑膜炎患者的ChP,并且发现ChP和CSF中存在大量的白细胞。为了阐明这些细胞进入大脑的路径以及脉络丛中的相关调节过程,作者通过向小鼠脑室内单次注射大肠杆菌的LPS来模拟与急性脑感染相关的炎症。使用scRNA-seq技术,作者确认了在LPS注射后24小时,细胞明显渗透进入CSF,并且CSF中的白细胞主要类型为中性粒细胞,并且通过免疫染色和流式细胞术进行了验证。
随后,作者利用活体双光子成像技术,实时观察了LPS注射后小鼠ChP中免疫细胞的积累和渗透过程。发现在LPS注射后的24至28小时内,ChP和脑脊液中出现了大量免疫细胞的涌入,特别是在ChP-CSF界面的某些“热点”区域。此外,通过E-selectin的表达模式,作者确定了可能的白细胞渗出位点,并且进一步证实了在LPS刺激后,CCR2+单核细胞在ChP中的积累,以及它们向CX3CR1+巨噬细胞的分化。在LPS注射后的48至72小时内,ChP中的巨噬细胞数量急剧增加,这些细胞在整个组织中高度活跃,显示出明显的移动性。通过Cx3cr1GFP;Ccr2RFP双标记的小鼠模型,作者发现LPS注射后72小时,ChP中出现了大量双标记的CX3CR1-GFP和CCR2-RFP细胞,表明这些新增加的巨噬细胞主要是由渗透进ChP的单核细胞分化而来。并且巨噬细胞在ChP中的形态发生变化,它们变得具有阿米巴样形态,并在细胞质中形成大的空泡结构,这与它们的吞噬和促愈合状态一致。
接下来,作者通过scRNA-seq深入分析了ChP在炎症反应中的细胞类型和分子机制。他们发现了一种炎症性上皮细胞(inf-Epi),在LPS注射后24小时出现,并表现出与免疫细胞招募和支持相关的基因表达模式。这些细胞不仅分泌了吸引免疫细胞的趋化因子,还表达了与细胞外基质重塑相关的因子如MMPs,这有助于白细胞穿透血脑屏障进入大脑。CellChat分析显示ChP上皮细胞通过CSF1/M-CSF信号积极与巨噬细胞交流,支持它们的存活和分化。中和CSF1/M-CSF的实验表明,这些因子对于巨噬细胞在ChP中的维持至关重要。通过使用抗粘附分子VCAM1和ICAM1的中和抗体,研究揭示了这些分子在巨噬细胞粘附于ChP和参与屏障修复中的必要性。通过ImageStream技术,作者发现了F4/80+巨噬细胞内含有Ly6G/C+中性粒细胞或单核细胞,这进一步证实了巨噬细胞在吞噬过程中的活跃性。此外,研究还发现,LPS处理的小鼠中,CX3CR1+免疫细胞含有occludin,这表明在炎症诱导后,ChP中的巨噬细胞可能通过清除上皮碎片等过程促进了屏障的修复。
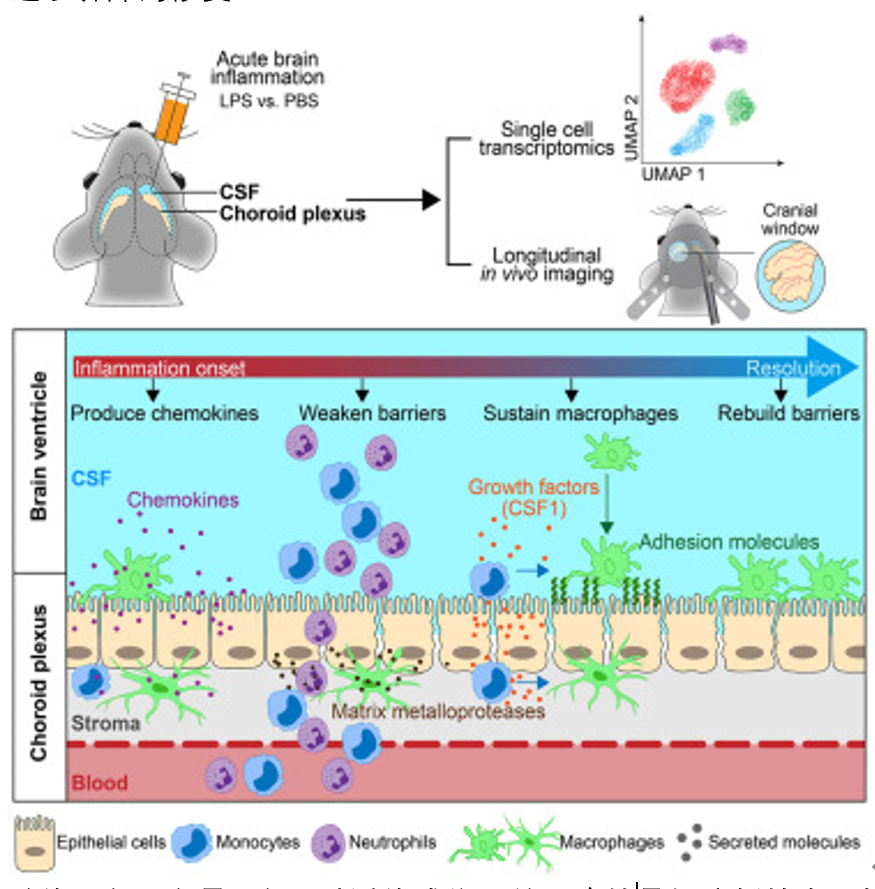
总体而言,这项研究通过活体成像和单细胞转录组分析技术,揭示了ChP在神经炎症中的免疫调节作用。在急性脑膜炎模型中,ChP上皮细胞和巨噬细胞协同响应LPS刺激,通过招募免疫细胞、调节紧密连接和分泌细胞因子,促进炎症的解决和血脑屏障的修复。ChP不仅作为脑脊液的产生地,还充当了免疫器官的角色,对维持中枢神经系统的稳态至关重要。这些发现为理解脑内免疫反应和开发相关疾病的治疗策略提供了新的视角。
原文链接:
https://doi.org/10.1016/j.cell.2024.07.002


