Nature Cell Biology:氨死亡——免疫T死亡新的方式
时间:2024-09-22 11:01:43 热度:37.1℃ 作者:网络
CD8+ T细胞激活后,如何走向死亡,这一直是一个未解之谜。
华中科技大学基础医学院黄波教授团队在 Nature Cell Biology 期刊发表了题为:Ammonia-induced lysosomal and mitochondrial damage causes cell death of effector CD8+ T cells 的研究论文。
该研究发现CD8+ T细胞激活的过程中细胞内氨逐渐积累并最终导致T细胞死亡,揭示了这一独特死亡方式的分子机制,为异己抗原清除后效应T细胞快速死亡这一基本免疫学现象提供了全新解释,并给出全新的“氨死亡”新的命名。

黄波团队发现,在快速增殖的T细胞中,线粒体会分解谷氨酰胺促进T细胞增殖,同时会释放氨;随后,逐渐积累的氨会进入溶酶体,导致溶酶体pH值升高,破坏溶酶体的功能;这又造成细胞中的氨没了去处,滞留在线粒体中,最终线粒体也严重受损,造成效应T细胞死亡。如果抑制谷氨酰胺的分解或阻断溶酶体碱化,可防止氨诱导的T细胞死亡,并改善基于T细胞的抗肿瘤免疫疗法。
黄波团队首先研究了在病原菌感染的条件下,小鼠体内T细胞中氨的水平变化情况。他们发现,在感染的初期阶段,T细胞中的氨水平下降,随后氨水平逐渐上升;在感染的第12天,T细胞中的氨水平达峰,恰好在此时,小鼠体内抗原特异性T细胞大量死亡。
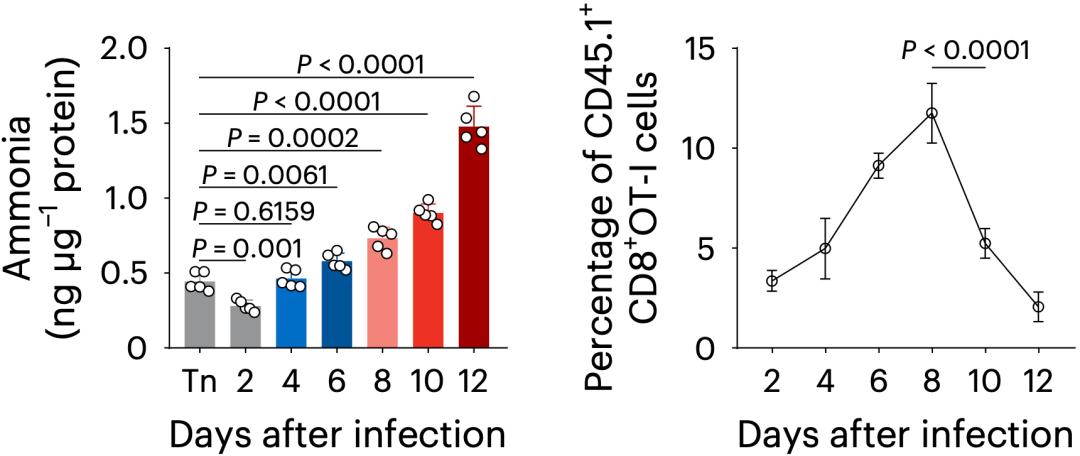
T细胞内氨浓度的变化(左) T细胞水平的变化(右)
体外刺激实验显示,在T细胞被抗原激活的第10天,效应T细胞中出现大量氨,随后细胞大量死亡。需要指出的是,此时培养基中未检测到氨的存在,直到培养到第16天,才在培养基的上清液中检测到氨。显然,氨确实是T细胞自己产生的。
CD8+ 效应性T细胞激活时间的延长,细胞内氨逐渐累积。外来抗原被清除后,效应性T细胞内氨迅速增加,导致细胞快速死亡。与记忆性T细胞不同,效应性T细胞低表达尿素循环关键限速酶氨基甲酰磷酸合成酶-1(CPS1),无法通过尿素循环将氨转化为尿素排出细胞外。而过表达CPS1或使用氨清除剂能够显著减少效应性T细胞死亡,提示氨的累积可能是触发CD8+效应性T细胞死亡的重要因素。
CD8+效应性T细胞在激活过程中需要利用谷氨酰胺代谢为细胞的生长和增殖提供前体物质。在效应性T细胞增殖活跃的早期阶段,效应性T细胞利用谷氨酰胺代谢产生的氨,快速进入合成代谢途径,避免了细胞内氨的浓度升高。然而,在效应性T细胞的晚期阶段,细胞增殖逐渐停滞,而此时谷氨酰胺代谢产生的氨,在细胞内累积。
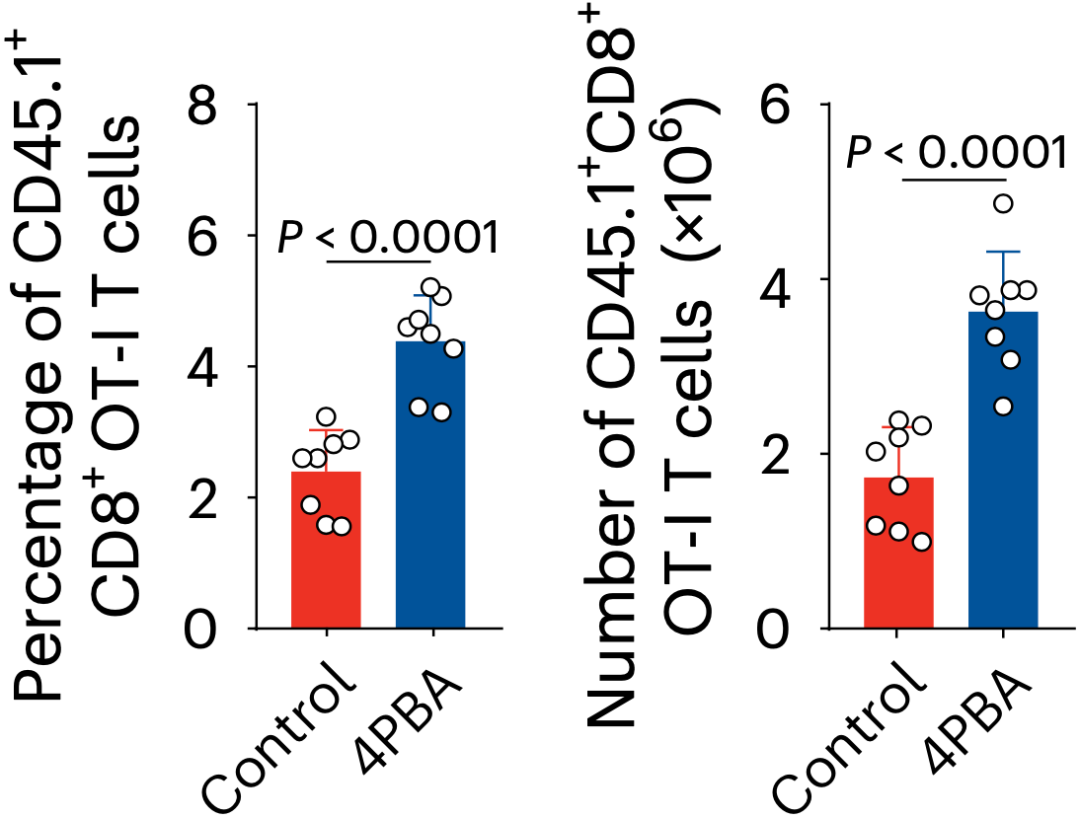
清除氨能让效应T细胞活下来
随后,黄波团队分析了氨浓度升高导致细胞死亡的方式。结果发现,不是凋亡,也不是铁死亡和坏死。这说明,氨积累导致的死亡方式,可能是一种新的、未被发现的方式。研究发现毒杀效应T细胞的氨,主要是线粒体中的谷氨酰胺酶1(GLS1)催化谷氨酰胺产生的。
氨是一种弱碱性分子(pKa 9.3),其生成在线粒体内完成。新生的氨离开线粒体,会利用钾离子通道将氨排出,而游离的氨通过氨转运体RHCG进入酸性细胞器溶酶体内,与H+结合生成铵根离子NH4+,导致溶酶体pH值升高及其功能受损。进一步地,胞浆中的氨不能流向溶酶体,却返流回线粒体,导致线粒体损伤。受损的线粒体可通过自噬途径进行自我清除,但溶酶体pH值的升高,抑制了自噬溶酶体的酶解,阻碍了对损伤线粒体的清除,最终导致效应性T细胞的死亡。基于效应T细胞与众不同的上述死亡特征,黄波团队将效应T细胞的这种死亡方式命名为氨死亡。
此外,用可以清除氨的药物4-苯基丁酸(4PBA)处理受感染的小鼠,可以观察到在感染的第14天后,抗原特异性效应T细胞的数量还在增加,同时氨水平下降。
阻断氨死亡可通过提高T细胞的持久性来增强抗肿瘤细胞免疫。
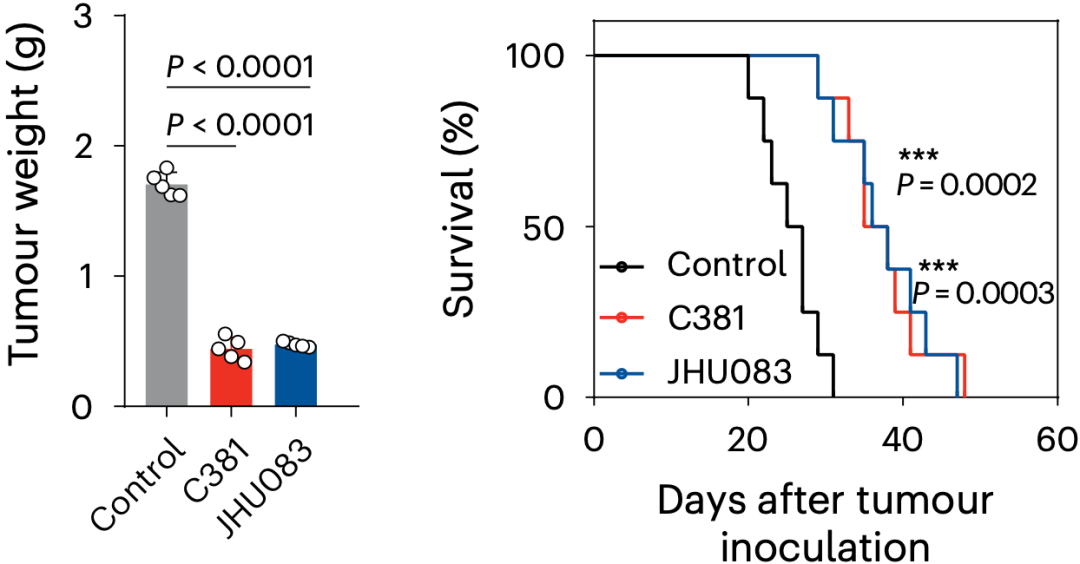
抑制氨死亡,可以提升抗肿瘤免疫
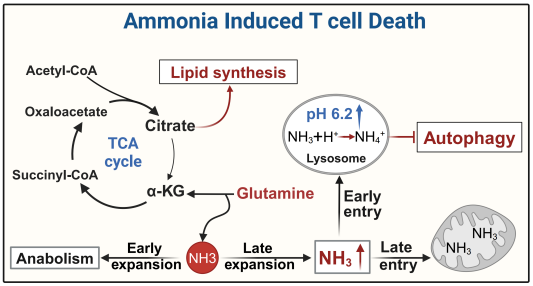
总之,在T细胞过继治疗的研究中,研究团队还发现肿瘤微环境中过继的CD8+效应性T细胞内氨逐渐积累。通过抑制谷氨酰胺代谢或过表达CPS1降低T细胞内氨水平,可以显著提高T细胞在肿瘤微环境中的存活,并增强其抗肿瘤效应。
更重要的是,这一发现有可能催生一个新的抗癌领域——抑制氨死亡。无论是将抑制氨死亡的抑制剂与免疫治疗药物联用,还是用氨死亡抑制剂预处理过继性T细胞,都有望给癌症患者带来新的治疗选择。
原始出处:
Zhang H, Liu J, Yuan W, Zhang Q, Luo X, Li Y, Peng Y, Feng J, Liu X, Chen J, Zhou Y, Lv J, Zhou N, Ma J, Tang K, Huang B.Ammonia-induced lysosomal and mitochondrial damage causes cell death of effector CD8(+) T cells.Nat Cell Biol. 2024 Sep 11. doi: 10.1038/s41556-024-01503-x


