EHJ:北京大学孔炜/丛馨发现靶向内皮紧密连接处,以预测和保护胸主动脉瘤和夹层
时间:2023-01-22 15:01:35 热度:37.1℃ 作者:网络
内皮紧密连接(TJs)的改变是否导致胸主动脉瘤和夹层(TAAD)的形成,并作为早期指标和治疗靶点仍然是未知的。
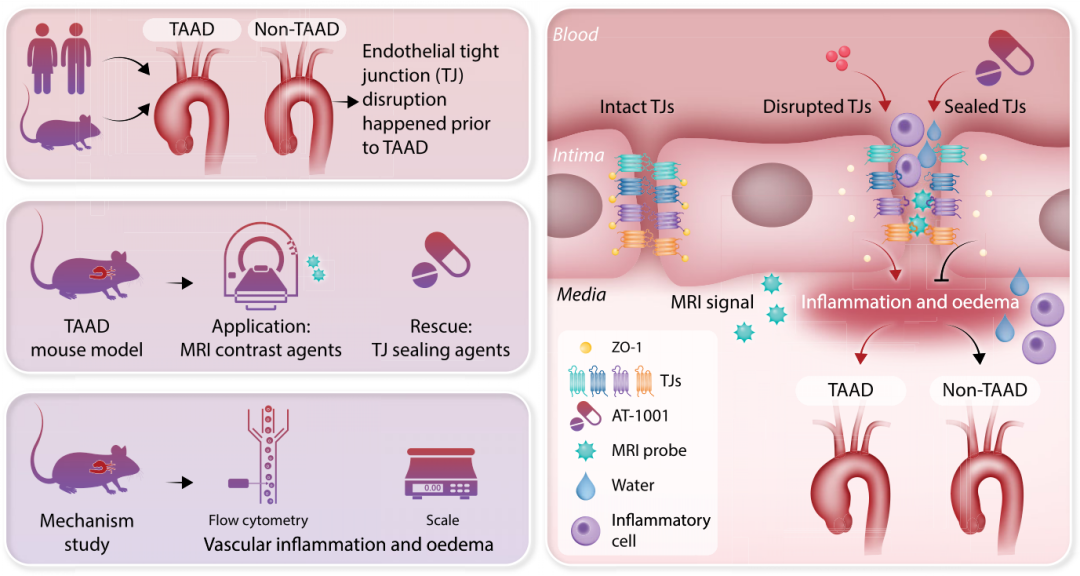
2023年1月14日,北京大学孔炜及丛馨共同通讯在European Heart Journal(IF=36)在线发表题为“Targeting endothelial tight junctions to predict and protect thoracic aortic aneurysm and disdiv”的研究论文,该研究表明靶向内皮紧密连接处,以预测和保护胸主动脉瘤和夹层。单细胞RNA测序分析显示TAAD患者胸主动脉内皮细胞TJ表达异常。在β-氨基丙腈(BAPN)诱导的TAAD小鼠模型中观察到,胸主动脉内皮TJ功能在早期被破坏,而面部染色则显著降低了TJ关键成分的细胞间分布。为了无创检测内皮TJ功能,将分子量为4和70 kDa的两种右旋糖酐与磁共振成像(MRI)造影剂Gd-DOTA偶联,合成FITC-右旋糖酐-DOTA-Gd和罗丹明B-右旋糖酐-DOTA-Gd。MRI图像显示,这两种探针都聚集在喂食BAPN的小鼠的胸主动脉中。特别是,在5-10天累积信号增加的小鼠在14天出现TAAD,而在两个时间点之间信号相似的小鼠则没有出现TAAD。
蛋白酶激活受体2抑制剂AT-1001可以密封TJs,减轻BAPN诱导的内皮TJ功能和表达损伤,从而降低TAAD的发生率。值得注意的是,内皮靶向ZO-1条件敲除增加了TAAD的发病率。机制上,在喂食BAPN的小鼠的胸主动脉中观察到血管炎症和水肿,而这些现象被AT-1001减弱。这表明内皮TJ功能的破坏是TAAD形成之前的早期事件,因此可以作为TAAD的潜在指标和有希望的靶点。

胸主动脉瘤夹层(TAAD)是一种死亡率很高的心血管疾病。迄今为止,对TAAD发病机制的了解主要集中在弹性纤维退化和内侧退变,因为遗传证据表明基因突变与TAAD的进展相关。如与平滑肌细胞(SMC)收缩功能相关的基因(如ACTA2、MYH11、MYLK和PRKG1),细胞外基质重塑(如FBN1、MFAP5和LOX),典型转化生长因子(TGF)-β信号(如TGFBR2、TGFBR1、SMAD3、TGFB2和TGFB3),和参与SMC代谢(如MAT2A)或存活(如FOXE3)的蛋白质。然而,很少有人关注在维持血管屏障功能中起关键作用的内膜内皮细胞(ECs)。
在ECs中,紧密连接(TJs)和粘附连接(AJs)主要构成血管屏障,有助于维持内皮的完整性,保护血管免受渗透和炎症。值得注意的是,TJs局限于ECs的最尖外侧区域,更容易受到环境线索的影响。TJs是一种高度动态的结构,由跨膜蛋白、连接粘附分子(JAMs)和细胞质支架蛋白组成。内皮TJs的表达、分布和结构的改变已经在血管疾病和病理中被发现。然而,TJ功能障碍是否参与TAAD的进展尚未确定。
有趣的是,一份病例报告显示,JAM-A是自发性冠状动脉夹层易感性的最高优先遗传候选基因,机制未知。另一项研究报道ECs中分解素和金属蛋白酶-17 (ADAM17)的缺乏通过保留AJ和TJ的表达来保护内膜屏障的完整性,从而抑制胸主动脉瘤的形成,尽管TJs和动脉瘤之间的因果关系仍然不明确。
机理模式图(图源自European Heart Journal )
由于TAAD以内膜撕裂为特征,TJs主要构成EC屏障的完整性,作者推测异常的内皮TJs可能参与了TAAD的发病。在这里,作者观察到在小鼠TAAD形成之前内皮TJs的实时破坏,并通过应用AT-1001来防止TAAD,从而提高TJ的密封性。此外,作者重新设计并合成了一种针对TJs的磁共振成像(MRI)探头,用于TAAD的无创早期检测。
原文链接:
https://doi.org/10.1093/eurheartj/ehac823