实体肿瘤临床疗效评价标准(RECIST 1.1) | 干货收藏
时间:2024-10-14 23:01:13 热度:37.1℃ 作者:网络
上世纪90年代,由国际专家工作组开始研究制定新的” 实体肿瘤疗效评价标准”,并于2000年发布,称为RECIST(Response Evaluation Criteria in Solid Tumours)。RECIST是评估抗肿瘤治疗效果的主要方法之一。为临床医生提供了一种量化和标准化评估治疗效果的方法。下面重点就RECIST 1.1版作介绍。
一、病灶基线的分类
01 可测量病灶
(1) 至少有一条可以精确测量的径线的病灶。
(2) 根据CT或MRI评价,病灶最长直径至少为10 mm。
(3) 根据胸部X线评价,病灶最长直径至少20 mm。
(4) 根据测径器评价,最长直径≥10 mm的浅表性病灶。
(5) 恶性淋巴结:病理学增大且可测量,单个淋巴结CT扫描短径须≥15 mm(CT扫描层厚推荐不超过5 mm)。基线和随访中,仅测量和随访短径。
注:恶性肿瘤淋巴结用最短轴作为直径,其他可测量病灶用最长轴。
02 不可测量病灶
(1) 不可测量病灶包括小病灶(包括短轴在10-14.9 mm的淋巴结)和真正无法测量的病灶,如胸膜或心包积液、腹水、炎性乳腺疾病、软脑膜病、累及皮肤或肺的淋巴管炎,测径器不能准确测量的临床病灶,体检发现的腹部肿块,重现影像技术无法测量的。
(2) 骨病:骨病为不可测量的疾病,除软组织成份可采用CT或MRI评价外,且符合基线时可评价的定义。
(3) 既往局部治疗:既往放疗病灶(或其他局部治疗的病灶)为不可测量病灶,除非治疗完成后进展。
03 目标病灶
在基线评估中,每个器官最多有2个病灶,总共不超过5个病灶,所有这些可测量的病灶都被视为目标病灶。应选择那些大小(即最长病灶)和适合度适合的目标病灶,以确保它们能够被精确且重复地测量。记录每个病灶的最长直径,而对于病理学淋巴结,则应记录其短轴。在基线时,所有目标病灶的直径(对于非结节病灶是最长直径,对于结节病灶是最短轴)的总和,将作为试验中进行评估和比较的基础。(1) 若两个病灶融合,就测量融合的肿块。如果目标病灶分裂,则使用各部分的总和。(2) 应继续记录变小的目标病灶的测量。如果目标病灶变的太小而不能测量,如认为病灶已消失则记录为0 mm;反之应记录为默认值5 mm。
注:结节性标准缩小至<10 mm(正常),仍应记录实际测量结果。
04 非目标病灶
所有无法测量的病变都被归类为非目标病变。此外,所有未明确识别为目标病变的可测量病变也被包括在非目标病变范畴内。这些病变虽然不需要进行具体的尺寸测量,但它们的评估可以分为无病变、不确定、存在但未增大、以及增大等几种情况。如果一个器官内存在多个非目标病变,在病例报告表中可以将其记录为一个条目(如:‘多发性骨盆淋巴结增大’或‘多发性肝转移’)。
二、病灶的测量
01 测量时机
肿瘤疗效评估有一条基线,所有基线评估必须尽可能在接近治疗开始前进行,不能早于4周。
02 方法的选择
在评价同一个病灶时,基线和随诊应使用同样的技术和方法。一般来说,病灶必须采用影像学手段进行评价,不能单纯采用临床检查。只有在 10 mm 以下的表浅病灶(如皮下小结)考虑使用测径器来进行临床检测。皮肤表浅病灶建议使用彩色照片记录,照片附上测量病灶大小的比例尺。当病灶既可用临床检测也可用影像学检查时,首选影像学检查。
-
胸部 X 片:CT 在发现新病灶等方面比 X 片更敏感,故优先选用 CT,特别是在重要的治疗终点时。
-
CT或MRI:CT(层厚 ≤ 5 mm)是目前用来评估病灶疗效最有效和重复性最好的检测方法;MRI 在全身扫描时可用。
-
超声检查:超声结果很大程度上依赖于检查者的操作,不适用于评估病灶大小,不应用于测量方法。
-
内镜、腹腔镜:常规评估实体瘤并不应用,但在用活检证实完全的病理学缓解或确定完全缓解或手术切除后的再发时是有益的。
-
肿瘤标志物:肿瘤标记物不能单独用于评估实体瘤疗效。若用来判断病人完全缓解,标记物必须正常化,如 CA-125 的变化(在卵巢癌复发中)和 PSA 的变化(在前列腺癌复发中)。
-
细胞学、组织学:必要时可用来区分部分缓解和完全缓解。
三、肿瘤近期疗效评价标准
01 目标病灶
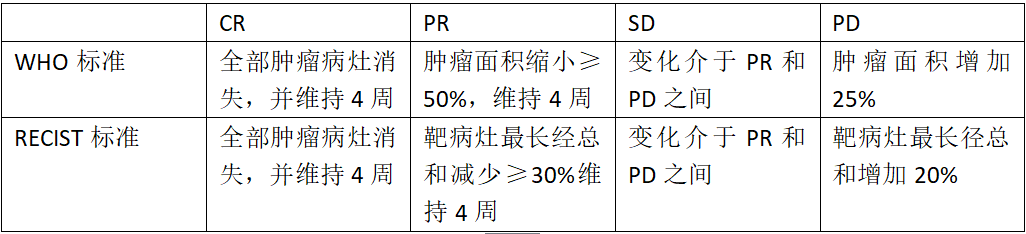
(1) 完全缓解(CR):除结节性疾病外,所有目标病灶完全消失。所有目标结节须缩小至正常大小 (短轴<10 mm)。所有目标病灶均须评价。
(2) 部分缓解(PR):所有可测量目标病灶的直径总和低于基线≥30%。目标结节总和使用短径,而所有其它目标病灶的总和使用最长直径。所有目标病灶均须评价。
(3) 疾病进展(PD):以整个实验研究过程中所有测量的靶病灶直径之和的最小值为参照,直径和相对增加至少20%(如果基线测量值最小就以基线值为参照);除此之外,必须满足直径和的绝对值增加至少5 mm (临床用药评价公众号:出现一个或多个新病灶也视为疾病进展)。
(4) 疾病稳定(SD):靶病灶减小的程度没达到PR,增加的程度也没达到PD水平,介于两者之间,研究时可以直径之和的最小值作为参考。
(5) 不确定。未记录进展,且
-
1个或以上可测量的目标病灶未评价
-
或所用评价方法与基线不一致
-
或1个或以上目标病灶不能准确测量(如:看不清除,除非由于太小而不能测量)
-
或1个或以上目标病灶被切除或辐射,且未复发或增大。
02 非目标病灶
(1) CR:所有非目标病灶消失或肿瘤标志物水平正常。所有淋巴结大小必须‘正常’(短轴<10 mm)。
(2) 非CR/非PD:任何非目标病灶持续存在和/肿瘤标志物水平高于正常上限。
(3) PD:已有病灶明确进展。通常,总体肿瘤负荷须增大到足以停止治疗。目标病灶SD或PR时,罕见由于非目标病灶明确增大的进展。
(4) 不明确:未测量进展,1个或以上非目标病灶部位未评价或评价方法与基线所用方法不一致。
03 新病灶
任何新发现的明确恶性肿瘤病变均指示病情进展(PD)。对于那些不够明确的新病变,比如由于它们体积小,需要进一步评估以确定其性质。若后续评估确认了这些病变的存在,那么病情进展应从最初的评估日期起算。在以前未曾扫描到的区域发现的病变也被归类为新病变。
04 疗效的确认
-
评价为 CR 或 PR 的患者必须在至少 4 周后重复评估确认。
-
评价为 SD 的患者应在方案规定的间隔时间后重复评估确定(一般不低于 6-8 周)。
-
如果明确 CR 取决于体积减小但未完全消失的残留病灶,建议活检或细针抽吸残留病灶进行研究。如未发现疾病,主观状况记录为 CR。
-
如果明确进展取决于可能由于坏死增大的病灶,那么病灶应活检或细针抽吸以明确状态。
05 总疗效评价
在评价病灶时,既要评价目标病灶,还要评价非目标病灶,还要看有无新病灶出现。有时候还需要根据临床研究的目的和观测指标确定。有些临床研究要求在一定时间后对CR和PR的病例进行确认。对于病灶的随访和重新评估,一般间隔6-8周。当然也可以根据不同的临床和研究情况缩短和延长。

06 有效率(RR)和疾病控制率(DCR)
RR等于(CR+PR)总例数×100%。
DCR等于(CR+PR+SD)总例数×100%。
单独使用客观缓解率(Objective Response Rate, ORR)可能无法充分描述试验药物的抗肿瘤活性,故需要同时描述性分析缓解持续时间(即从初始肿瘤缓解到疾病进展或任何原因导致死亡的时间,以先发生者为准)和至缓解时间。对于通过稳定疾病病情使患者临床获益的药物,也可以分析DCR,该指标不仅考虑疾病缓解病例,还包括疾病维持稳定状态持续一定时间的病例。
四、总结
RECIST 1.1 提供了一个客观、统一的评价体系,有助于不同研究之间结果的比较和交流。然而,在实际应用中,临床医生需根据具体情况和研究目的,灵活运用该标准,并结合其他评价手段,以全面评估抗肿瘤治疗的效果。
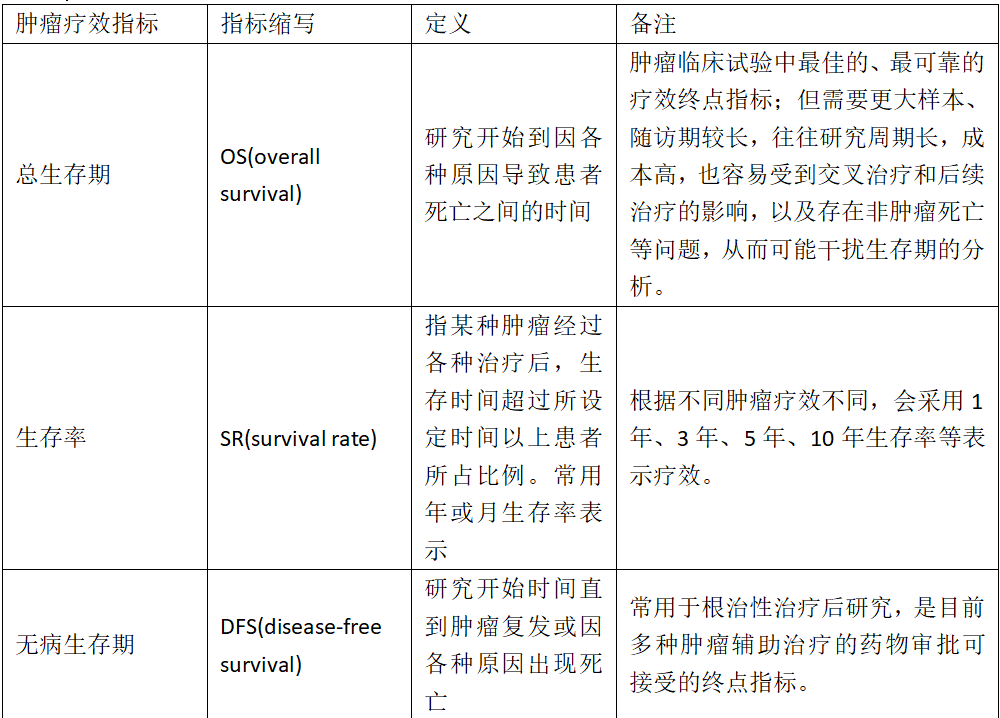
临床常用肿瘤疗效指标一览表
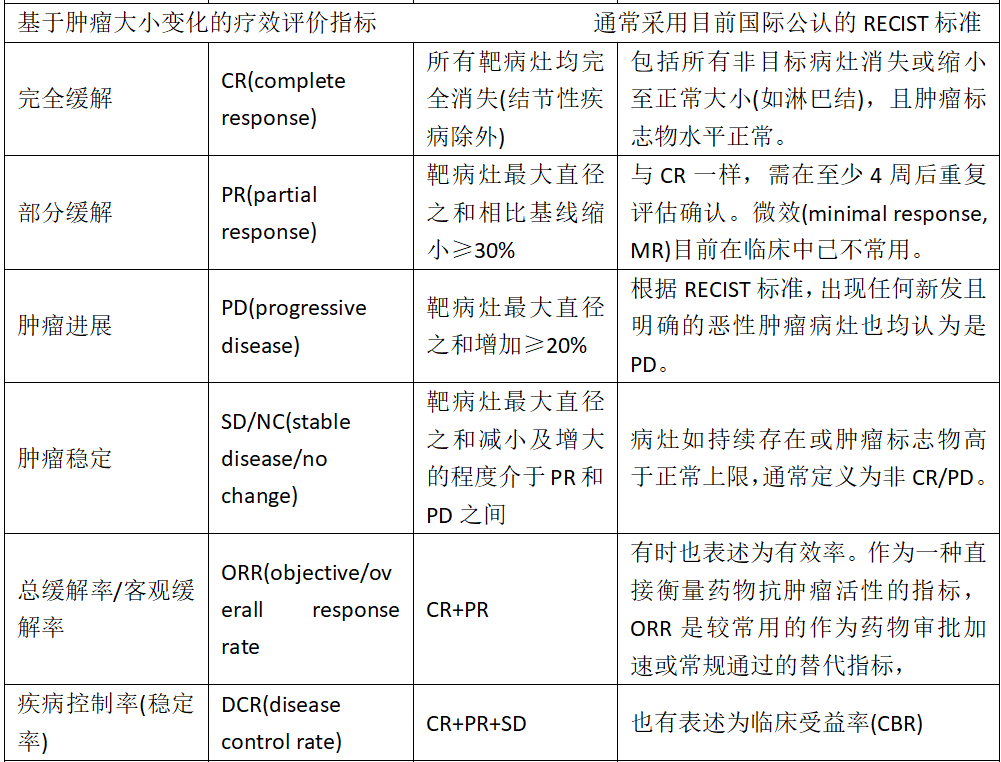

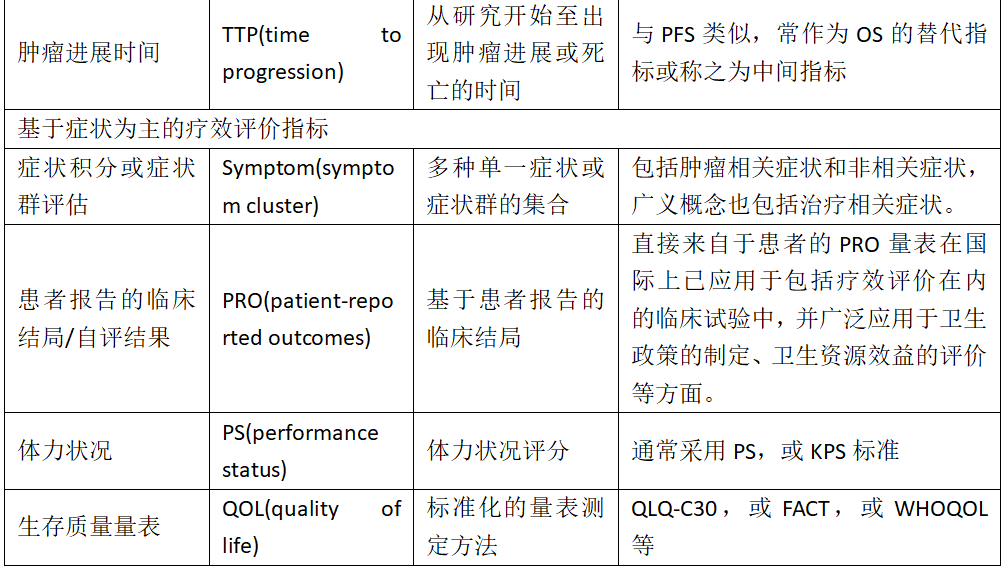
WHO标准和RECIST标准一览表
参考资料:
[1] New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1.1)
[2] 实体瘤中医疗效评价标准的再优化与实施. 中医肿瘤学杂志, 2023, 5(0):1-5.
[3] 客观解读RECIST(修订版)的临床评价意义. 中国实用外科杂志, 2010, 30(1):31-33.
[4] Schwartz L H, Litière S, de Vries E, et al. RECIST 1.1-update and clarification: from the RECIST committee[J]. European journal of cancer, 2016, 62: 132-137.
[5] 柳影, 程颖. 实体肿瘤疗效评价标准的研究[J]. 实用肿瘤学杂志, 2004, 18(2):4.
[6] 张贺龙. 实体瘤疗效评价标准及演变[J]. 现代肿瘤医学, 2010, 18(5):3.
[7] 丁婕, 戴旭, 孟宪运,等. 实体瘤疗效评价标准的研究进展[J]. 中国肿瘤临床与康复, 2015(9):3.
[8] 《抗肿瘤药物临床试验统计学设计指导原则(试行)》.2020.
[9] ICH. E9 (R1) Addendum on estimands and sensitivity analysis in clinical trials to the guideline on statistical principles for clinical trials. 2019.


