甲状腺结节检出EIF1AX突变有什么意义?
时间:2024-10-14 23:01:15 热度:37.1℃ 作者:网络
EIF1AX 突变被癌症基因组图谱(TCGA)研究识别为甲状腺乳头状癌(PTC)的驱动突变。随后的研究证实了 PTC 和间变性甲状腺癌(ATC)中该突变,但也报道了滤泡结节性病变(FND)和良性甲状腺结节中存在 EIF1AX 突变。本研究回顾了两个机构的 EIF1AX 突变甲状腺结节:三级医院(YNHH,n=22)和大型癌症转诊中心(MSKCC,n=34),报告了在其他分子异常和机构实践的背景下不同的组织形态学。根据 WHO 第 5 版分类对病理诊断进行回顾,并与 EIF1AX 突变类型和其他共存的分子改变(如果有)相关联。大多数病例为剪接位点类型突变。病例包括 9 例 FND、7 例滤泡性腺瘤(FA)或嗜酸细胞腺瘤(OA)、2 例具有乳头状核特征的非浸润性滤泡性甲状腺肿瘤(NIFTP)和 38 例滤泡细胞起源的甲状腺癌。在 8 例孤立性 EIF1AX 突变的病例中,7 例为 FND、FA 或 OA(88%),1 例为嗜酸细胞癌(12%)。在 12 例同时携带 EIF1AX 突变和 1 个其他分子改变的病例中,9 例(75%)为 FND、FA 或 OA,2 例(17%)为 NIFTP,1 例(8%)为低分化甲状腺癌。所有 36 例同时携带 EIF1AX 突变和 ≥ 2 个其他分子改变的病例均为恶性(100%),包括 TP53 和 TERT 启动子突变与 ATC(n=8)和高级别滤泡细胞起源的非间变性癌(HGC,n=2)相关。孤立性 EIF1AX 突变仅在 YNHH 的甲状腺结节中观察到,并且主要在良性甲状腺结节中遇到(包括 FND)。额外分子异常的积累似乎与恶性肿瘤进展相关。
研究背景
真核翻译起始因子 1A,X 连锁(EIF1AX)基因编码真核翻译起始因子 1A(eIF1A),43S 起始前复合物(PIC)的重要组成部分。eIF1A 稳定三元复合物(Met-tRNAi:eIF2:GTP)与 40S 核糖体亚基的结合,形成 43S PIC,然后将其募集到加帽 mRNA 的 5' 端,形成 48S 起始前复合物。该复合物随后开始扫描过程以定位起始密码子并启动蛋白质翻译。EIF1AX 突变改变 eIF1A 的 RNA 结合表面,导致 43S 和 48S 前起始复合物形成缺陷,干扰蛋白质翻译。翻译起始失调在肿瘤发生中常见。此外,在体外,E1F1AX 过表达增加细胞周期调节因子 Cyclin D1 的表达,触发细胞增殖。EIF1AX 基因突变最初是在葡萄膜黑色素瘤中发现的,之后,在其他癌症中也有报道,包括低级别胶质瘤、肺癌、子宫癌、卵巢癌和甲状腺乳头状癌(PTC)。甲状腺癌基因组图谱研究认为 EIF1AX 基因突变是甲状腺癌变的驱动事件,报告 EIF1AX 突变存在于 1.5% 的高分化甲状腺癌,与其他分子异常几乎相互排斥。随后的研究发现,大约 1-2% 的 PTC、5% 的滤泡状甲状腺癌(FTC)和 10% 的低分化甲状腺癌(PDTC)和间变性甲状腺癌(ATC)存在 EIF1AX 突变。然而,TCGA 研究受到人群选择的限制,不包括良性病变。之后,在良性甲状腺结节中观察到该突变。
在不同研究中观察到孤立性 EIF1AX 突变赋予的恶性风险(ROM)存在显著差异,范围从 13% 到约 50% 不等,但肿瘤通常是低风险的。EIF1AX 剪接位点突变,以及当 EIF1AX 突变与其他分子改变(如 TP53 或 RAS 突变)共存时,ROM 更高,与侵袭性表型相关。根据世界卫生组织新的第 5 版内分泌肿瘤分类(WHO 第 5 版),我们探索了两种环境下甲状腺病变中 EIF1AX 突变的发生,首先报告了我们在三级医院 [耶鲁纽黑文医院(YNHH)] 的一般人群中遇到的细胞学不确定且携带 EIF1AX 突变的甲状腺结节的经验。由于 EIF1AX 与恶性肿瘤的相关性不断被强调,我们还试图通过将研究扩展到来自转诊癌症中心 [纪念斯隆凯特琳癌症中心(MSKCC)] 的一组单独的甲状腺肿瘤患者来分析 EIF1AX 突变在各种甲状腺癌中的分布,以了解分子异常及其表型相关性是否受到机构实践的影响。
研究结果
YNHH患者
研究期间,YNHH 有 916 例 TBSRTC III 类和 IV 类细胞学标本进行了分子检测,48 例(5.2%)存在 EIF1AX 突变。其中,22 例患者 [17 例(77%)女性,5 例(23%)男性,中位年龄 66(范围,44 – 81)岁](表 1)接受了手术切除。细胞学诊断包括意义未明的非典型(AUS)15 例,滤泡性肿瘤(FN)4 例,嗜酸细胞滤泡性肿瘤(OFN)3 例。8 例仅存在 EIF1AX 突变,14 例还存在至少 1 个其他分子改变。回顾了甲状腺切除术标本,根据新的第 5 版 WHO 肿瘤分类对目标结节进行了组织病理学诊断。有 9 例滤泡结节性病变(FND)、3 例滤泡性腺瘤(FA)、4 例嗜酸细胞腺瘤(OA)、1 例血管浸润性滤泡状甲状腺癌(A-FTC)、1 例嗜酸细胞(Hurthle细胞)癌(OCA)和 2 例高级别滤泡细胞起源的非间变性癌(HGC)[1 例高级别滤泡状甲状腺癌(FTC)和 1 例低分化甲状腺癌(PDTC)]。2 例具有滤泡生长模式、拥挤、核大伴透明和散在核沟的病例被归类为具有乳头状核特征的非浸润性滤泡性甲状腺肿瘤(NIFTP)(表 1,图 1)。在被归类为腺瘤和 NIFTP 的病例中,整个甲状腺叶(n=2)、结节(n=1)或包膜(n=1)最初完全提交。
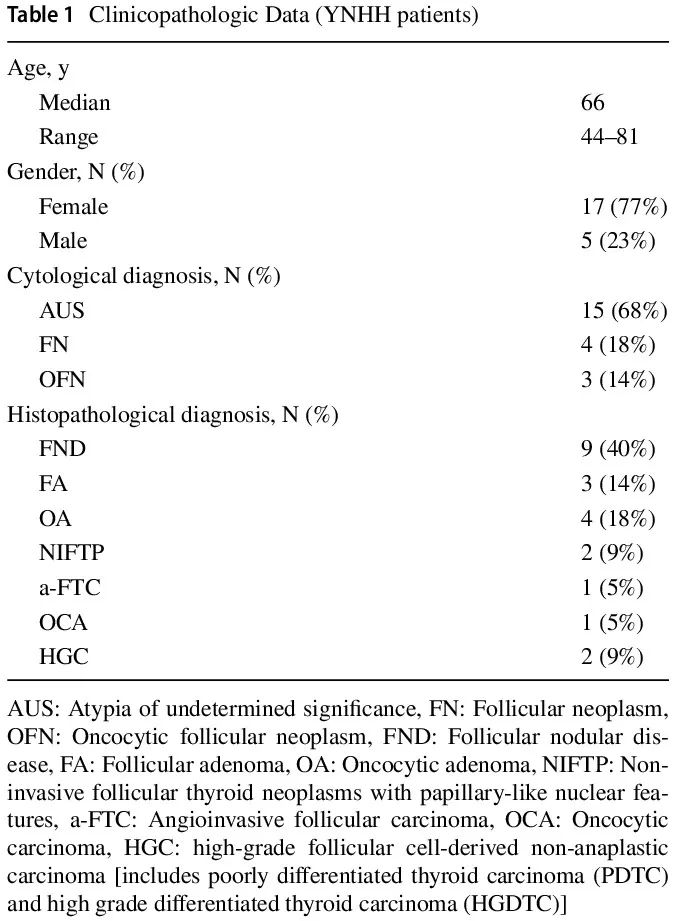
表1
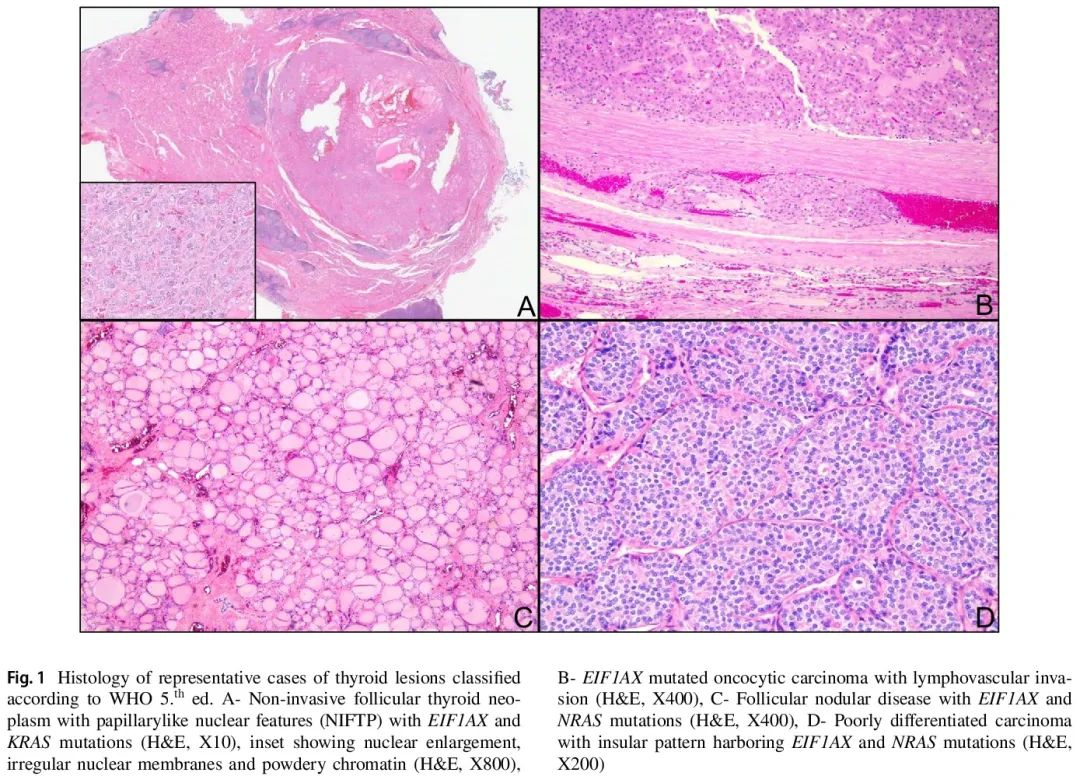
图1
在诊断为 TBSRTC III 或 IV 类且 EIF1AX 突变的 FNA 细胞学样本中,YNHH 队列中的总体 ROM 为 18%(4/22)。8 例孤立性 EIF1AX 突变阳性:4 例(50%)为 FND,3 例(38%)为 FA 或 OA,1 例(12%)为 OCA,ROM 为 1/8(12%)。12 例同时存在 EIF1AX 突变和 1 个其他分子改变,其中 5 例(42%)为 FND,4 例(33%)为 FA 或 OA,2 例(17%)为 NIFTP,1 例(8%)为 PDTC,产生 17% 的 NIFTP 风险和 8% 的 ROM。2 例同时存在 EIF1AX 突变和 2 个其他分子改变,均为 FTC,包括 1 例高级别 FTC,ROM 为 100%(表 2 和 3)。在同时存在 EIF1AX 突变和至少1个其他分子改变的病例中,ROM 为 21%。EIF1AX 突变包括剪接位点突变,发生率为77%(17/22),以及错义突变,发生率为 23%(5/22)。所有 8 例孤立性 EIF1AX 突变均为剪接位点类型,ROM 为 12%。所有 EIF1AX错义突变的病例都同时存在其他分子改变,包括拷贝数变异(CNV)见于具有嗜酸细胞改变的 FND,TSHR 见于 FND 和 OA, NRAS 见于 PDTC、TERT 和 TP53 见于高级别 FTC。
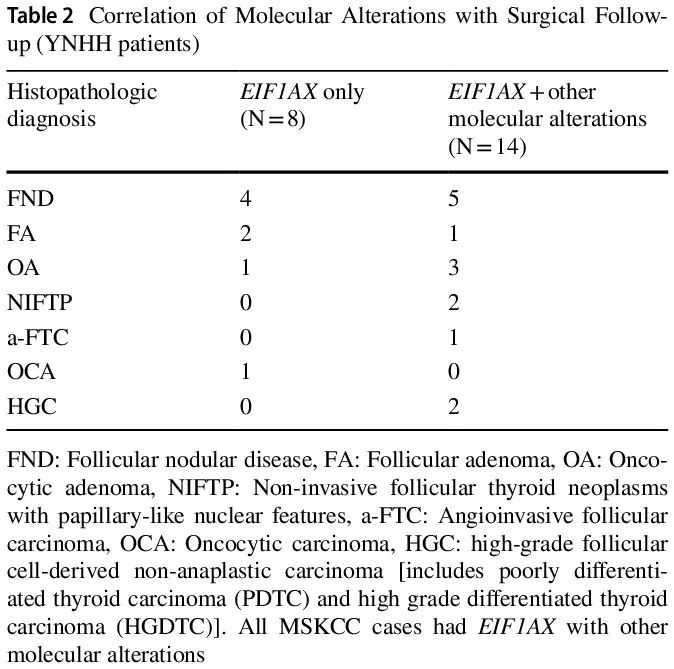
表2
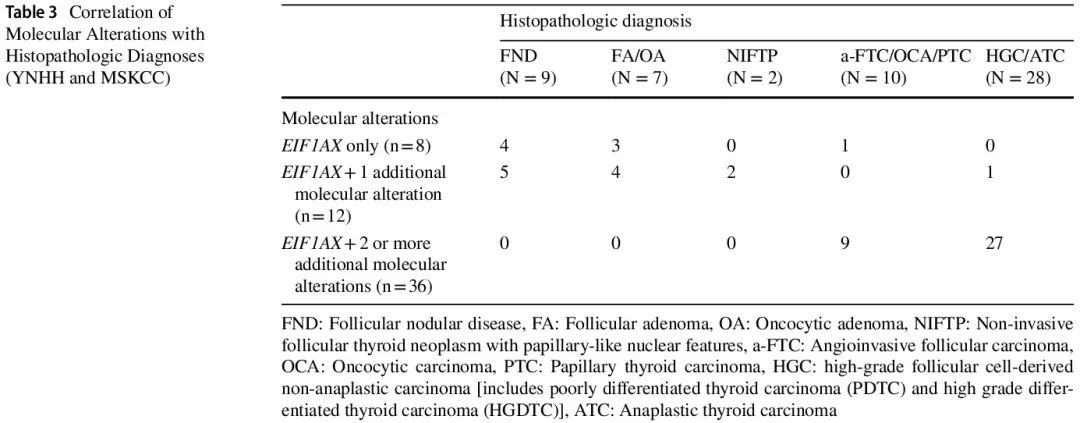
表3
在 16 例良性结节(FND 或腺瘤)中,7 例(44%)具有孤立性 EIF1AX 突变,9 例(56%)具有 1 个额外的分子改变(表 2),包括 CNV、GE、NRAS、HRAS、TSHR、TERT 启动子和 TP53 突变。除 2 例外,其他所有 FND 病例均为 EIF1AX剪接位点突变(表 4)。在 NIFTP 病例(n=2)中,EIF1AX 突变和 RAS 突变各有 1 例检出。有 4 例恶性病例,其中 2 例除 EIF1AX 突变外还有 2 个其他分子改变:1 例广泛浸润性高级别 FTC,同时存在 TERT 启动子、TP53 和 EIF1AX错义突变,以及 1 例具有广泛血管浸润的包膜 FTC,同时存在 TERT 启动子、HRAS 和 EIF1AX 剪接突变。其余 2 例恶性肿瘤分别为 1 例携带 NRAS 和 EIF1AX 错义突变的 PDTC 和 1 例携带孤立性 EIF1AX 剪接突变的 OCA。
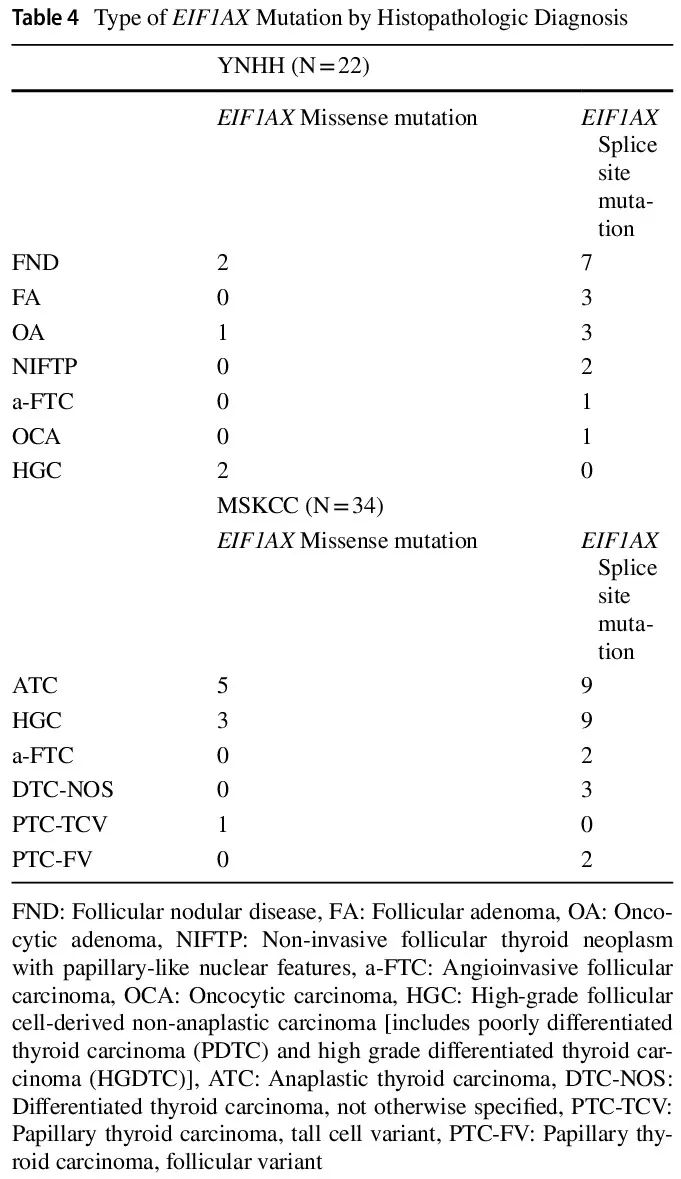
表4
MSKCC患者
MSKCC 队列包括 34 例显示 EIF1AX 突变的甲状腺肿瘤患者 [17 例(50%)女性,17 例(50%)男性,中位年龄 67 岁(范围 43-85)岁]。使用 MSK-IMPACT 对 21 例来自原发肿瘤部位的肿瘤和 13 例局部复发/区域复发/远处转移样本进行了检测。所有肿瘤均为恶性,组织病理学亚型为 ATC 14 例,HGC 12 例,A-FTC 2 例,分化型甲状腺癌(DTC)6 例(分化型甲状腺癌-非特指型:DTC-NOS,n=3;高细胞亚型甲状腺乳头状癌:PTC-TCV,n=1;滤泡亚型甲状腺乳头状癌:PTC-FV,n=2)。所有 3 例归类为 DTC-NOS 的病例活检样本均显示滤泡模式远处转移(骨、肾、肝),没有高级别特征。活检样本的性质阻碍了明确的分类。所有 MSKCC 病例均携带 EIF1AX 突变合并其他分子改变,包括 NRAS(n = 21)、HRAS(n=4)、KRAS(n=2)、TERT 启动子(n=25)和 TP53(n=13)突变。其他分子改变包括 ATM、AXIN2、BBC3、BRAF、BREBBP、CUL1-EZH2、CDKN2A、CDKN2C、DAXX、GNAS、MLL1、MLL2、NF1、PAK7、PBRM1、PIK3CA、PTPRT、RAC1、SMAD2、TET2、TSHR、DDR2、PRKAR1A、RAD21、RBM10、SDHA、SDHB、TP53BP1、JAK2、NEGR1、SF3B1、PTCH1、TGFBR1、KLF4、TGFBR2、ZFHX3、NOTCH1 重排、CCNE1 扩增、PIK3CD 缺失、CD79B 扩增和 FANCC 缺失。EIF1AX 突变包括 26 例剪接位点突变和 8 例错义突变(表 4)。TERT启动子突变发生于 64%(9/14)的 ATC、83%(10/12)的 HGC、100%(2/2)的 A-FTC 和 67%(4/6)的 DTC。TP53 突变发生于 79%(11/14)的 ATC 、0%(0/12)的 HGC、50%(1/2)的 A-FTC 和 17%(1/6)的 DTC。所有 34 例病例均除 EIF1AX 突变外,至少还有 2 个其他分子改变,包括 29 例(85%)ATC 和 22 例(85%)HGC 存在 TERT 启动子和/或 TP53 突变。RAS 突变见于 27/34(79%)的病例(表 3)。
讨 论
本研究证实了以前的报道,即 EIF1AX 突变在良性和恶性甲状腺结节中均存在。最初报道,其ROM约为20%。然而,随后的研究揭示了不同的 ROM 估计,具体取决于 EIF1AX突变的类型和是否存在其他分子改变。例如,在细胞学不确定和孤立性 EIF1AX 突变的病例中,ROM 范围为 13% 至 47.6%,在 EIF1AX突变与其他驱动突变共存的病例中,ROM/NIFTP 较高,范围在 70% 至 80% 之间,在 EIF1AX 剪接位点突变和一个额外分子改变的情况下达到 100%。提示额外的分子改变的存在可能代表进入恶性进展的一步。
大多数具有孤立性 EIF1AX 突变的肿瘤是高分化癌或 NIFTP,但 EIF1AX 和 RAS 共突变与较大的肿瘤、侵袭性行为、晚期疾病相关,并预测生存期较短。此外,TERT 启动子或 TP53 突变伴 EIF1AX 突变导致 100% 的ROM,更具侵袭性恶性肿瘤(如 FTC 和 OCA)的风险更高,但主要与 PDTC 和 ATC 相关。PDTC 和 ATC 的特征是具有多个分子改变;尽管 BRAF V600E 和 RAS 突变是主要驱动因素,但据报道 PDTC 和 ATC 也富集了 EIF1AX 突变,这通常与 TERT 启动子、TP53 或编码 PI3K/AKT/mTOR 通路效应因子或染色质修饰因子的基因突变有关,这些是肿瘤进展的主要驱动因素。在一系列同时存在高分化 PTC 和/或结节性增生成分的 PDTC 和 ATC 中,一例 PDTC 病例的 PDTC 成分存在 EIF1AX和 RAS 突变,高分化 PTC 成分仅存在 RAS突变,结节性增生成分未检测到分子改变,提示去分化可能是由多个分子事件的积累驱动的。
我们的结果与文献一致。在我们三级中心的一般人群中,总体 ROM 为 18%,当存在多种分子改变时,这种风险增加,TP53 和/或 TERT 突变与侵袭性表型相关。为了反映日常实践,我们将 YNHH 研究队列限制在 TBSRTC III 类和 IV 类甲状腺细胞学、术前分子检测检出 EIF1AX 突变的病例。然而,要注意,仅为了评估 EIF1AX 突变与恶性肿瘤的关系而纳入细胞学不确定的样本是存在局限性的,因为 TBSRTC III 类和 IV 类通常 RAS 突变发生率较高,在良性、低危和恶性肿瘤中都遇到 RAS 突变,并且这些类别的 ROM 分别仅为 22% 和 30%。因此,我们纳入了一组来自癌症转诊中心的已知恶性肿瘤患者。所有 MSKCC 恶性病例除 EIF1AX 突变外,还携带至少 2 个其他分子改变,并且与侵袭性临床病理特征相关,支持多个分子改变与 EIF1AX 突变同时发生与侵袭性表型相关,导致不利的临床病程。
WHO 第 5 版分类将甲状腺滤泡细胞的多灶性良性增生导致具有可变结构的多个克隆和非克隆结节定义为 FND,不鼓励使用先前的腺瘤样增生、甲状腺肿、弥漫性甲状腺肿或胶体结节的名称,提示克隆结节代表真正的肿瘤。克隆性结节中识别的分子改变包括家族性甲状腺肿中 RGS12、GRPEL1、CLIC6 和 WSF1 基因变异,以及 SPOP、EZH1 和 ZNF148 基因体细胞变异。因此,根据新的分类,FND 属于良性肿瘤。在我们研究的 NIFTP 和腺瘤以及 FND 病例中都存在 EIF1AX 突变可能代表克隆结节的分子改变,而许多研究中报道的携带 EIF1AX 突变的“增生性”结节可能是克隆结节,应命名为 FND。在这种情况下,构成 FND 的结节中孤立性 EIF1AX 突变可能代表甲状腺肿瘤多步骤过程中的早期分子事件。当孤立发生时,它不足以导致恶性转化,需要其他突变才能进展为明显的恶性肿瘤。从良性肿瘤到恶性肿瘤,分子改变逐渐积累,FA 可能是 FTC 的前体。其他研究和本研究证实,良性肿瘤中 EIF1AX 是唯一的分子改变,这支持这一理论。本研究中有 1 例 OCA 病例具有孤立性 EIF1AX 突变;在该病例中,EIF1AX 突变可能是作为晚期事件发生的,或者可能是驱动突变,加上额外的未发现的分子改变,可能是导致恶性过程的原因。
与 TCGA 和其他一些研究的结果类似,本研究表明,孤立性 EIF1AX 突变最有可能在滤泡和嗜酸细胞型肿瘤(如 FA、OA 和 OCA)中遇到。据报道,EIF1AX 突变的肿瘤,伴或不伴 RAS 突变,是具有滤泡表型的 PTC,通常有包膜,以及 FA、OA、FTC 和 OCA。与其他研究相反,本研究中没有具有孤立性 EIF1AX 突变的 PTC。
EIF1AX 突变似乎根据肿瘤类型聚集到基因的不同区域。在甲状腺癌中,所有突变都是单核苷酸替换,聚集在基因的两个特定区域:要么在外显子 2 的 N 端结构域附近的密码子 6-15 中,作为错义突变,如葡萄膜黑色素瘤中所见,要么更常见的是,在 EIF1AX 的 C 端结构域外显子 5 和 6 之间的热点剪接受体位点的密码子 113 中(X113_splice突变),导致 12 个氨基酸缺失。EIF1AX 剪接突变是甲状腺癌特有的,与外显子 2 突变相比,具有更高的 ROM,但这一发现尚未得到普遍证实,在恶性和良性甲状腺病变中都报道了这两种突变类型。我们发现了类似的结果:EIF1AX 剪接位点和错义突变均见于癌症、腺瘤和 FND,EIF1AX 剪接位点突变与 12% 的 ROM 相关,而所有错义突变肿瘤除 EIF1AX 突变外,还存在至少一个其他分子改变。目前尚不清楚 EIF1AX 错义突变是否是这些病例的驱动基因,因为许多其他分子改变与甲状腺发病机制有关。在本研究中没有孤立性 EIF1AX错义突变病例,限制了对其临床意义的评估。
本研究由于回顾性性质和两个机构的选择偏倚,存在许多固有的缺点。使用多个分子检测平台是本研究的一个缺点。虽然 NGS panel 检测相对灵敏,但不同平台之间的灵敏度差异可能会改变 EIF1AX和其他分子改变的检出,如果使用较低灵敏度的平台,可能会错过这些改变。此外,我们记录了一般人群中 FND 和各种甲状腺病变中存在 EIF1AX 突变,但在每个类别中的真实发生率难以评估。只有一部分细胞学诊断不明确的患者,可能是那些具有令人担忧的临床和影像学特征的患者,接受了手术。此外,没有对 Bethesda II 类进行分子研究。因此,FND 中 EIF1AX 突变的发生率仍然未知,但可能被低估。同样,EIF1AX 突变在恶性甲状腺肿瘤中的评估和分布在很大程度上是未知的,因为 YNHH 患者中不包括 V 类或 VI 类。为了回顾 EIF1AX 突变侵袭性癌症的组织学和分子学发现,我们纳入了一组来自癌症转诊中心的已知甲状腺癌患者。虽然纳入晚期疾病患者反映了对侵袭性恶性肿瘤的选择偏倚,这是转诊实践特征,但揭示了与细胞学不确定的 EIF1AX 突变结节相比,EIF1AX 突变癌症的分子改变分布不同。此外,该组肿瘤的病理和分子特征证实了一般人群的发现。需要强调的是,本研究未探索 EIF1AX 在甲状腺中的发生率或其在不同甲状腺病变中的分布,而是表明了 EIF1AX 突变存在于甲状腺癌以及良性结节(包括 FND),反映了日常实践中遇到的归类为 Bethesda III 类或 IV 类的甲状腺 FNA 标本中对 EIF1AX 突变的解读。
总之,EIF1AX 突变存在于良性和恶性甲状腺结节。术前在 Bethesda III 类和 IV 类中检测到的孤立性 EIF1AX 突变赋予低 ROM,而其他分子改变的积累与 ROM 增加和侵袭性甲状腺癌有关。
参考文献:
Abi-Raad R, Xu B, Gilani S, Ghossein RA, Prasad ML. EIF1AX mutation in thyroid nodules: a histopathologic analysis of 56 cases in the context of institutional practices. Virchows Arch. 2024 Sep 3. doi: 10.1007/s00428-024-03914-5. Epub ahead of print. PMID: 39225726.



