【BMT】综述:NPM1突变AML的MRD监测手段、意义及其对移植指征的影响
时间:2024-11-19 12:01:05 热度:37.1℃ 作者:网络
NPM1突变AML
NPM1 突变急性髓系白血病(AML)约占所有 AML 病例的 30%,根据欧洲白血病网(ELN)分层主要为低危或中危,然而有部分患者对初始强化疗反应不佳,或最终复发。NPM1 突变很常见,通常在早期复发时保持稳定,且是 AML 特异性的,这些特征使其成为监测MRD的理想靶点。在治疗过程中通过分子学分析进行 MRD 监测,可以告知首次完全缓解期异基因造血干细胞移植(alloHCT)的作用,包括在伴有高危共突变(尤其是 FLT3-ITD)的 NPM1 突变 AML 患者中,以及未达到既定分子学里程碑的低危患者中。诱导治疗后仍为MRD阳性的患者可能从alloHCT中获益,但由于移植前 MRD 阳性与不良预后相关,alloHCT 的获益可能并不完全。
《Bone Marrow Transplantation》近日发表综述,评估了 MRD 监测在 NPM1 突变 AML 中的预后作用、监测方法和时间点,及其作为预测性生物标志物在优化风险分层和为治疗决策提供信息的作用,包括移植前 MRD 阳性对移植后结局的影响,以及移植相关因素(如预处理强度)如何影响该风险。

NPM1基因
NPM1基因编码一种具有穿梭和伴侣蛋白功能的核仁磷蛋白,参与核糖体生物发生、DNA修复、组蛋白伴侣蛋白和rRNA甲基化。NPM1基因的突变主要影响外显子12,并且均为杂合,因为完全缺失野生型基因会导致胚胎死亡。NPM1突变导致蛋白质从细胞核转移到细胞质中,这种异常的细胞质定位使得NPM1突变体在二代测序广泛应用之前可通过免疫组化法发现。所有NPM1突变都会导致细胞质白血病分子的输出增加,这些分子在白血病发生中起着关键作用。
研究表明,NPM1 突变是在先前存在的克隆性造血之后作为继发性病变发展起来。缓解时克隆性造血增殖的持续存在可能是患者患继发性血液肿瘤的一个诱发因素,因为多达 10%的 NPM1 突变AML复发患者可能会失去 NPM1 突变克隆。NPM1 突变在AML中经常与其他突变共存,这种组合可能会影响疾病行为和风险分类(图 1)。
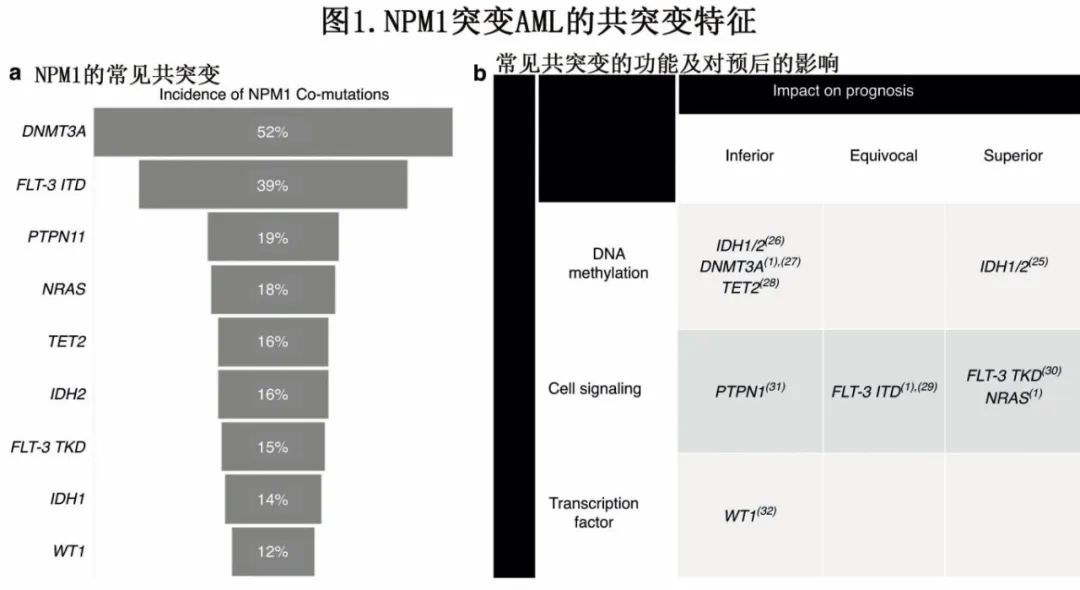
分子MRD监测
在过去二十年中,技术进步使得监测白血病的残留病变变得更加灵敏。MRD监测有助于跟踪治疗反应、在alloHCT前监测白血病负荷,以及筛查白血病克隆的重新出现以预防血液学复发。对于这些不同的目的,MRD评估的方法选择和最佳时间点尚未普遍标准化;然而,目前的数据表明MRD阳性与不良预后之间存在强烈关联。因此,MRD监测视为一种手段,以改进达到形态学缓解的患者中复发风险的预测,并且在整个治疗过程中进行MRD监测可以比初始的基因预后分层更准确地预测复发风险。尽管MRD在复发预测方面有良好的结果,但MRD并不是一个完美的标志物,因为仍有相当一部分MRD阴性患者会发生复发;也有部分患者在治疗后很长时间内可能表达低水平的分子MRD,但不会复发。
评估MRD最可靠的方法是实时定量 PCR(qPCR)、数字 PCR(dPCR)和多参数流式细胞术(MFC)。二代测序(NGS)作为一种优化预后的技术以及与 MFC 联合使用的工具正在兴起,但目前尚未推荐作为独立的标准实践。NPM1 突变很常见,在复发时稳定,并且呈AML特异性,仅发生在明显的血液恶性肿瘤中,这些特征使其成为分子 MRD 监测的理想靶点。对于 NPM1 突变 AML 患者进行 MRD 监测,目前建议通过 qPCR 或 dPCR。
PCR
通过 PCR 评估MRD包括使用荧光探针的经典实时 qPCR 及dPCR。qPCR 的灵敏度为10-4–10-6,推荐用于 MRD 监测。对于 NPM1 的分子 MRD 分析,使用 RNA/cDNA(逆转录酶 qPCR [RT-qPCR])而非基因组 DNA 扩增,因为由于每个细胞中 mRNA 相对于 DNA 的丰度更高,可能产生更高的灵敏度,从而能够为分析准备更具代表性的样本。骨髓(BM)样本在分子 MRD 检测方面往往比外周血(PB)具有更高的灵敏度,在治疗期间的各个时间点显示差异为 0.2-1.5 log10(p<0.001),且NPM1突变转录水平在骨髓中始终高于外周血。但数据支持在缓解期间同时使用骨髓和外周血来提供预后信息,并指出如果在随访期间使用外周血进行 MRD 监测,应更频繁地进行评估。
已报道了超过 55 种不同的 NPM1 移码插入突变,包括外显子 12,其中 A 型、B 型和 D 型最为常见,共同构成95%的变异。通过 qPCR 进行MRD检测要求在诊断时确定每种突变类型,并且要有可用的、独立验证的突变特异性引物和荧光探针。qPCR 检测仅广泛适用于三种最常见的突变,意味着部分低发病率突变可能会被遗漏。
虽然dPCR可进行检测点突变和绝对定量,且无需标准曲线,但它需要为每个待评估的突变开发特定的检测方法,从而使其对资源的消耗更大。重要的是,所有 PCR 方法的主要局限性在于其无法检测非 NPM1 复发。
NGS
DNA 也可用于 NGS-MRD 评估,使用多基因panel筛查突变,有利于 NPM1突变AML的 MRD 监测,因为约 10%的患者在复发丢失NPM1 突变。该情况在晚期复发期间更为常见,此时原始白血病克隆可能已经消亡,但持续的克隆性造血易导致第二次de novo或治疗相关AML。在这种情况下,NGS 具有检测和追踪共突变的优势。此外,NGS通过直接序列读段来测量突变拷贝数,可避免遗漏不常见突变类型。
NGS的灵敏度取决于检测的测序深度,如果要适用于MRD监测,其检测限应达到 10-3水平。2018 年Patkar等人验证了一种超灵敏技术,能够检测到频率为 0.001%的 NPM1 突变。该研究与Dillon等人的报告表明,血液中检测到 NPM1 变异体(等位基因频率为 0.01%或更高),与检测结果为阴性的患者相比复发增加和生存降低。
与qPCR相比,成本仍是NGS的劣势之一,并且缺乏大型多中心试验中将其用于MRD监测。众多研究表明,已开发出用于 NPM1 突变AML中 MRD 监测的 NGS 检测方法,为更大规模的验证试验奠定了基础,以使 NGS 能够进入常规临床应用,从而对初始 NPM1 克隆之外的疾病复发进行全面监测。
临床上评估MRD的时间点
在 NPM1 突变AML中,分子MRD最好在化疗 2 个周期后通过外周血进行评估,在巩固治疗结束时通过骨髓进行评估,并且在巩固治疗结束后总共 24 个月内每 3 个月通过骨髓评估;或在 24 个月的随访期间,每 4-6 周通过外周血测量MRD。这些与ELN微小残留病工作小组的建议一致。在这些时间点未能达到治疗里程碑表明复发风险高,并可能影响治疗决策。
诱导后的MRD评估
诱导化疗后或达到完全缓解后的时间点评估MRD,已在多项研究中证实与NPM1突变AML的临床和预后相关,诱导后MRD阳性表明患者复发风险高,总生存期短。Hubmann等通过qPCR评估了158例强治疗的NPM1突变AML患者治疗过程中的BM MRD,发现诱导后NPM1突变比值为1%与预测复发的最高灵敏度相关。在诱导后MRD水平高于该阈值的ELN低危患者中,MRD水平高于该阈值的患者2年累积复发发生率为76%,而低于该阈值的患者为6%。Krönke等在一项纳入245例强化治疗患者的研究中发现,两次诱导治疗后NPM1突变qPCR阴性可识别低复发风险(4年累计发病率为6.5%)的患者;但研究中的治疗包括伊达柔比星(12mg /m2,第1、3和5天)、阿糖胞苷(100mg /m2,第1-7天)和依托泊苷(100mg /m2,第1-3天)两个周期,这在部分国家并不常见。同样,Ivey等发现,在346例NPM1突变AML患者中,与MRD阴性的患者相比,两个周期强化疗后通过qPCR检测到MRD的患者复发风险更高(HR=4.8, p<0.001)。这些数据促使适合移植患者在两个周期强化疗后考虑HCT以治疗持续性分子MRD阳性。
由于不同研究之间的 qPCR 检测、预处理和治疗方法有所不同,MRD 的对数减少量而非绝对值可能是实现研究之间一定可比性的最可靠参数。Balsat 等报告了 152 例接受强化治疗的 NPM1突变AML患者,患者在首次缓解时接受诱导治疗后的分子 MRD 监测。除3例患者(8%)外,其余患者均在首次诱导疗程后实现缓解。对于未实现缓解的三例患者,在第二次诱导疗程后评估 MRD 情况。研究人员发现,在这个时间点实现外周血中 NPM1突变转录本水平≥4-log减少是预测后续复发和总体生存的最有预后意义的标志物,无论 MRD 水平是否仍可检测到。其他则确定从诊断时起转录本水平减少 3-log是识别复发高风险患者的最佳阈值。
治疗结束时及随访期间的MRD评估
ELN MRD工作组认为巩固治疗结束时是临床有意义的时间点,此期间MRD结果在NPM1突变AML中具有临床可操作性。qPCR结果显示,此时MRD持续性≥2%的患者应考虑进行alloHCT巩固,MRD低于该水平的患者为低水平分子MRD(low-level molecular MRD,MRD-LL),以前称为低拷贝数分子持久性(molecular persistence with low copy numbers,MP-LCN)(表1)。指南指出,“在治疗结束时检测的MRD-LL与NPM1突变AML患者的复发风险极低相关”。
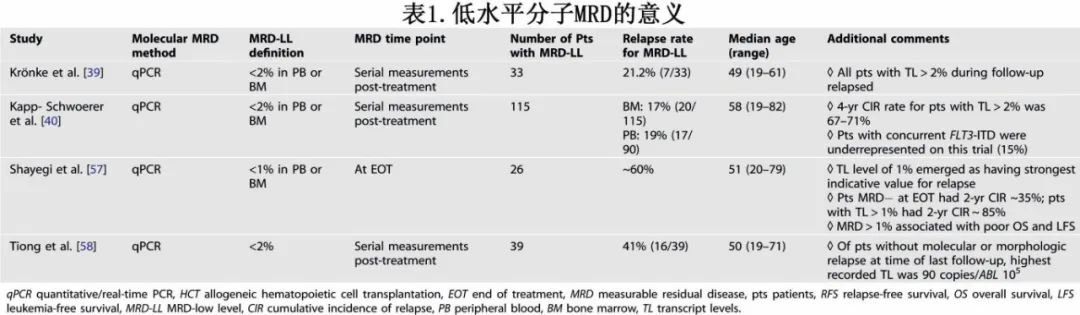
Krönke等首次报道了该现象,他们在研究中检测了接受强化治疗的年轻成年患者的连续骨髓和外周血样本中的 NPM1突变转录本水平。治疗后69例患者有至少一个骨髓样本通过定量聚合酶链反应检测到MRD,其中有36例患者的至少一个MRD数值>200 NPM1mut/ABL 104(相当于 2%),所有这些患者均复发;在另外 33 例MRD水平始终<2%的患者中,有 7 例复发;在 26例仍处于完全缓解期的患者中,MRD的峰值水平为 144 NPM1mut/104 ABL。在随访期间,骨髓中的 NPM1突变转录本水平高于外周血(中位数为 8.73 倍),15.6%的配对样本存在差异,表明在骨髓中检测到MRD但在外周血中未检测到。Kapp-Schwoerer等报道了 115例接受强化治疗的患者,治疗结束和随访期间的 NPM1突变qPCR水平<2%。在这个亚组中,超过 80%的患者在 4 年时保持无复发,验证了该阈值的预后价值。值得注意的是,同时患有 FLT3-ITD 的患者所占比例较低(15%),或许降低了研究中的复发率。
Shayegi等在大规模前瞻性临床试验中完成治疗的患者队列中,主要基于骨髓样本回顾性地确定了一个阈值,即 100 NPM1mut/104 ABL(相当于 1%),最能表明即将复发。这与Krönke等确定的数值非常接近。重要的是,尽管 1%的阈值对复发具有最强的指示价值,但检测到MRD水平低于该阈值(即<1%)的患者亚群体的复发率仍高于无MRD的患者。最近,Tiong等报告了 100例在强化治疗结束时仍为MRD阳性的患者,其中包括 39 例随后MRD持续<2%;该组患者2 年无事件生存率为 58%,表明即使低于该阈值,复发率也显著较高。在末次随访时仍无分子学或形态学复发的患者中,记录的最高 NPM1mut MRD水平仅为 90 拷贝/ABL 105。
总之,治疗结束时和随访期间 NPM1突变MRD的低水平持续存在(通过 qPCR 检测到 MRD,但低于 2%)并不一定意味着存在有复发风险的残留疾病,甚至可能是假阳性结果。然而这类患者的病程各不相同,包括相当一部分会最终复发。巩固治疗结束后应密切监测 MRD,建议持续 24 个月,以识别高复发风险的患者。
哪些患者需要移植?MRD评估在风险分层和治疗决策中的临床应用
AML的风险分层和管理在很大程度上取决于疾病的基线细胞遗传学和分子学特征及其对初始治疗的反应(包括MRD的病程)。在 2022 年更新的ELN关于遗传风险分类的建议中,NPM1 突变AML主要归为低危或中危,具有高危细胞遗传学的病例不到5%。
目前来说,伴有 NPM1 突变和 FLT3-ITD 的AML都视为中危(无论 FLT3-ITD 等位基因比例如何)。如果不良风险、骨髓增生异常相关基因突变(如 ASXL1、BCOR 和 EZH2)与低危NPM1 突变 AML 共存,目前不会影响风险分类,不过仍有待研究。目前的数据参差不齐,部分研究表明,伴有或不伴有其他骨髓增生异常相关基因突变的 NPM1 突变 AML 患者预后无差异,而其他研究则认为伴有此类突变的 NPM1 突变 AML 患者预后较差。
低危患者的MRD与缓解后巩固治疗方案的选择
对于低危NPM1 突变AML患者,标准治疗包括强化诱导和巩固化疗。根据共识建议,并基于上述证据,对于持续存在分子MRD或巩固化疗结束时转录水平未实现 3–4 log降低的患者,无论基线风险分类如何,都应考虑alloHCT。例外情况可能包括治疗后 MRD-LL 的患者,该患者亚群中进行alloHCT的其他相对指征包括如前2个强化治疗周期后 MRD 持续存在。最后,无论使用何种 MRD 检测技术,MRD 从阴性转为阳性,或者在同一组织样本的任意两个样本之间转录水平增加≥1 log,均构成 MRD 复发,是适合移植患者进行alloHCT的指征(图2)。外周血或骨髓中 MRD 从阴性转为阳性应通过同一组织来源的连续第二次样本迅速确认,然后再进行治疗。
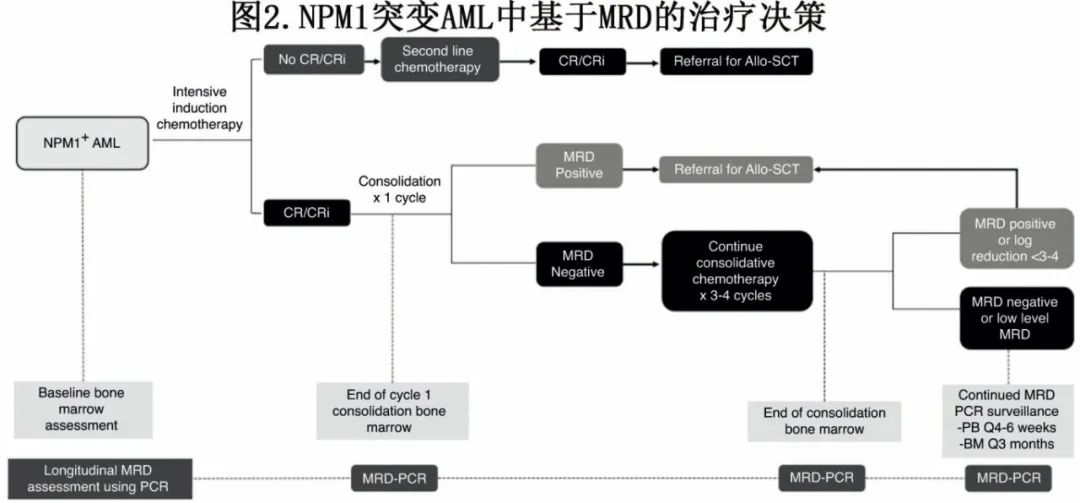
中危患者的MRD与缓解后巩固治疗方案的选择
由于担心复发,许多中心建议同时携带 NPM1 突变和 FLT3-ITD 的AML患者进行alloHCT,而早期监测MRD可能有助于进一步完善该组患者的移植指征。Othman等回顾了两项针对强化治疗的AML患者的大型研究的前瞻性数据,其中包括 286 例同时携带NPM1 突变和 FLT3-ITD 的患者,患者在第二次诱导后实现缓解,并有外周血MRD检测结果。仅第二次诱导后MRD阳性(qPCR)患者可获益于首次完全缓解期(CR1)alloHCT;即使考虑 FLT3-ITD 等位基因比例高的患者或 DNMT3A 突变的患者,该时间点MRD阴性的患者alloHCT也没有生存获益。鉴于alloHCT的应用并非随机,其决策可能受到临床医生判断、供者可用性或其他未检测的因素的影响,这些因素可能会混淆结果。还需要对MRD阴性患者进行随机分组,比较移植与非移植治疗策略,以充分阐明alloHCT在同时携带 NPM1 突变和 FLT3-ITD 的AML中的真正生存获益。
Lussana等和Balsat等都得出类似结论,即alloHCT对NPM1突变AML的获益仅限于在治疗期间未能达到MRD里程碑的患者(两研究中分别定义MRD里程碑为在两个周期巩固治疗后qPCR水平<0.01%和诱导治疗后PB-MRD减少<4-log);但两研究均未提及该结果是否适用于同时携带 FLT3-ITD 的患者亚群。最后,Othman等以及Lussana等均观察到,alloHCT对 MRD 阳性患者的获益只是部分性的,因为对于经过 2-3 个周期强化疗后仍可检测到 MRD 的患者,移植后复发率更高。
围移植期MRD对结局的影响
移植前MRD
研究表明,alloHCT时检测到分子MRD是 NPM1 突变AML患者复发的强有力的预测因素。
(表 2)。
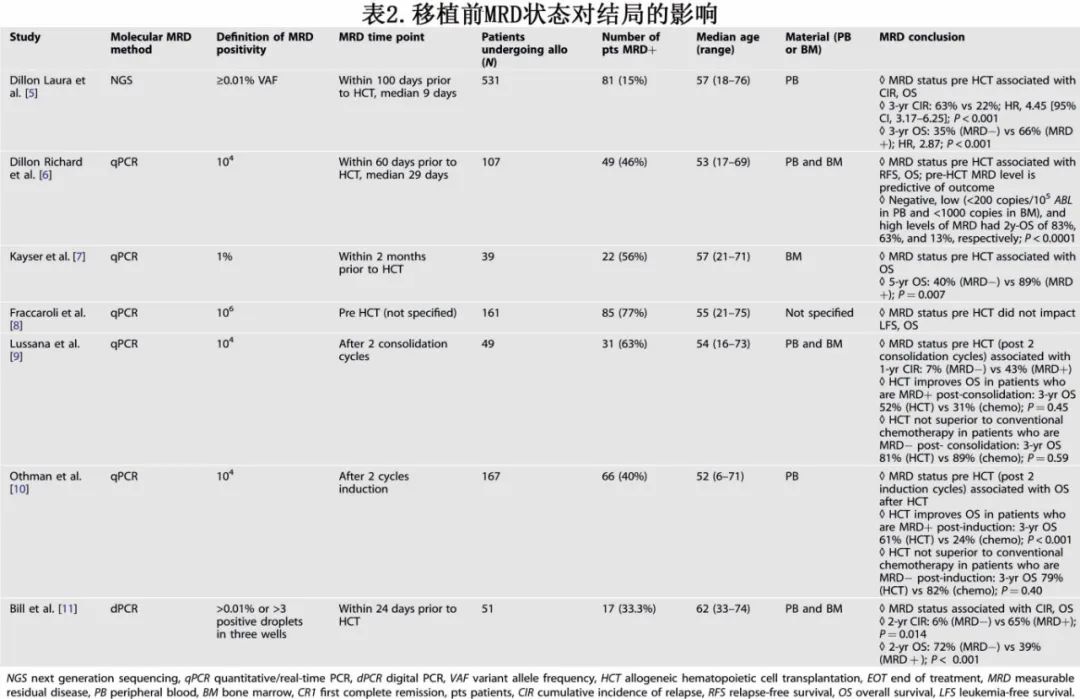
在最大规模的此类研究中,Pre-MEASURE 研究小组在alloHCT前对 531 例处于CR1的患者的血浆样本进行深度 DNA 测序,通过NGS评估,alloHCT前 15.3%的患者检测到MRD。与MRD阴性相比,alloHCT时检测到患者血液样本中残留NPM1 突变与更高的 3 年累积复发率(63% vs 22%,p<0.001)和更差的总生存率(35% vs 66%,p<0.001)相关。此外还对携带 FLT3-ITD 和/或 NPM1 突变的AML患者中通过流式细胞术分析MRD(822例患者中774例)。通过流式细胞术检测到MRD阳性率仅为 16.7%(132通过NGS为 MRD 阳性患者中22例),有趣的是,其未就总生存率提供额外的预后数据。
其他研究证实,移植前分子MRD对 NPM1 突变AML的预后影响显著。Kayser等报告了 39 例 NPM1 突变 AML 患者在缓解期接受alloHCT,并对移植前的 NPM1 qPCR 水平进行分析。有和无 MRD 的患者 5 年总生存率分别为 40%和 89%(p=0.007)。事实上,移植前 NPM1 MRD>1%的患者预后与移植时患有难治性疾病的患者相似。同样,一项针对 107 例 NPM1 突变AML 患者的研究报告称,在alloHCT时可检测到 qPCR MRD的患者和未检测到 MRD的患者 2 年总生存率分别为 45%和 83%。
与之相反,一项回顾性德国研究报告称,对于处于形态学缓解期的 NPM1 突变AML患者,通过qPCR评估移植前MRD阳性对移植后结局没有影响。与 Pre-MEASURE 研究相比,在alloHCT时检测到 MRD 的患者比例要高得多(111 例患者中有 85 例患者在治疗后仍有 NPM1 突变持续存在或出现分子学复发)。移植时MRD 阳性和阴性患者之间没有显著的生存差异。目前尚不清楚是什么导致该研究与其他研究的结果差异。这些研究之间显著的差异包括德国队列中在alloHCT时MRD 的高发率、该人群中频繁使用序贯预处理方案以及所使用的 MRD 评估方法。Pre-MEASURE 研究使用阈值为 0.01%等位基因分数(10-4)的NGS,而德国研究使用 qPCR 方案监测 MRD,灵敏度达到 10-6。
对于移植时存在分子残留病的患者,关于强化预处理以消除复发风险的能力,相关研究结果各不相同。在 Pre-MEASURE 研究中,预处理强度改变了MRD对复发风险的影响,因为接受减低强度或非清髓性方案的MRD患者复发风险最高(3年时达57%),而接受清髓性预处理的MRD患者复发风险较低(35%,p<0.001)。相比之下,Othman等和Dillon等报告称,在alloHCT时检测到MRD的患者中,预处理强度并未降低复发风险,并且后者发现序贯预处理无额外获益。
对于在移植前对MRD阳性患者进行额外疗程的强化疗,目前证据有限。如果适合,MRD阳性患者应考虑接受清髓性预处理方案或缩短移植后的免疫抑制疗程。基于维奈克拉的治疗方法在根除分子学失败的 NPM1突变AML患者中的MRD方面显示出希望,无论是作为移植的桥接还是作为根治性治疗(definitive therapy)。在Jimenez-Chillon的一项研究中,接受维奈克拉联合治疗的患者中有84%实现≥1-log的MRD减少,71%的患者转为MRD阴性。同样,Tiong等回顾性证明,维奈克拉联合低剂量阿糖腺苷或阿扎胞苷可有效诱导检测到MRD的患者(包括分子学持续和分子学复发/进展)获得持久分子学完全缓解。Tiong等随后的一项前瞻性研究证实了该方案在首次分子学或寡细胞复发中的耐受性和有效性。上述发现突显了基于维奈克拉的疗法在消除MRD方面的潜力,尤其是不适合强化化疗的患者。然而,患者是否应推迟移植以追求更深的缓解和MRD阴性,该问题仍未解决。
移植后MRD
alloHCT后检测到 NPM1突变 MRD也与不良预后相关。周等报告称,通过在第 28 天进行高灵敏度 NGS 检测到的移植后 NPM1突变与至复发时间缩短和无复发生存率降低独立相关。Malmberg等也表明,通过移植后 3 个月进行深度测序检测到的 NPM1突变 MRD 阳性,是无复发生存率和总体生存率降低的强独立预测因素。这些研究与之前的发现一致,表明移植后 MRD 是早期检测即将发生的复发的有用工具,并且有助于确定是否需要进一步干预。
总结
NPM1 突变在AML中很常见,过去十年内的研究已经揭示了 NPM1 促进白血病发生的关键机制,从而对 NPM1 突变 AML 的生物学特性有了更好的理解。最新的指南反映了分子MRD评估在检测 NPM1 突变 AML 患者残留疾病以及识别首次缓解期复发风险最高的患者方面的价值。因此,对于接受强化疗的 NPM1 突变 AML 患者,分子 MRD 状态可能是决定alloHCT指征的最具影响力的因素。诱导治疗后和预处理化疗前的分子 MRD 状态在预测移植后复发风险方面可能同样具有影响力,而消除此类患者移植后复发风险的最佳方法仍有待研究。
参考文献
Christopher, M.R., Nawas, M.T. & Reagan, J.L. Molecular measurable residual disease monitoring and transplant indications in NPM1 mutated acute myeloid leukemia. Bone Marrow Transplant (2024). https://doi.org/10.1038/s41409-024-02465-2


