“绘”解读真报告丨肾母细胞瘤检出FBXW7基因胚系+体系共突变,警惕发病儿童的遗传风险!
时间:2024-11-22 23:00:31 热度:37.1℃ 作者:网络
近期,一位年仅4岁的男童,经病理诊断确诊为:(右侧)肾母细胞瘤,术后化疗后转移至肝部、肺部。送检组织+对照血标本至我司,检测“实体瘤201Plus+RNA1560基因检测”项目,用于治疗指导和遗传风险评估。

图1 患者病理报告
患者检出的FBXW7胚系+体系双突变,分别是什么意义呢?
通过系统的检测后,我司报告检出FBXW7两个致病性突变:p.K444Sfs*27(9号染色体的移码突变);p.R505S(10号染色体的错义突变)。
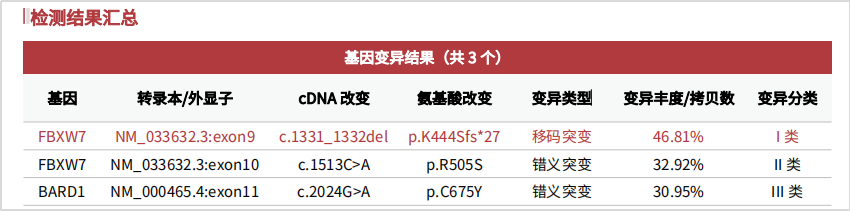
图2 患者报告检出突变
生信分析发现,患者p.R505S突变为体细胞突变(解读:编码蛋白的氨基酸第505位精氨酸R替换成丝氨酸S,为患者肿瘤组织细胞发生的特异性突变);而p.K444Sfs*27验证为胚系突变(解读:编码蛋白的氨基酸第444位赖氨酸K替换成丝氨酸S,同时发生编码移位,至第27位氨基酸停止编码;为患者全身细胞均携带的突变),该突变具备遗传风险(杂合突变,遗传给下一代的概率为50%),我司在报告的“遗传性肿瘤基因检测”部分进行标注和解释。

图3 报告遗传性肿瘤基因检测详解(部分截图)

图4 患者检出突变的IGV视图
关注用药方面,FBXW7基因突变的肾母细胞瘤,目前尚无指南推荐的高证据级别的靶向治疗药物。仅有临床前研究证实,携带 FBXW7失活突变的肿瘤细胞对AR-42、Belinostat、Entinostat 等药物敏感[1];国外也在开展针对 FBXW7突变的实体瘤的临床试验,试验药物为Temsirolimus(替西罗莫司)[NCT03297606]。
“二次打击”理论解释患者致病原因,父母有必要验证自身胚系突变!
FBXW7作为知名的抑癌基因,患者这种胚系突变+体系突变同时发生的现象,正符合“二次打击(two hit)”理论[2]。第一次“打击”是p.K444Sfs*27胚系突变,与生俱来,即携带胚系FBXW7基因,表现为所有的细胞均为FBXW7杂合突变。第二次“打击”,即体细胞发生再次突变(p.R505S),使FBXW7成为复合杂合突变,类似于纯合突变,进而发展为肿瘤(肾母细胞瘤)。
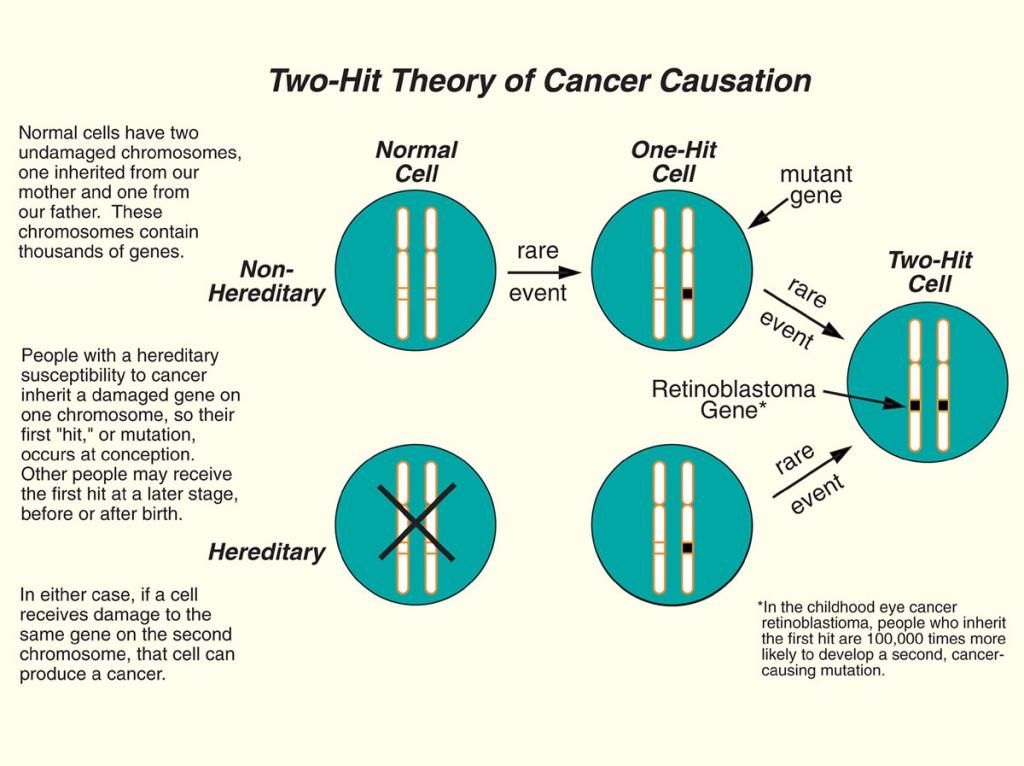
图5 引自:Fox Chase Cancer Center(费城癌症中心)Knudson's "Two-Hit" Theory of Cancer Causation
调研文献发现,肾母细胞瘤中也确有FBXW7基因突变的案例报道,就在今年10月份刚刚发表:一例年仅3岁的肾母细胞瘤患者,先是遗传了母亲的FBXW7致病突变(Pro528Glnfs*28),与本案例患者一样,也是移码后的截短突变,然后在肾母细胞瘤的肿瘤组织中又检出FBXW7体细胞无义突变(Arg278*),而母亲是健康人,他还有一位发育迟缓的姐姐。文章最后也结合案例提到,这种遗传现象在家系中广泛存在,即便是父母健康的家系,强调通过基因型-表型做相关性基因检测的重要性[3]。

图6 文献报道:FBXW7胚系变异相关肿瘤患者的临床和分子学特征
同样,这也意味着在本案例中,患者父亲或者母亲也极可能携带FBXW7 p.K444Sfs*27胚系致病性突变,非常有必要为自己做验证看是否同样携带,并进行适当的干预。因为胚系突变携带者将比未突变人群更容易罹患癌症,而且罹患癌症的时间大大提前。
肾母细胞瘤患者基因检测,有哪些需要关注的权威推荐?
我们了解下这个儿童最常见的肾脏肿瘤—肾母细胞瘤,也称作肾胚胎瘤或Wilms瘤,约75%的肾母细胞瘤发生在5岁以前,平均发病年龄仅3.5岁。
在治疗上,《儿童肾母细胞瘤诊疗专家共识》提到,目前主张手术治疗和化疗联合应用。如果可以完整切除肿瘤一般建议先手术,对于手术切除困难者,可以先化疗再手术[4]。
在基因遗传上,《中国儿童双侧肾母细胞瘤诊疗专家共识》提到,同时性双侧肾母细胞瘤(BWT),BWT患者易出现胚系变异,主要包括WT-1、TRIM28、CTR9、AMER1、TP53、CTCF等基因异常,分子变异形式多样,故推荐对BWT 患者进行胚系基因变异筛查,检测方法可采用高通量测序或靶向测序;同时也鼓励对肿瘤组织进行检测,以期发现更多的体细胞变异信息以及预后相关分子特征[5]。
对于BWT患者推荐常规进行胚系基因变异筛查,尤其要关注 WT-1 基因是否异常,推荐利用外周血采用高通量测序(如全外显子)检测可能的基因变异。(证据等级:IIIb;推荐强度:B)
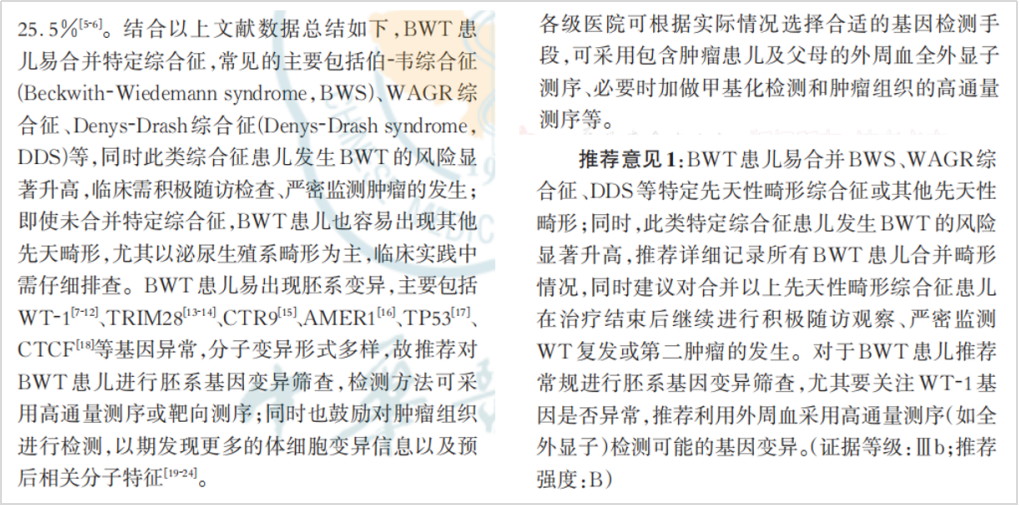
图7 摘自《中国儿童双侧肾母细胞瘤诊疗专家共识》
聚焦本案例患者检出的FBXW7胚系突变,也已被肾母细胞瘤NCCN临床实践指南推荐为检测指标,NCCN指南将WT1、CTNNB1、DROSHA、WTX(AMER-1)、DGCR8、SIX1、BCORL1、MLLT1、MYCN 和 SIX2列为最常见的胚系基因突变,其他还有:FBXW7、REST、TRIM28、NYNRIN、KDM3B、XPO5和DICER1。并强调这些基因胚系突变在肾母细胞瘤患者中为反复突变[6]。

图8 摘自肾母细胞瘤NCCN临床实践指南
此外,适当的体细胞基因检测也能为患者带来预后指导。研究表明,肾母细胞瘤属于异质性肿瘤,和多种染色体和癌基因的异常相关。约30%的肿瘤存在1q染色体的扩增,染色体1p和16q的杂合性缺失在肾母细胞瘤病例中分别占17%和11%,以及TP53基因突变等均为肾母细胞瘤患者的预后不良因素,提示患者较低的生存率和更为密切的治疗需求[7-8]。

图9 摘自《儿童肾母细胞瘤病理诊断共识》等
总结下,FBXW7基因检测在肾母细胞瘤乃至实体肿瘤中均值得关注。针对FBXW7基因的检测,我司有一系列推荐项目。如,仅针对FBXW7基因胚系检测的项目有:遗传性肿瘤105基因、遗传性肿瘤625基因。同时检测FBXW7基因胚系+体系突变的项目有:实体瘤201基因plus版、实体瘤1299基因等多个项目。全面助力临床诊疗,惠及患者及家人!
参考文献:
[1]He L, Torres-Lockhart K, Forster N, Ramakrishnan S, Greninger P, Garnett MJ, McDermott U, Rothenberg SM, Benes CH, Ellisen LW. Mcl-1 and FBW7 control a dominant survival pathway underlying HDAC and Bcl-2 inhibitor synergy in squamous cell carcinoma. Cancer Discov. 2013 Mar;3(3):324-37. doi: 10.1158/2159-8290.CD-12-0417. Epub 2012 Dec 28. PMID: 23274910; PMCID: PMC3595349.
[2]Chial, H. (2008) Tumor suppressor (TS) genes and the two-hit hypothesis. Nature Education 1(1):177
[3]Saito Y, Keino D, Kuroda Y, Enomoto Y, Naruto T, Tanaka Y, Tanaka M, Usui H, Kitagawa N, Yanagimachi M, Kurosawa K. Two-hit mutation causes Wilms tumor in an individual with FBXW7-related neurodevelopmental syndrome. J Hum Genet. 2024 Oct 16. doi: 10.1038/s10038-024-01299-6. Epub ahead of print. PMID: 39414990.
[4]中华医学会小儿外科学分会泌尿外科学组.儿童肾母细胞瘤诊疗专家共识[J].中华小儿外科杂志, 2020, 41(07):585-590.DOI:10.3760/cma.j.cn421158-20190805-00479.
[5]中国抗癌协会小儿肿瘤专业委员会,中华医学会小儿外科分会肿瘤学组,中国研究型医院学会儿童肿瘤专业委员会.中国儿童双侧肾母细胞瘤诊疗专家共识[J].中华小儿外科杂志, 2024, 45(11):961-977.DOI:10.3760/cma.j.cn421158-20240703-00306.
[6]NCCN Guidelines Version 2.2024 Comprehensive Cancer Wilms Tumor (Nephroblastoma)
[7]杨文萍,武海燕,张文,等.儿童肾母细胞瘤病理诊断共识[J].中华病理学杂志, 2017, 046(003):149-154.DOI:10.3760/cma.j.issn.0529-5807.2017.03.002.
[8]王金湖,蔡嘉斌,李民驹,等.儿童肾母细胞瘤国际及国内诊治方案解读[J].临床小儿外科杂志, 2020, 19(9):10.DOI:CNKI:SUN:LCXR.0.2020-09-003.



