2023CSCO指南会 |《ICIs临床应用指南2023版》更新解读(上)
时间:2023-04-25 10:21:56 热度:37.1℃ 作者:网络
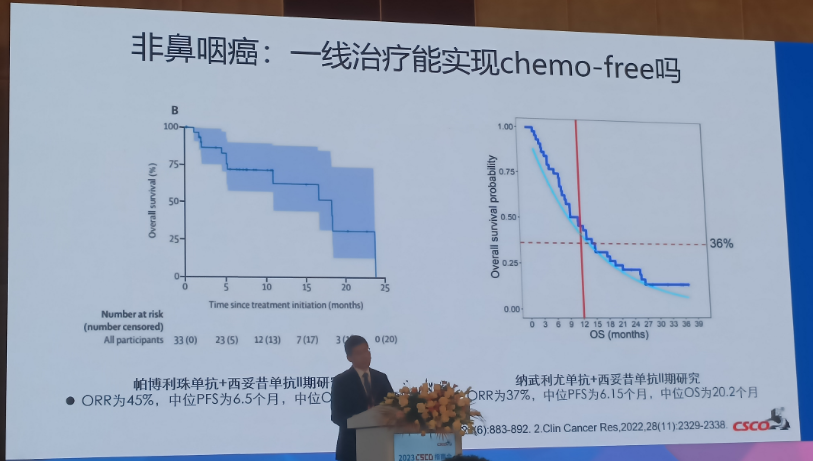
来源:找药宝典 为积极推动我国临床肿瘤学事业的发展、提高临床肿瘤医师的临床与科研水平,进一步促进CSCO诊疗指南的制定和推广,由中国临床肿瘤学会和北京市希思科临床肿瘤学研究基金会联合主办的2023年CSCO指南会于4月21-22日在广州隆重召开。大会开设多个专场,一众学术大咖对指南的更新要点、指南推荐建议进行解读。在免疫治疗专场,武汉大学人民医院章必成教授对《ICIs临床应用指南2023版》上半部分更新进行了解读。 1. 复发或转移性头颈部鳞癌 一线治疗: 非鼻咽癌III级推荐新增帕博利珠单抗+西妥昔单抗(2A类)和纳武利尤单抗+西妥昔单抗(2A类); 鼻咽癌治疗将替雷利珠单抗+吉西他滨+顺铂(1A类)调至I级推荐; 二线或挽救治疗: 鼻咽癌将特瑞普利单抗(2A类)和卡瑞丽珠单抗单抗(2A类)调至I级推荐。 更新解读: 非鼻咽癌一线治疗新增帕博利珠单抗+西妥昔单抗和纳武利尤单抗+西妥昔单抗是基于以下两个II期研究: 帕博利珠单抗+西妥普单抗ORR为45%,中位PFS为6.5个月,中位OS为18.4个月; 纳武利尤单抗+西妥昔单抗ORR为37%,中位PFS为6.15个月,中位OS为20.2个月。 

鼻咽癌的一线治疗属于国产PD1单抗三分天下的局面,基于CAPTAIN-1st、JUPITER-02和RATIONALE 309等研究,NMPA分别于2021年6月、2021年11月和2022年6月相继批准卡瑞利珠单抗、特瑞普利单抗和替雷利珠单抗联合化疗 (吉西他滨和顺铂作为一线方案治疗复发或转移性鼻咽癌。

2. 食管癌
晚期一线治疗:
I级推荐新增斯鲁利单抗+顺铂+5-FU (1A 类) 和替雷利珠单抗+顺铂/奥沙利铂+5-FU/紫杉醇 (1A 类),形成八王混战的局势;
晚期二线治疗:
将纳武利尤单抗(2A类)调至II级推荐;
辅助治疗:
将纳武利尤单抗(1A类)调至I级推荐。

基于ASTRUM-007研究,目前斯鲁利单抗联合化疗用于治疗食管鳞癌的上市注册申请已获得NMPA受理;
基于RATIONALE 306研究,目前替雷利珠单抗联合化疗用于治疗食管鳞癌的上市注册申请已获得NMPA受理。
3. 非小细胞肺癌
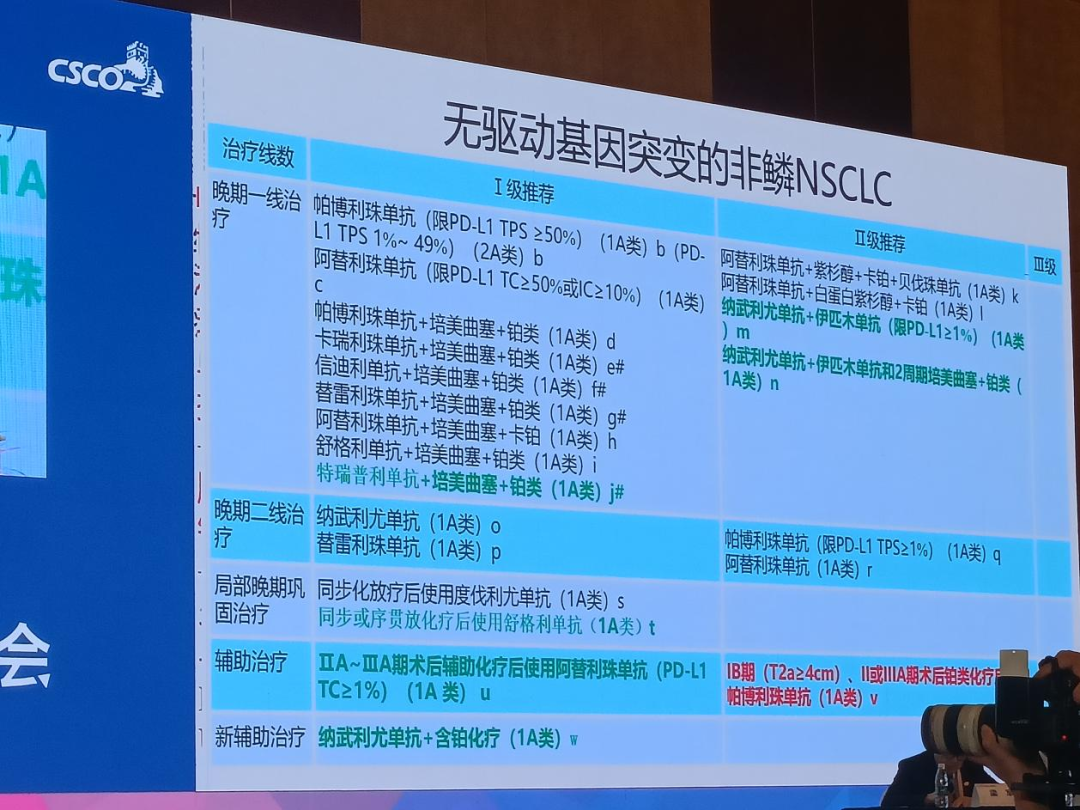
无驱动基因突变的非鳞NSCLC
晚期一线治疗:
将特瑞普利单抗+培美曲塞+铂类 (1A类)调至I 级推荐;
将纳武利尤单抗+伊匹木单抗 (限PD-L1≥ 1%) (1A类)和纳武利尤单抗+伊匹木单抗和2周期培美曲塞+铂类 (1A)调至 II级推荐;
局部晚期巩固治疗:
将同步或序贯放化疗后使用舒格利单抗调至I 级推荐;
II级推荐新增IB期 (T2a≥4cm)、II或IIIA期术后铂类化疗后使用博利珠单抗 (1A类);
辅助治疗:
将 IIA~IIIA期术后辅助化疗后使用阿替利珠单抗(PDL1TC≥ 1%) (1A类)调至I 级推荐;
新辅助治疗:
将纳武利尤单抗+含铂化疗 (1A类)调至I 级推荐。
鳞状NSCLC
晚期一线治疗:
将特瑞普利单抗+白蛋白紫杉醇+卡铂 (1A类)调至I 级推荐;
将纳武利尤单抗+伊匹木单抗 (限PD-L1≥ 1%) (1A类)和纳武利尤单抗+伊匹木单抗和2周期培美曲塞+铂类 (1A)调至 II级推荐;
局部晚期巩固治疗:
将同步或序贯放化疗后使用舒格利单抗调至I 级推荐;
II级推荐新增IB期 (T2a≥4cm)、II或IIIA期术后铂类化疗后使用博利珠单抗 (1A类);
辅助治疗:
将 IIA~IIIA期术后辅助化疗后使用阿替利珠单抗(PDL1TC≥ 1%) (1A类)调至I 级推荐;
新辅助治疗:
将纳武利尤单抗+含铂化疗 (1A类)调至I 级推荐。

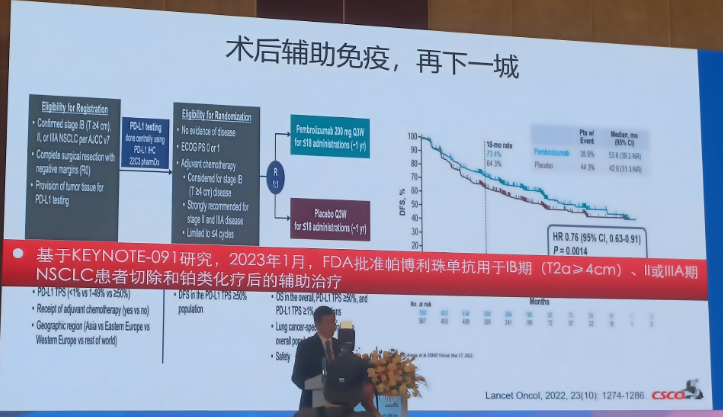
更新解读:
基于KEYNOTE-091研究,2023年1月,FDA批准帕博利珠单抗用于IB期 (T2a≥4cm) 、II或IIIA期NSCLC患者切除和铂类化疗后的辅助治疗;
驱动基因突变阳性的非鳞NSCLC
晚期二线及以上治疗:
II级推荐新增信迪利单抗+贝伐珠单抗类似物+化疗方案。

更新解读:
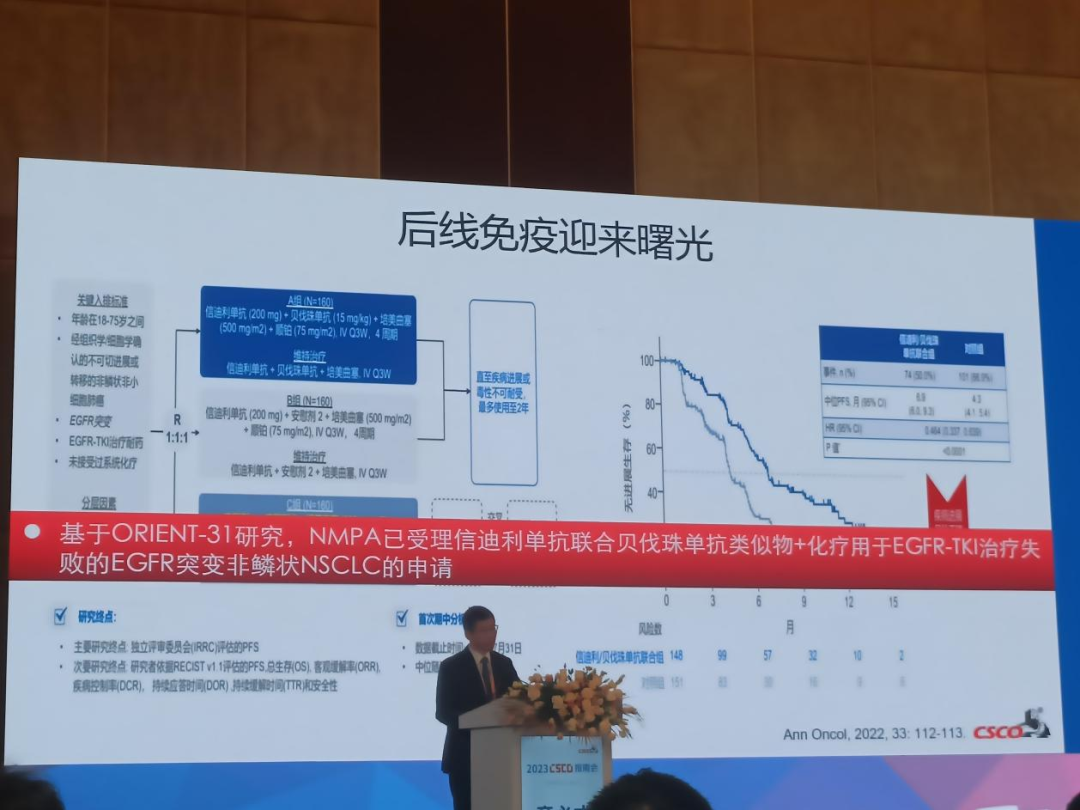
上海交通大学附属胸科医院陆舜教授牵头开展的ORIENT-31研究是一项随机、双盲、多中心、III期临床试验,在中国52家医院开展。纳入标准18-75岁局部晚期或转移性NSCLC、EGFR-TKIs治疗后进展EGFR突变阳性患者。2022年3月31日数据截止时,476例患者被随机分配至A组(信迪利单抗+ IBI305+化疗,n=158)、B组(信迪利单抗+安慰剂+化疗,n=158)、C 组(安慰剂1+安慰剂2+化疗,n=160),独立放射学审查委员会(IRRC)评估的A、B、C组的中位 PFS分别为7.2个月、5.5个月和4.3个月。与C组相比,B组的中位PFS显著提高(HR 0.723,95% CI:0.552,0.948;P = 0.0181)。由IRRC评估确认的 A、B、C组的客观缓解率(ORR)分别为 48.1%、34.8% 和 29.4%。三组的疾病控制率(DCR)分别为 86.1%、81.6%和75.6%;三组的中位缓解持续时间(DoR)分别为8.5个月、7.4个月和5.7个月。
基于ORIENT-31研究,NMPA已受理信迪利单抗联合贝伐珠单抗类似物+化疗用于EGFR-TKI治疗失败的EGFR突变非鳞状NSCLC的申请,后线治疗迎来曙光。
4. 广泛期小细胞肺癌
一线治疗I 级推荐新增斯鲁利单抗 +依托泊苷+卡铂 (1A 类)和阿得贝利单抗+依托泊苷+卡铂 (1A 类)。

更新解读:
基于ASTRUM-005研究2023年1月,NMPA批准斯鲁利单抗联合依托泊苷和卡铂用于ES-SCLC-线治疗;
基于CAPSTONE-1研究,2023年3月,NMPA批准阿得贝利单抗联合依托泊苷和卡铂用于ES-SCLC的一线治疗。
5. 晚期胸膜间皮瘤
治疗方案无更新,将章节标题胸膜间皮瘤改为晚期胸膜间皮瘤。

6. 乳腺癌
新辅助治疗、辅助治疗将PS 0-1、PD-L1 CPS≥20,早期三阴性乳腺癌,手术前4个周期帕博利珠单抗+紫杉醇+卡铂序贯4个周期帕博利珠单抗+多柔比星/表柔比星+环磷酰胺新辅助治疗,手术后9个周期帕博利珠单抗辅助治疗 (1A类) 调至I 级推荐。

更新解读:
2022年11月7日,NMPA批准帕博利珠单抗新适应证上市,联合化疗新辅助治疗并在手术后继续帕博利珠单抗单药辅助治疗,用于经充分验证的检测评估肿瘤表达PD-L1(综合阳性评分(CPS)≥20)的早期高危三阴性乳腺癌(TNBC)患者的治疗。
7. 晚期胃癌
晚期一线治疗(HER2阴性):
I 级推荐新增XELOX联合替雷利珠单抗 (PD-L1 评分≥5)(1A类) 方案;
III级推荐新增SOX/XELOX联合纳武利尤单抗 (2B类)方案。

更新解读:
基于RATIONALE 305研究,2023年2月,NMPA批准替雷利珠单抗联合氟尿嘧啶类和铂类药物化疗用于PD-L1高表达的局部晚期不可切除的或转移性的胃或胃食管结合部腺癌的一线治疗;
ATTRACTION-4研究(纳武利尤单抗联合化疗治疗HER2阴性晚期胃癌或胃-食管结合部癌的III期临床研究) 达到ITT人群的PFS和OS双终点。
8. 中晚期肝细胞癌
中晚期一线治疗:
将卡瑞利珠单抗+阿帕替尼 (1A类)调至I 级推荐;
II级推荐新增度伐利尤单抗 (1A类)和替雷利珠单抗 (1A类);
删除仑伐替尼+帕博利珠单抗或纳武利尤单抗一线治疗的III级推荐。

更新解读:
新增度伐利尤单抗和替雷利珠单抗为II级推荐是基于RATIONALE-301、HIMALAYA研究的成功。
9. 晚期胆道恶性肿瘤
晚期一线治疗可耐受强化疗的患者:
I 级推荐新增吉西他滨+顺铂+度伐利尤单抗 (1A类);
II级推荐新增帕博利珠单抗 (仅MSI-H/dMMR患者) (2B类) 方案和卡瑞利珠单抗+GEMOX或FOLFOX4 (2B类);
III级推荐新增GEMOX+仑伐替尼+特瑞普利单抗 (2B类) 。
晚期二线治疗PS≤1:
II级推荐新增帕博利珠单抗 (仅MSI-H/dMMR患者) (2A类)方案;
III级推荐新增纳武利尤单抗 (2B类) 、仑伐替尼+帕博利珠单抗 (2B类)、安罗替尼+信迪利单抗 (2B类)。
晚期二线治疗PS>2:
II级推荐新增帕博利珠单抗 (仅MSI-H/dMMR患者) (2A类)。

更新解读:
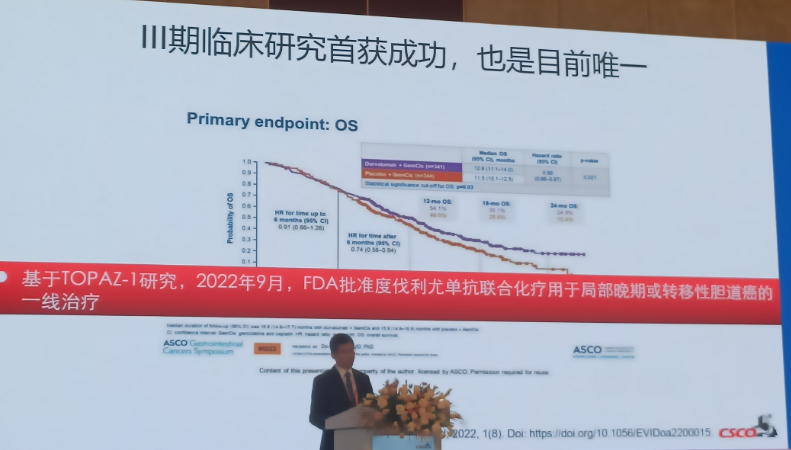
基于TOPAZ-1研究,2022年9月,FDA批准度伐利尤单抗联合化疗用于局部晚期或转移性胆道癌的一线治疗。
10. 结直肠癌
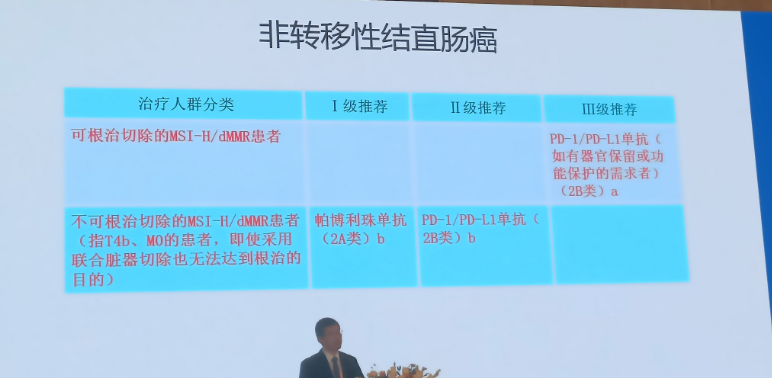
非转移性结直肠癌
可根治切除的MSI-H/dMMR患者:
III级推荐新增PD-1/PD-L1单抗(如有器官保留或功能保护的需求者)(2B类) ;
不可根治切除的MSI-H/dMMR患者(指T4b、MO的患者,即使采用联合脏器切除也无法达到根治的目的):
I 级推荐新增帕博利珠单抗(2A类);
II级推荐新增PD-1/PD-L1单抗 (2B类)。
更新解读:
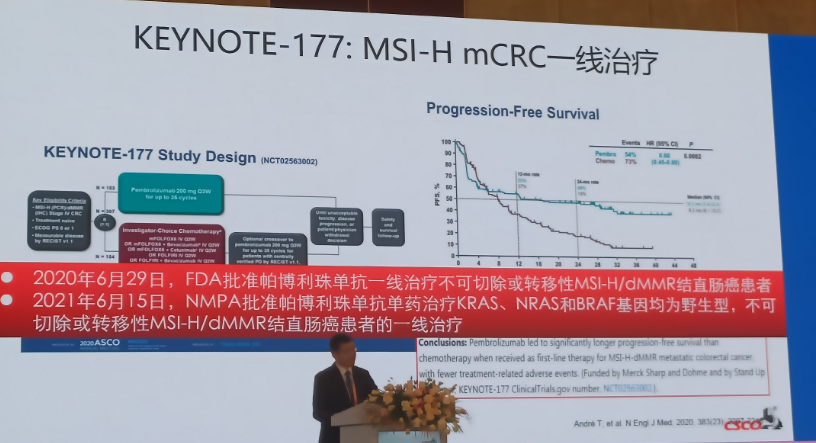
2020年6月29日,FDA批准帕博利珠单抗一线治疗不可切除或转移性MSI-H/dMMR结直肠癌患者;
2021年6月15日,NMPA批准帕博利珠单抗单药治疗KRAS、NRAS和BRAF基因均为野生型,不可切除或转移性MSI-H/dMMR结直肠癌患者的一线治疗。
转移性结直肠癌
MSI-H/dMMR晚期一线治疗:
III级推荐新增纳武利尤单抗+伊匹木单抗 (2B类);
MSI-H/dMMR晚期二线治疗 (一线未使用ICIs,无论一线治疗方案):
II级推荐新增纳武利尤单抗+伊匹木单抗 (2A类);
MSI-H/dMMR晚期三线治疗 (一二线未使用ICIs,无论一、二线治疗方案):
II级推荐新增纳武利尤单抗+伊匹木单抗 (2A类)。

更新解读:
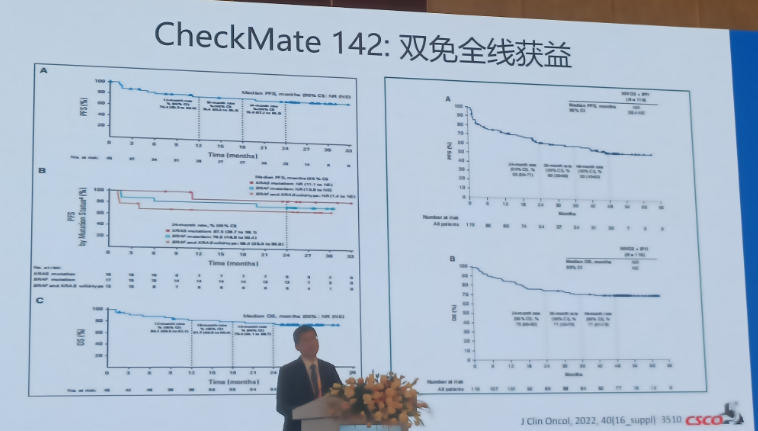
CheckMate 142是一项多中心、开放、非随机、多个队列的Ⅱ期临床试验,是目前结直肠癌领域最大规模的PD-1单抗和CTLA-4单抗双免联合治疗的一项队列研究,旨在评估纳武利尤单抗单药或纳武利尤单抗联合伊匹单抗治疗dMMR/MSI-H型mCRC的疗效和安全性。CheckMate142研究显示,治疗MSI-H/dMMR晚期结直肠癌,双免全线获益。