体外肺肾联合支持技术在液体过多中的治疗应用
时间:2023-06-28 23:05:05 热度:37.1℃ 作者:网络
在人工器官支持期间,肾脏损伤是多因素的,与接受体外膜肺氧合(ECMO)治疗的患者的严重程度有关。ECMO期间连续肾脏替代治疗(CRRT)的成功实施需要基于累积液体平衡和生理变量明确规定目标溶质清除率和液体清除率。CRRT的作用以及最佳时间、方式和剂量仍需澄清。
介绍
体外膜氧合技术(ECMO)是用于各种病因导致严重心脏或/和肺衰竭患者的一种生命支持治疗方法,已经得到广泛认可。当其他常规治疗策略失败时,ECMO是一种有效的治疗方法(Eckman等人,2019年)。ECMO是通过替代心脏、肺的功能,使心脏、肺功能得已恢复的治疗方法。
根据体外生命支持组织(ELSO)登记,ECMO患者存在急性肾损伤(AKI)的高风险;在特定人群(即患有先天性膈疝或先天性心脏病的新生儿)中,发病率从20%到高达85%不等。这种报告发病率的高差异是基于患者特征、临床环境和使用不同方法概述AKI的差异(Ostermann and Lumlertgul 2021)。
在器官支持治疗过程中,肾脏损伤是多因素的,特别是与接受ECMO和肺-肾治疗的患者的高严重程度相关(Gu et al. 2021)。事实上,导致AKI在ECMO管路系统中的相关危险因素包括非脉动血流、血液暴露于ECMO管路表面、红细胞应激、溶血、出血、凝血功能障碍、肢体缺血和感染。更重要的是,需要高血流量ECMO的患者特别容易发生液体过负荷(FO),这与长期使用ECMO和AKI相关(Patil和Salunke 2020)。
液体平衡(FB)是重症监护治疗的一个基本方面,在重症监护中,FO与预后差之间的关联被广泛认可(Samoni et al. 2016)。因此,个体化的容量评估、液体平衡策略,是患者管理的一个中心和关键内容(Kalantari et al. 2013)。虽然容量复苏策略对于血管内容量保存和器官灌注是必不可少的,但盐和水摄入过量可导致组织水肿,增加静脉压,从而导致肾血流改变,导致持续的器官功能障碍(Ostermann et al. 2014)。然而,FO对肺功能和肺功能的恢复都有众所周知的负面影响。严格的FB评估可以允许给予足够的营养和血液生产,避免进一步的液体积累和较少的利尿剂摄入量。因此,限制性的液体管理和预防或治疗FO的策略对危重症患者至关重要,对ECMO患者也是如此(Silversides,2017年)。
ECMO期间肾脏替代治疗(RRT)的主要指征为预防FO(16%)、治疗FO(43%)、AKI(35%)和电解质失衡(4%)(Fleming et al. 2012)。ECMO期间的RRT通常是一种连续的模式(CRRT),因为这类患者具有血流动力学不稳定的特征。CRRT允许在更长的时间内进行更稳定和可靠的液体分配和电解质调整。ECMO和CRRT可以结合在两种主要的方式中;并联方法与集成应用(Martins-Costa等人,2022年)。这些方式的选择通常受到当地经验和技术可用性的影响。这两种技术都有优点和缺点,在CRRT启动之前了解这类技术的缺点和潜力至关重要(Ostermann等人,2018年)。
ECMO期间有效提供CRRT的中心方面是明确的目标溶质清除和液体清除率,并根据患者不断变化的需求定期重新评估和重新调整处方(Tandukar and Palesvsky )。最后,虽然AKI和FO对ECMO患者预后的有害影响是清楚的,但值得进一步研究的关键问题仍然是关于设备、方式和启动的最佳时间。
危重症监护中的液体平衡
在ECMO患者中,液体管理对于预防液体过负荷等并发症至关重要,这些并发症可导致水肿、低氧血症和增加死亡率。特别是,正液体平衡导致死亡率增加,尤其是潜在心血管和肾脏疾病患者(Mal等,2014年;Neyra等,2016年)。有几个因素导致了液体过负荷,其后果是多系统的。因此,恢复正常血容量是重症监护环境中的一个重要目标(Kim et al. 2022)。FO也被证明可以增加机械通气的长度、AKI的时间、CRRT的需要、感染和腹腔内高血压的风险(Salahuddin et al. 2017)。AKI、少尿、正压机械通气、钠和水的应激反应保留、腹腔室综合征和医源性同时液体负荷是FO的潜在危险因素(Wang et al. 2015)。与此同时,流体平衡评估不足和流体卸载策略不足可能会加剧液体潴留。
过量的液体潴留会导致组织间隙的扩张和静脉充血的增加。由此产生的平均循环充盈压升高和循环系统透壁压力的改变导致组织水肿、严重的低白蛋白血症、炎症性毛细血管渗漏和淋巴引流受损,进而损害腹内压力、心功能和肺气体交换,并降低肺顺应性,增加呼吸肌做功,可能导致多器官衰竭(Monnet和Teboul 2018)。此外,静脉充血和腹内压力升高是公认的发展危险因素,对液体清除具有巨大的影响。静脉压的增加改变了肾血流,随之产生了肾小球滤过率(Doty et al. 1999)。
为了根据患者的需要调整液体平衡,在不同的临床情况下(例如复苏与复苏后阶段)制定特定的治疗策略以预防或治疗FO也至关重要(Ramesh等人,2019)。在重症监护环境中,患者的具体需求可能会迅速变化,有时可能会存在疾病与补液量冲突的情况(Malbrain et al. 2018)。事实上,在急性“复苏”阶段,液体管理是必要性的,以达到血流动力学目标。更重要的是,为了满足营养需求或药物剂量目标,经常需要大量的液体。在所有这些情况下,CRRT可能是一种重要的辅助手段,通过连续操作将多余体液排出。即使没有关于最佳启动时间和CRRT模式的可靠结论,CRRT也可以满足临床医生评估患者液体需求的动态变化水平(Prowle和Mehta 2021)。临床医生必须根据满足个体化方案所需血流动力学和容量状况调整液体用药量,每隔一定时间评估需要排出的液体总量(Neyra et al. 2022)。为了提供精确的液体管理治疗,CRRT不仅可以调节液体总出量,还可以调节液体清除的速度(Murugan et al. 2016)。这对血流动力学不稳定的危重病人尤其重要,也能维持生理血浆总入量。
最后,另一个需要考虑的重要方面是,静脉给药对于维持CRRT回路本身的通畅是很重要的。在过滤器之前给药(预稀释)可以保持电路的完整性并防止凝块的形成。通过改变超滤速率和替代液,可以实现液体平衡,同时要记住,流出水量的变化会影响溶质清除率(剂量)(Claure-Del Granado和Clark 2021)。持续心电监测对于CRRT的安全实施和患者安全至关重要。
ECMO患者的液体状态评估
液体状态评估是接受ECMO治疗的患者管理的重要组成部分(Freitag et al. 2010)。尽管临床检查包括对患者进行身体检查,以寻找体液负荷重的证据,但在危重患者中,精确的体液评估和记录是极具挑战性的。每日体重可能是评估体外多器官支持患者体液状态的重要工具,但有必要记录“干体重”(即液体复苏前的体重),目标是从细胞外容积恢复到正常(干体重)。
有几种公式可用于评估ECMO患者的体液评估。液体平衡可以通过从总液体入量(口服、静脉、肠内)中减去总液体出量(尿输出、昏迷损失、引流)来计算。净液体平衡可以通过从总液体输入中减去超滤或血液过滤去除的液体量来计算。这个公式可以帮助我们有效的评估清除多余体液的具体量。此外,累积液体平衡可以评估为规定期间(如24小时或48小时)内每日液体平衡的总和。这个公式可以帮助评估一段时间内出入量的趋势。细胞外液容量(ECFV)也可以通过体重×(1-红细胞压积)×0.9来确定。该公式假设红细胞压积是对血管内体积的良好估计。值得注意的是,这些公式应与临床检查和其他监测方法结合应用,以准确评估ECMO患者的容量状态。然而,血流动力学监测可以帮助确定容量状态和指导体液管理。
事实上,评估液体反应性对于避免不必要的液体给药、降低肾功能衰竭的风险和改善危重患者的预后非常重要。尽管脉压变化和每搏输出量变化能准确预测机械通气期间的液体反应性,但遗憾的是,关于ECMO患者的液体反应性评估的证据很少(Yang and Du 2014; Jozwiak
et al. 2018)。罗等人(2021)发现Trendelenburg操作引起的左心室流出道速度-时间积分(ΔVTI)的变化可以有效地预测VA-ECMO患者的液体反应性。
床旁超声可用于评价ECMO患者的体液状态。通过无创超声操作评估皮肤组织厚度,为液体转移到血管外空间似乎提供了进一步的信息,并指导液体管理(Sarvazyan等,2005;Wagner and Cotter 2021)。利用线性阵列探头测量跟骨区真皮表层与骨组织界面之间的距离来评估间质厚度也是确定是否存在水肿的方法之一。在四个不同的身体区域(即上前胸、外侧胸、外侧腹部和前紧肌)测量皮肤表面到脂肪-肌肉边界之间的皮下组织深度可能是估计FB的另一个工具。这些方法,即使特别有趣,仍然需要进一步评估。
显然,在过去的几年中,用来评估容积状态的监测点超声(POCUS)在重症监护专科医师的液体管理中发挥了巨大的作用(Argaiz et al. 2021)。然而,尽管评估下腔静脉的塌陷和胸腔积液的存在可以帮助识别液体过负荷,使用VV-ECMO和VA-ECMO总是使用半刚性中心静脉插管(s)占据下腔静脉(IVC)的部分范围,从而限制下腔静脉塌陷(Via et al. 2016)。
此外,静脉负压会影响下腔静脉的大小和呼吸动力学,压迫/占据血管的肿块、腔静脉滤过物或下腔静脉血栓形成同样会影响下腔静脉的生理通畅和大小。然而,对LUS和超声血流动力学评估(即下腔静脉塌陷指数-IVC CI)在液体管理中的作用的深入描述超出了本文的范围。
生物电阻抗矢量分析(BIVA)可能是一种可行的有前途的工具,包括测量电阻来评估人体组成,包括细胞外液量(Samoni et al. 2016; Basso et al. 2013)。虽然BIVA可以更早地反映液体过载状态,以及由于液体平衡计算而产生的旁路误差,但在ECMO和综合系统设置中,它并没有得到很好的研究(Wang et al. 2021)。
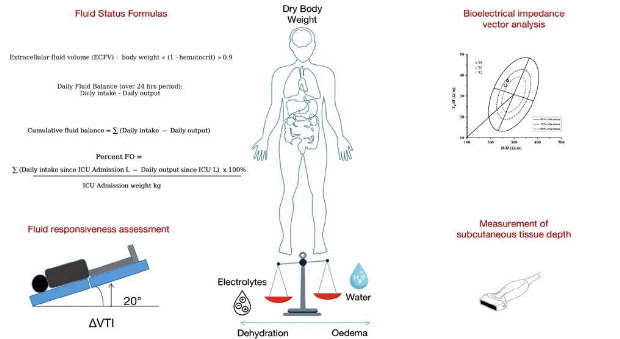
图1 液体平衡和过负荷测定的评估方法
ECMO患者的液体过量
由于基础疾病的严重程度和回路的固有特性,接受ECMO治疗的患者可能需要接受大量晶体液和血液制品(Chiu et al. 2021)。为了维持足够的体外膜肺氧合(ECMO)血管引流率,临床医生经常给予大量液体,特别是在ECMO的初始阶段;更重要的是,由于治疗过程中可能出现的几种并发症(如出血、贫血、凝血功能障碍),患者也经常接受大量的血液制品。液体管理对于维持ECMO回路的通畅和防止回路过早改变具有重要意义。ECMO期间这种宽松的补液方法加剧了基础疾病,通常表现为全身性低血容量状态。更重要的是,血液暴露于ECMO回路的人工表面,可加重全身毛细血管渗漏,从而增加间质和组织水肿。更糟糕的是,ECMO患者伴随AKI的高患病率,减少了液体输出,加重了液体超负荷(Cheng et al. 2014)。
更糟糕的是,ECMO患者伴随AKI的高患病率,减少了液体输出,加重了液体超负荷。ECMO期间FO与ECMO持续时间延长和死亡率相关(Selewskietal. 2017)。从现有文献中得出的另一个重要方面是,一定比例的ECMO患者(高达50%)在ECMO插管前出现FO, CRRT开始时较高水平的FO与死亡率增加和ECMO持续时间增加有关。因此,ecmo前液体平衡是一种重要的目标干预措施。此外,He et al(2018)发现,ECMO启动第三天的液体平衡和CRRT开始时的乳酸水平都是接受ECMO时进行CRRT患者预后的独立危险因素。因此,即使容量复苏是基本策略,特别是在ECMO治疗开始时,过多的容量超负荷会影响生存和结局(Schmidt et al. 2014)。然而,要找到一个具体的阈值仍然是一个挑战。从这个角度来看,体液平衡特定阈值(mL/kg)与死亡率之间可能存在的相关性值得进一步研究(Kim et al. 2018)。更重要的是,评估阈值是否会根据ECMO治疗的适应症(即心血管疾病与呼吸系统疾病)而出现差异,这将是一件有趣的事情。
预防或治疗这类患者的FO需要积极使用利尿剂,并可能产生副作用,或限制液体的摄入导致理想热量摄入的减少。因此,在ECMO期间添加CRRT可以减少利尿剂的使用,并实现精确的营养目标。然而,在这组患者中,在最佳时机、剂量处方目标和理想模式技术方面仍存在一些悬而未决的问题(Paek et al. 2018)。
然而,FO是接受ECMO治疗的儿科患者的常见并发症,它可能导致严重的后果,如肺水肿、氧气输送减少和死亡率增加。在ECMO治疗期间,超过75%的患者液体平衡为正,这表明FO和实现液体平衡为负的能力是潜在的重要治疗目标(Selewski et al. 2017; Sakurai and Singhal 2022)。在ECMO中实现液体负平衡的能力与生存率的提高相关。CRRT在液体管理方面提供了灵活性和控制性,并已被证明可以在ECMO期间实现干体重和液体负平衡的能力(Rajapreyar et al. 2021)。
结合本研究中FO的流行病学及其与不良结果的独立关联,这些结果表明,利用CRRT来管理ECMO患儿的液体可能是有必要的,并且可能需要早期干预。虽然这些研究为使用ECMO-CRRT综合系统管理儿科人群体液超载提供了一些证据,但需要更大规模的随机对照试验来确定这种方法的安全性和有效性。同时,应密切监测ECMO患儿的液体管理,并应采取多学科团队方法来改善患者预后。表1显示了评估重症患者体液超载和综合系统的研究。
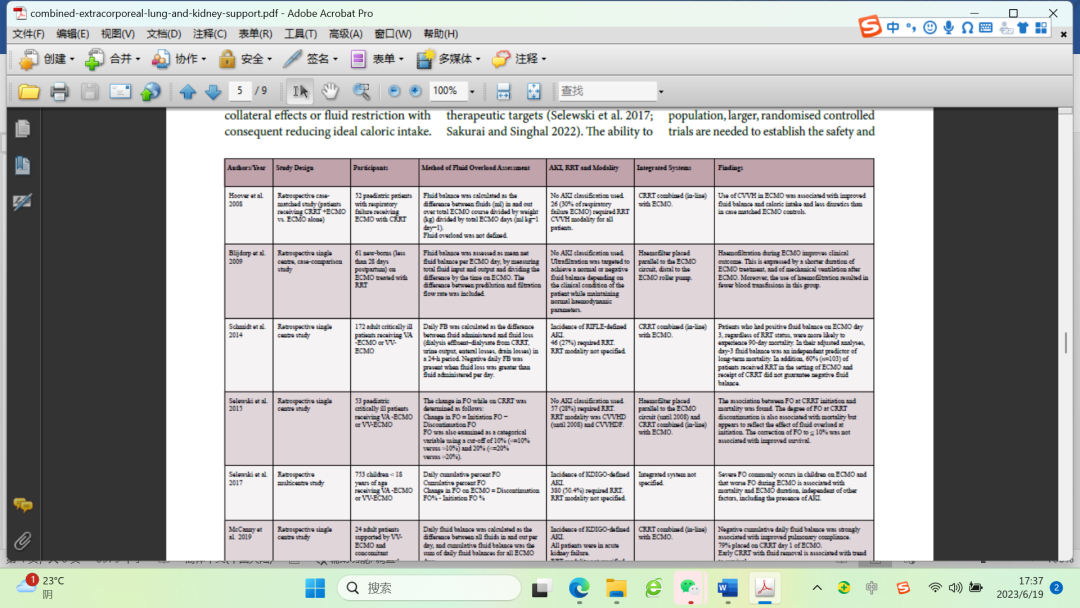
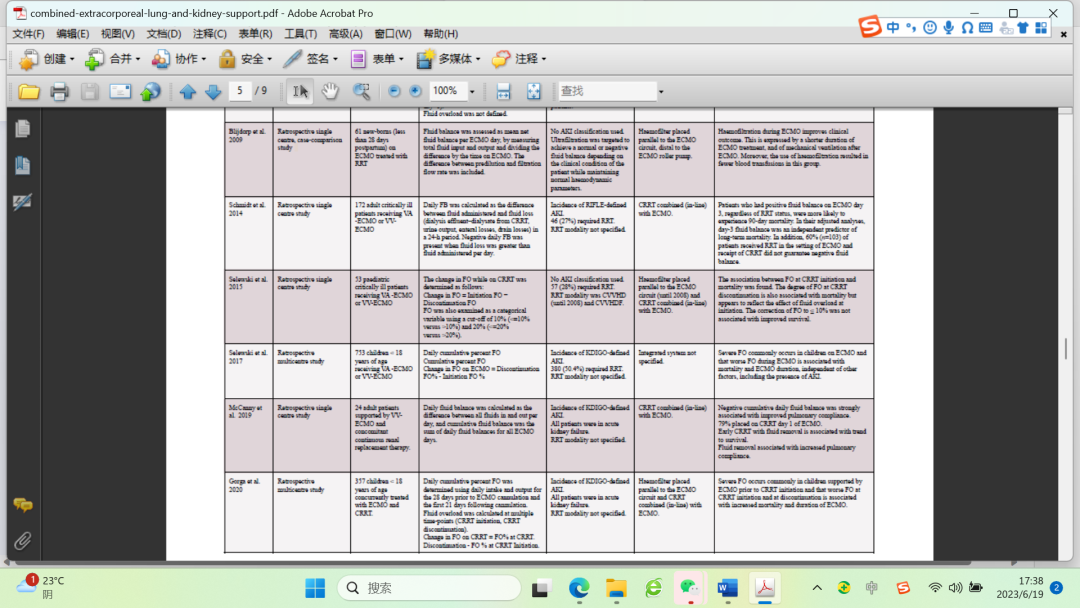
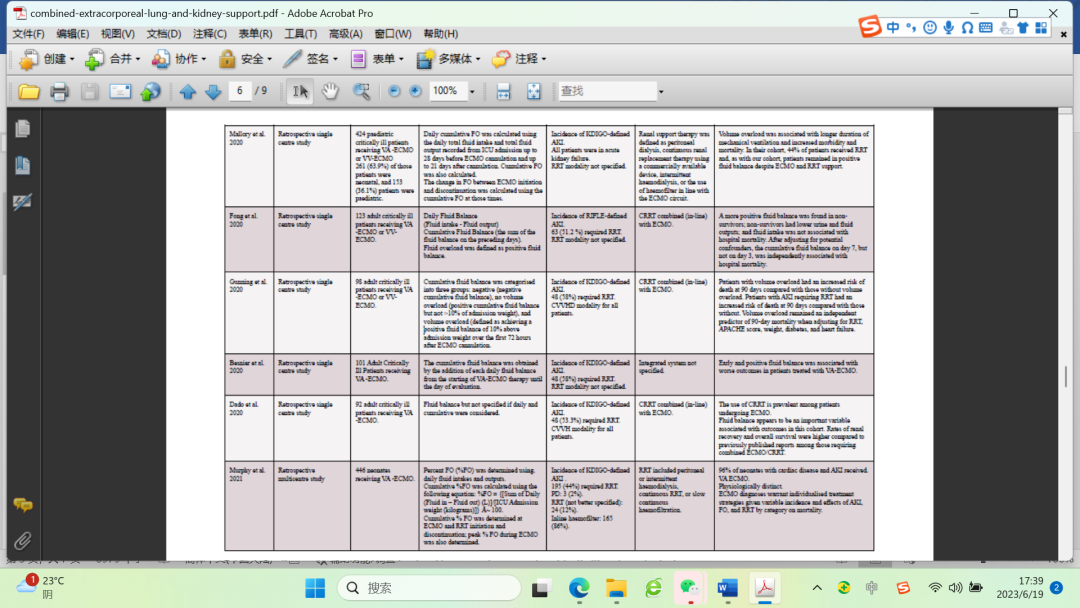
表1过去几年中评估危重患者液体过负荷和综合系统的研究。
AKI急性肾损伤;APACHE II评分,急性生理和慢性健康评估;CRRT连续肾脏替代疗法;CVVH连续静脉-静脉血液滤过;CVVHD连续静脉-静脉血液透析;FO,流体过载;KDIGO肾脏疾病改善全球结果;RIFLE、风险、损伤、衰竭、肾功能丧失和终末期肾病;RRT肾替代疗法;VA-ECMO静脉-动脉体外膜肺氧合;VV-ECMO,静脉-静脉体外膜肺氧合
集成系统的指示和模式
ECMO-CRRT整合系统的适应症包括需要呼吸和CRRT治疗的严重急性呼吸窘迫综合征(ARDS)和AKI,需要同时进行ECMO和肾脏支持的心脏骤停、脓毒症或多器官衰竭,以及用于稳定血流动力学及代谢。
在ECMO期间,可通过引入一个血液过滤器或RRT回路,或通过一个单独的导管分别引入ECMO回路(集成系统)和回路(并联系统)来提供RRT。并行系统不是本文探讨的目的。
ECMO-CRRT集成系统通常有以下三种不同的配置方式:
1.串联血液过滤器(图2,分图A),滤器通常连接在ECMO回路中的氧合器之后,以避免相互渗透和透析。过滤器入口为回路,允许连续超滤。在这种形式中,CRRT回路与带有气体交换和出口的ECMO串联连接被重新连接到ECMO回路上,以允许血液在置换液或透析液进入充氧器之前返回;静脉泵允许控制液体排出;液体置换或透析可以允许额外的溶质清除。
2.并连(图2,分图B和C):在这种模式中,ECMO和CRRT回路并排布置,具有共同的静脉通路和共同的动脉回流,也可以通过氧合器的入口和出口上的现有鲁尔接头。它需要更大的占地面积和更复杂的管道布置。不需要单独的血管通路和抗凝治疗。这种模式允许控制回路内的压力,但也可以实现更高的超滤速率,而不需要具有更好溶质清除率的外部泵(Chen等人,2014)。然而,并不是所有的设备都能识别导致治疗反复停止和中断的压力变化。此外,ECMO电动泵后的集成可能会引发高压警报(de Tymowski等人,2017)。因此,由于两个集成管路具有两个不同的压力水平,压力差可能会导致ECMO管路内部出现分流效应的极端危险情况。整合是可能的,强烈建议血液在氧合器之前返回ECMO回路。选择的模式应仅由训练有素的医疗保健人员执行,整合系统需要两方面的专业知识。ECMO-CRRT的使用结合了患者的具体需求、可用的ECMO和CRRT疗法以及专业人。
集成系统对结果的影响
没有强有力的建议来改变ECMO患者的结果,这个决定取决于当地的专家在ECMO期间的最佳RRT模式和可用性。CRRT在改变ECMO患者预后中的作用仍不确定。
几篇发表的文章发现,接受ECMO和CRRT治疗的患者死亡率比仅接受ECMO治疗的患者高(Chen et al. 2014;Mitra et al. 2021;Han et al. 2015)。但是,要谨慎解读这个结果。首先,AKI本身的严重程度的影响可能是重要的,要强调的是,这一数据有助于要求RRT与其他此类脆弱患者相关的死亡率增加。更重要的是,AKI治疗并发症(例如脓毒症、免疫缺陷、肝功能衰竭、出血、神经并发症)增加了ECMO患者基础疾病的严重性。然而,必须考虑到初始的高度异质性、FO评估模式和AKI定义的差异。此外,没有明确的证据表明不同的策略(即并联、整合)可能会影响死亡率或ECMO持续时间。值得注意的是,与疾病严重程度相匹配的病因学是困难的,因此,即使对ECMO患者AKI的研究是多因素的,也难以得出任何可靠的结论s (Martins Costa et al. 2022)。ECMO的AKI患者死亡的主要危险因素包括但不限于年龄、AKI阶段、RRT持续时间、高碳酸血症、多器官衰竭综合征、失血、输血需求、血液动力学不稳定、肝功能衰竭和液体超负荷(Ostermann和Lumlertgul 2021)。
ECMO期间CRRT相关并发症
可能发生在套管的血管放置过程中(例如,出血、气胸、血胸、腹膜后出血、血管损伤、动脉穿刺、瘘管形成)和在治疗本身(例如,心律失常、低钾血症、垂体炎、体温过低、营养损失,溶血、颅内出血和胃肠道出血)。必须特别注意在治疗几个过程中防止空气进入可能出现的栓塞(中心线插入、连接/断开CRRT、ECMO和CRRT系统中输液和流量变化及压力和流量的相互作用)。另一个至关重要的方面为严格控制抗凝方案(例如,系统、局部)以防止血栓形成、出血、电路过早凝固,以增加电路通畅性。然而,在2014年的一项系统综述中,作者发现ECMO和CRRT系统的集成似乎安全有效,可以改善血流动力学和电解质紊乱。
技术问题
在开始治疗之前,已知ECMO期间CRRT执行的每个特定模态系统有固定的优点和缺点。深入了解内部管路压力和流量可以保证治疗期间的安全。集成系统的特点是滤器的引入或CRRT机器插入ECMO管路。滤器的引入需要实行与ECMO并联的方法,然而ECMO回路的特点是在回路引血部分是负压下工作(例如,-20至-100mmHg),泵和氧合器之间以及氧合器和患者之间是正压状态。相反,CRRT机器通常在约0至30mmHg的静脉压力(来自患者和到达患者)下工作,此外,ECMO回路内的流量(3500-5000ml/min)高于CRRT系统中的流量(100-200mL/min)。压力和流量的差异可能引起并发症,表现为空气滞留、湍流、溶血、剪切应力增加、警报超出范围。串联系统的另一个重要含义是,由于部分串联系统需要外部输液泵以及回路内管路分支,因此难以进行超滤评估,这导致了处方和实际超滤率之间的不同,在ECMO回路中使用CRRT可以避免这个问题。CRRT回路允许在没有外部泵的情况下控制压力和超滤,更精确地控制排水量。然而,同样在这种情况下,压力报警器和连接管路可能会出现问题,从而导致治疗中断或出现并发症,例如空气栓塞和湍流。不容低估的是,在ECMO内引入集成系统,带有分支导管的系统负责ECMO回路的血液分流,从而导致氧合和血流的潜在变化。
当然,这种技术方面和可能的复杂性在并行系统中是不会遇到的,并行系统的特点是有一个独立的管路来提供ECMO或CRRT模式。在并行方法中,ECMO和CRRT技术之间不会相互干扰,CRRT可以独立于ECMO进行处方计算和监测,不容低估的是CRRT治疗可以在风险较小的情况下完成,而无需ECMO专家参与。然而,由于需要单独的血管通路,可能会导致出血、感染和血栓形成;甚至,使用血管部位进行CRRT需要额外插管以获得更高的ECMO治疗输出,减少了进入部位的选择。此外,使用一个独立的回路增加了人体表面的激活凝血级联反应、全身炎症反应、剪切应力和溶血的风险。为了避免上述问题,目前正在开发新型体外装置,特别关注纤维的排列、过滤模式、人造(滤器,译者理解)表面特性和连接方式。
结论
ECMO期间CRRT的成功实施是基于液体平衡的目标、溶质清除率和液体清除率的血液净化处方。基于患者的需求,治疗监测和重新调整是必要的,而有害的AKI和FO对ECMO患者预后的影响是明确的,需要进一步研究的关键问题仍然是关于CRRT在患者管理中的作用,
包括设备、模态,启动的最佳时机和生理变量(血流动力学、氧合)。


